2023·河南郑州·二模
名校
解题方法
1 . 2023年1月30日,中国科学院朱庆山团队研究六方相砷化镍(NiAs)型到正交相磷化锰(MnP)型结构转变,实现了对锂硫催化剂的精确设计。回答下列问题:
(1)Li、P、S三种元素中,电负性最小的是___________ 。第三周期元素中第一电离能比P大的元素有___________ 种。
(2)基态S原子核外有___________ 个电子自旋状态相同。基态As原子的电子排布式为___________ 。
(3)PH3、AsH3中沸点较高的是___________ ,其主要原因是___________ 。
(4)Mn的一种配合物化学式为[Mn(CO)5(CH3CN)],该配合物中锰原子的配位数为___________ 。
(5)CH3CN中C原子的杂化类型为___________ 。
(6)等物质的量的CH3CN和CO中,π键数目之比___________ 。
(7)NiAs的一种晶胞结构如图所示。若阿伏加德罗常数的值为NA,晶体的密度为ρ g/cm3,则该晶胞中最近的砷原子之间的距离为___________ pm。

(1)Li、P、S三种元素中,电负性最小的是
(2)基态S原子核外有
(3)PH3、AsH3中沸点较高的是
(4)Mn的一种配合物化学式为[Mn(CO)5(CH3CN)],该配合物中锰原子的配位数为
(5)CH3CN中C原子的杂化类型为
(6)等物质的量的CH3CN和CO中,π键数目之比
(7)NiAs的一种晶胞结构如图所示。若阿伏加德罗常数的值为NA,晶体的密度为ρ g/cm3,则该晶胞中最近的砷原子之间的距离为

您最近一年使用:0次
2023-04-06更新
|
736次组卷
|
4卷引用:化学-2023年高考押题预测卷03(山东卷)(含考试版、全解全析、参考答案、答题卡)
(已下线)化学-2023年高考押题预测卷03(山东卷)(含考试版、全解全析、参考答案、答题卡)河南省郑州市2023届高三下学期第二次质量预测理科综合化学试题(已下线)考点43 晶体结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)甘肃省武威第一中学2023-2024学年高三上学期第三次月考化学试题
名校
解题方法
2 . 碘及其化合物在生产、生活中有着广泛的应用。回答下列问题:
电负性:H 2.20;C 2.55;F 3.98;P 2.19;I 2.66
(1)人工合成的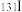 是医疗上常用的放射性同位素,碘在周期表中的位置是
是医疗上常用的放射性同位素,碘在周期表中的位置是_______ 。
(2)碘单质在 中的溶解度比在水中的大,解释原因
中的溶解度比在水中的大,解释原因_______ 。
(3)HI主要用于药物合成,通常用 和P反应生成
和P反应生成 ,
, 再水解制备HI.
再水解制备HI. 的空间结构是
的空间结构是_______ , 水解生成HI的化学方程式是
水解生成HI的化学方程式是_______ 。
(4) 是一种甲基化试剂,
是一种甲基化试剂, 可用作制冷剂,
可用作制冷剂, 和
和 发生水解时的主要反应分别是:
发生水解时的主要反应分别是: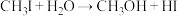 和
和 。
。 的水解产物是HIO,结合电负性解释原因
的水解产物是HIO,结合电负性解释原因_______ 。
(5) 晶体是一种性能良好的光学材料,其晶胞为立方体,边长为a nm,晶胞中K、I、O分别处于顶点、体心、面心位置,结构如下图。
晶体是一种性能良好的光学材料,其晶胞为立方体,边长为a nm,晶胞中K、I、O分别处于顶点、体心、面心位置,结构如下图。
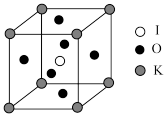
①与K原子紧邻的O原子有_______ 个。
② 的摩尔质量为214g/mol,阿伏加德罗常数为
的摩尔质量为214g/mol,阿伏加德罗常数为 。该晶体的密度是
。该晶体的密度是_______ 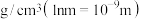 。
。
电负性:H 2.20;C 2.55;F 3.98;P 2.19;I 2.66
(1)人工合成的
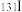 是医疗上常用的放射性同位素,碘在周期表中的位置是
是医疗上常用的放射性同位素,碘在周期表中的位置是(2)碘单质在
 中的溶解度比在水中的大,解释原因
中的溶解度比在水中的大,解释原因(3)HI主要用于药物合成,通常用
 和P反应生成
和P反应生成 ,
, 再水解制备HI.
再水解制备HI. 的空间结构是
的空间结构是 水解生成HI的化学方程式是
水解生成HI的化学方程式是(4)
 是一种甲基化试剂,
是一种甲基化试剂, 可用作制冷剂,
可用作制冷剂, 和
和 发生水解时的主要反应分别是:
发生水解时的主要反应分别是: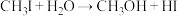 和
和 。
。 的水解产物是HIO,结合电负性解释原因
的水解产物是HIO,结合电负性解释原因(5)
 晶体是一种性能良好的光学材料,其晶胞为立方体,边长为a nm,晶胞中K、I、O分别处于顶点、体心、面心位置,结构如下图。
晶体是一种性能良好的光学材料,其晶胞为立方体,边长为a nm,晶胞中K、I、O分别处于顶点、体心、面心位置,结构如下图。
①与K原子紧邻的O原子有
②
 的摩尔质量为214g/mol,阿伏加德罗常数为
的摩尔质量为214g/mol,阿伏加德罗常数为 。该晶体的密度是
。该晶体的密度是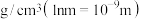 。
。
您最近一年使用:0次
2023-03-17更新
|
628次组卷
|
6卷引用:山东省青岛第二中学2023-2024学年高三上学期期中考试化学试卷
名校
解题方法
3 . 在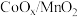 催化下醇的氧化氰化反应如图所示。下列叙述正确的是
催化下醇的氧化氰化反应如图所示。下列叙述正确的是

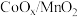 催化下醇的氧化氰化反应如图所示。下列叙述正确的是
催化下醇的氧化氰化反应如图所示。下列叙述正确的是
A.熔点: | B.键角: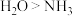 |
C.I和II分子中 键数目相同 键数目相同 | D.II含有的元素中 的电负性最大 的电负性最大 |
您最近一年使用:0次
2023-03-16更新
|
2417次组卷
|
4卷引用:山东省菏泽市曹县第一中学2022-2023学年高二下学期3月月考化学试题
名校
解题方法
4 . 硒化锌是一种重要的半导体材料;其晶胞结构如图甲所示,已知晶胞参数为pnm,乙图为晶胞的俯视图,下列说法正确的是
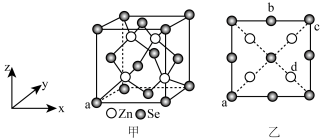
| A.晶胞中硒原子的配位数为12 |
B.晶胞中d点原子分数坐标为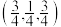 |
C.相邻两个Zn原子的最短距离为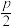 nm nm |
| D.电负性:Zn>Se |
您最近一年使用:0次
2023-03-03更新
|
1858次组卷
|
11卷引用:山东省济宁市2023届高三一模考试(3月)化学试题
山东省济宁市2023届高三一模考试(3月)化学试题山东省德州市第一中学2022-2023学年高二下学期3月月考化学试题山东省烟台市第一中学2023-2024学年高三下学期3月月考化学试题山东省临沂市第二十四中学2023-2024学年高二下学期3月学科素养水平监测化学试题(已下线)湖北省七市(州)2023届高三3月联合统一调研测试化学试题变式题(选择题11-15)河南省郑州市六校联盟2022-2023学年高二下学期4月期中考试化学试题(已下线)专题十 晶胞示意图(练)福建省龙岩市连城县第一中学2022-2023学年高二下学期5月月考化学试题河北省张家口市宣化第一中学2023届高三模拟试题(三)化学试题河南省驻马店市环际大联考2022-2023学年高二下学期4月期中考试化学试题(已下线)热点08 金属晶体和离子晶体
5 . 回答下列问题:
(1)化合物III也是一种汞解毒剂。化合物IV是一种强酸。下列说法正确的有_____ 。

A.在I中S原子采取sp3杂化
B.在II中S元素的电负性最大
C.在III中C-C-C键角是180°
D.在III中存在离子键与共价键
E.在IV中硫氧键的键能均相等
(2)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物I与化合物III相比,水溶性较好的是_____ 。
(3)NH3、PH3、AsH3分子的键角分别为107.3°、93.3°、91.8°,其键角逐渐减小的原因是____ 。
(4) 中含有各元素的电负性由小到大的顺序为
中含有各元素的电负性由小到大的顺序为____ ;该物质中,含有σ键和π键数目之比为____ 。
(5)在CO分子中每个原子均为8电子稳定结构,则C与O之间形成_____ 个σ键____ 个π键,在这些化学键中,O原子共提供了____ 个电子。
(6)乙腈(CH3CN)分子中碳原子的杂化类型有____ ,与N同周期的主族元素中,第一电离能大于N的有_____ 种,写出一种与N 互为等电子体的分子的化学式
互为等电子体的分子的化学式_____ ,NO 离子的立体构型是
离子的立体构型是____ 。
(7)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据列于表:
锰元素位于第四周期第VIIB族。请写出基态Mn2+的价电子排布式:_____ ,比较两元素的I2、I3可知,气态Mn2+再失去1个电子比气态Fe2+再失去1个电子难,对此你的解释是_____ 。
(1)化合物III也是一种汞解毒剂。化合物IV是一种强酸。下列说法正确的有

A.在I中S原子采取sp3杂化
B.在II中S元素的电负性最大
C.在III中C-C-C键角是180°
D.在III中存在离子键与共价键
E.在IV中硫氧键的键能均相等
(2)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物I与化合物III相比,水溶性较好的是
(3)NH3、PH3、AsH3分子的键角分别为107.3°、93.3°、91.8°,其键角逐渐减小的原因是
(4)
 中含有各元素的电负性由小到大的顺序为
中含有各元素的电负性由小到大的顺序为(5)在CO分子中每个原子均为8电子稳定结构,则C与O之间形成
(6)乙腈(CH3CN)分子中碳原子的杂化类型有
 互为等电子体的分子的化学式
互为等电子体的分子的化学式 离子的立体构型是
离子的立体构型是(7)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据列于表:
| 元素 | Mn | Fe | |
| 电离能/kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
您最近一年使用:0次
解题方法
6 . A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是_____ (填元素符号),其中C原子的核外电子排布式为_____ 。
(2)单质A有两种同素异形体,其中沸点高的是_____ (填分子式);A和B的氢化物所属的晶体类型分别为_____ 和_____ 。
(3)C和D反应可生成组成比为1︰3的化合物E,E的立体构型为_____ ,中心原子的杂化轨道类型为_____ 。
(4)化合物D2A的中心原子的价层电子对数为_____ ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为_____ 。
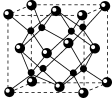
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为_____ ;晶胞中A原子的配位数为_____ 。
(1)四种元素中电负性最大的是
(2)单质A有两种同素异形体,其中沸点高的是
(3)C和D反应可生成组成比为1︰3的化合物E,E的立体构型为
(4)化合物D2A的中心原子的价层电子对数为
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为

您最近一年使用:0次
名校
解题方法
7 . C、N、P、Si是重要的非金属元素,在生产、生活中有重要应用。回答下列问题:
(1)下列氮原子的电子排布图表示的状态中,能量最高的是_______(填序号)。
(2)原子中运动的电子有两种相反的自旋状态,一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态Si原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态Si原子,其价电子自旋磁量子数的代数和为_______ 。
(3) 中共用电子对偏向C,
中共用电子对偏向C, 中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为
中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为_______ 。
(4) 分子的中心原子的价层电子对数为
分子的中心原子的价层电子对数为_______ ,分子的立体构型为三角双锥形, 属于
属于_______ 分子(填“极性”或“非极性”),其中心原子杂化类型为_______ (填序号)。
A. B.
B. C.
C. D.
D.
(5)试用下表中的键能数据解释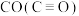 比
比 相对活泼的原因:
相对活泼的原因:_______ 。
(1)下列氮原子的电子排布图表示的状态中,能量最高的是_______(填序号)。
A.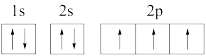 | B.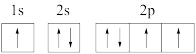 |
C.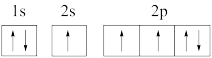 | D.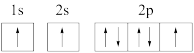 |
 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态Si原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态Si原子,其价电子自旋磁量子数的代数和为(3)
 中共用电子对偏向C,
中共用电子对偏向C, 中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为
中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为(4)
 分子的中心原子的价层电子对数为
分子的中心原子的价层电子对数为 属于
属于A.
 B.
B. C.
C. D.
D.
(5)试用下表中的键能数据解释
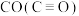 比
比 相对活泼的原因:
相对活泼的原因:| C—O | C=O |  | |
键能 | 357.7 | 798.9 | 1071.9 |
| N—N | N=N |  | |
键能 | 154.8 | 418.4 | 941.7 |
您最近一年使用:0次
2022-08-21更新
|
352次组卷
|
2卷引用:山东省潍坊市2021-2022学年高二上学期期末考试化学试题
名校
8 . X、Y、Z、W、Q五种元素位于元素周期表前四周期,原子序数依次增大。基态X原子价电子排布式为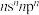 ;基态Z原子核外电子有三个能级,p电子总数与s电子总数相等;W是第三周期电负性最大的元素;基态Q原子有四个未成对电子。
;基态Z原子核外电子有三个能级,p电子总数与s电子总数相等;W是第三周期电负性最大的元素;基态Q原子有四个未成对电子。
(1)W核外电子运动状态共有_______ 种。
(2)阴离子 、
、 的空间构型分别是
的空间构型分别是_______ 、_______ 。
(3)基态Q原子中,核外电子占据最高能层的符号是_______ ,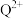 的价电子排布式为
的价电子排布式为_______ ,Q在周期表中的位置是_______ 区。
(4) 分子中各原子都满足最外层8电子结构,分子中
分子中各原子都满足最外层8电子结构,分子中 键与
键与 键数目之比为
键数目之比为_______ 。
(5)Y与W可形成化合物 。资料显示:Y元素电负性略大于W;
。资料显示:Y元素电负性略大于W; 可溶于水发生水解反应。试判断
可溶于水发生水解反应。试判断 可能的水解产物为
可能的水解产物为_______ (写化学式)。
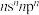 ;基态Z原子核外电子有三个能级,p电子总数与s电子总数相等;W是第三周期电负性最大的元素;基态Q原子有四个未成对电子。
;基态Z原子核外电子有三个能级,p电子总数与s电子总数相等;W是第三周期电负性最大的元素;基态Q原子有四个未成对电子。(1)W核外电子运动状态共有
(2)阴离子
 、
、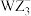 的空间构型分别是
的空间构型分别是(3)基态Q原子中,核外电子占据最高能层的符号是
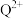 的价电子排布式为
的价电子排布式为(4)
 分子中各原子都满足最外层8电子结构,分子中
分子中各原子都满足最外层8电子结构,分子中 键与
键与 键数目之比为
键数目之比为(5)Y与W可形成化合物
 。资料显示:Y元素电负性略大于W;
。资料显示:Y元素电负性略大于W; 可溶于水发生水解反应。试判断
可溶于水发生水解反应。试判断 可能的水解产物为
可能的水解产物为
您最近一年使用:0次
2022-08-21更新
|
336次组卷
|
2卷引用:山东省潍坊市2021-2022学年高二上学期期末考试化学试题
解题方法
9 . 完成下列问题。
(1)基态铬的核外电子排布式是:_______ ,其在周期表中的位置是_______ 。
(2) 可以形成的一种配合物是
可以形成的一种配合物是 ,
, 表示的是
表示的是 。其中
。其中 的VSEPR模型为
的VSEPR模型为_______ , 分子中,各元素的电负性由大到小的顺序为
分子中,各元素的电负性由大到小的顺序为_______ 。
(3)在极性分子中,正电荷重心和负电荷重心间的距离称为偶极长,用d表示。极性分子的极性强弱和偶极长,电荷重心的电量q有关,用偶极矩μ衡量,其定义为μ=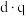 。
。
①请写出一种μ=0的分子_______ 。
②对硝基氯苯,邻硝基氯苯,间硝基氯苯三种分子的偶极矩由大到小的顺序为_______ 。
③治癌药物 有平面四边形结构,
有平面四边形结构, 位于四边形的中心,
位于四边形的中心, 和
和 位于四边形的四个角上。已知该化合物有两种异构体,a的μ≠0、b的μ=0,则这两者在水中的溶解度大小顺序为
位于四边形的四个角上。已知该化合物有两种异构体,a的μ≠0、b的μ=0,则这两者在水中的溶解度大小顺序为_______ 。
(4)铁有δ、γ、α三种晶体,以下为这三种晶体在不同温度下转化的图示。
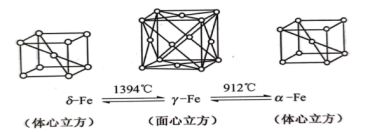
① 晶体中
晶体中 原子的配位数是
原子的配位数是_______ 。
②若 晶胞边长为a,
晶胞边长为a, 晶胞边长为b,则这两种晶体的密度比为
晶胞边长为b,则这两种晶体的密度比为_______ 。
(1)基态铬的核外电子排布式是:
(2)
 可以形成的一种配合物是
可以形成的一种配合物是 ,
, 表示的是
表示的是 。其中
。其中 的VSEPR模型为
的VSEPR模型为 分子中,各元素的电负性由大到小的顺序为
分子中,各元素的电负性由大到小的顺序为(3)在极性分子中,正电荷重心和负电荷重心间的距离称为偶极长,用d表示。极性分子的极性强弱和偶极长,电荷重心的电量q有关,用偶极矩μ衡量,其定义为μ=
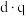 。
。①请写出一种μ=0的分子
②对硝基氯苯,邻硝基氯苯,间硝基氯苯三种分子的偶极矩由大到小的顺序为
③治癌药物
 有平面四边形结构,
有平面四边形结构, 位于四边形的中心,
位于四边形的中心, 和
和 位于四边形的四个角上。已知该化合物有两种异构体,a的μ≠0、b的μ=0,则这两者在水中的溶解度大小顺序为
位于四边形的四个角上。已知该化合物有两种异构体,a的μ≠0、b的μ=0,则这两者在水中的溶解度大小顺序为(4)铁有δ、γ、α三种晶体,以下为这三种晶体在不同温度下转化的图示。

①
 晶体中
晶体中 原子的配位数是
原子的配位数是②若
 晶胞边长为a,
晶胞边长为a, 晶胞边长为b,则这两种晶体的密度比为
晶胞边长为b,则这两种晶体的密度比为
您最近一年使用:0次
10 . 一般认为,含氧酸酸性强弱主要与两个因素有关:一是中心原子的电负性越大,酸性越强:一是中心原子所连接的“非羟基氧”数目越多,酸性越强。据此推断下列说法正确的是
A. 是一种二元强酸 是一种二元强酸 |
B.H3PO2的分子结构是 ,它是一种三元弱酸 ,它是一种三元弱酸 |
| C.HPO3、 HClO3、HClO4的酸性依次增强 |
D.某元素X形成的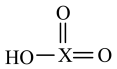 比HO-X的酸性强,氧化性也强 比HO-X的酸性强,氧化性也强 |
您最近一年使用:0次
2022-05-27更新
|
922次组卷
|
3卷引用:山东省名校联盟2022届高三下学期5月模拟考试化学试题



