名校
1 . 下列事实不能通过比较氟元素和氯元素的电负性进行解释的是
A. 键的键能小于 键的键能小于 键的键能 键的键能 |
B. 键角比 键角比 小 小 |
| C.氟化氢分子的极性强于氯化氢分子的极性 |
D.气态氟化氢中存在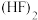 ,而气态氯化氢中是 ,而气态氯化氢中是 分子 分子 |
您最近一年使用:0次
名校
解题方法
2 . A、B、C、D、E、F、G、H是元素周期表前四周期常见元素,且原子序数依次增大,相关信息如下表:
请用化学用语填空:
(1)A元素在元素周期表中的位置___________ ;C元素和F元素的电负性比较,较小的是___________ (填元素符号)。
(2)B元素与宇宙中含量最丰富的元素形成的最简单化合物的电子式为___________ ,B元素所形成的单质分子中σ键与π键数目之比为___________ 。
(3)F元素原子的价电子的轨道表示式是___________ ;G的高价阳离子的溶液与H单质反应的离子方程式为___________ ;元素X与元素E在周期表中呈对角线关系,且元素X的最高价氧化物的水化物也具有两性,试写出X元素的最高价氧化物的水化物与D元素的最高价氧化物的水化物反应的化学方程式___________ 。
| 元素 | 元素相关信息 |
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 基态原子最外层电子排布式为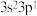 |
| F | 基态原子的最外层p轨道有两个电子的自旋方向与其他电子的自旋方向相反 |
| G | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
| H | 是我国使用最早的合金中的最主要元素 |
(1)A元素在元素周期表中的位置
(2)B元素与宇宙中含量最丰富的元素形成的最简单化合物的电子式为
(3)F元素原子的价电子的轨道表示式是
您最近一年使用:0次
名校
解题方法
3 . 下列有关物质结构、性质与应用的表述,没有 因果关系的是
A. 胶体具有吸附性,可用于除去水中的悬浮颗粒物 胶体具有吸附性,可用于除去水中的悬浮颗粒物 |
B.N—H键的极性大于C—H键的极性, 分子的极性大于CH4 分子的极性大于CH4 |
| C.C—F的键能大于C—H,聚四氟乙烯的稳定性高于聚乙烯 |
D. 存在3d、4s、4p等多个空轨道,可形成多种配位化合物 存在3d、4s、4p等多个空轨道,可形成多种配位化合物 |
您最近一年使用:0次
2024-03-06更新
|
497次组卷
|
2卷引用:福建省泉州市2024届高三下学期高中毕业班质量监测(三)化学试卷
名校
4 . 叠氮化钠( )可用于汽车安全气囊的制造,
)可用于汽车安全气囊的制造, 与
与 发生反应可以生成
发生反应可以生成 ,反应方程式为
,反应方程式为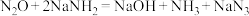 。下列有关说法错误的是
。下列有关说法错误的是
 )可用于汽车安全气囊的制造,
)可用于汽车安全气囊的制造, 与
与 发生反应可以生成
发生反应可以生成 ,反应方程式为
,反应方程式为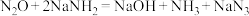 。下列有关说法错误的是
。下列有关说法错误的是A.键角: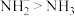 | B.电负性: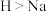 |
C. 溶液显碱性 溶液显碱性 | D.1 mol  中含2 mol σ键 中含2 mol σ键 |
您最近一年使用:0次
2024-02-01更新
|
448次组卷
|
3卷引用:福建省厦门第一中学2023-2024学年高二下学期第一次月考化学试题
解题方法
5 . 四种短周期主族元素在元素周期表中的相对位置如图所示,且X、Y、Z和Q四种元素的p轨道电子总数为24。化学家鲍林以Y的电负性作为参照标准,得出了各元素的电负性。下列叙述错误的是
| X | Y | |||
| Z | Q |
| A.最简单氢化物的稳定性:Y>Q>Z |
B. 分子中每个原子最外层都达到8电子稳定结构 分子中每个原子最外层都达到8电子稳定结构 |
| C.最高价氧化物对应水化物的酸性: Z<Q |
D.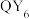 分子呈正八面体形 分子呈正八面体形 |
您最近一年使用:0次
2023-10-28更新
|
337次组卷
|
2卷引用:福建省宁德市部分达标学校2023-2024学年高三上学期期中考试化学试题
名校
解题方法
6 . 阴离子 和二脲基分子能通过一种弱相互作用形成超分子阴离子配合物,如下图所示(图中省略阴离子配合物中部分原子)。下列关于该阴离子配合物的说法正确的是
和二脲基分子能通过一种弱相互作用形成超分子阴离子配合物,如下图所示(图中省略阴离子配合物中部分原子)。下列关于该阴离子配合物的说法正确的是
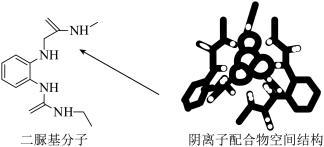
 和二脲基分子能通过一种弱相互作用形成超分子阴离子配合物,如下图所示(图中省略阴离子配合物中部分原子)。下列关于该阴离子配合物的说法正确的是
和二脲基分子能通过一种弱相互作用形成超分子阴离子配合物,如下图所示(图中省略阴离子配合物中部分原子)。下列关于该阴离子配合物的说法正确的是
A.所含元素电负性最大的是 |
| B.二脲基分子中所有碳原子不可能共平面 |
C. 离子与 离子与 离子的空间结构不同 离子的空间结构不同 |
D.二脲基分子中 的 的 和 和 离子的 离子的 形成氢键 形成氢键 |
您最近一年使用:0次
7 . 2022年度诺贝尔化学奖授予对发展点击化学和生物正交化学做出突出贡献的科学家。 反应作为点击化学的典型代表,其反应原理如下:
反应作为点击化学的典型代表,其反应原理如下:
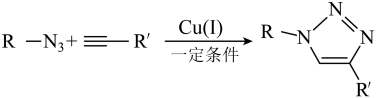
科学家以 为催化剂、以
为催化剂、以 和水的混合溶剂作为反应介质进行了一种
和水的混合溶剂作为反应介质进行了一种 反应:
反应:

回答下列问题:
(1)基态铜原子核外电子占据能量最高的能层符号为___________ 。
(2)化合物P的结构简式为___________ ;P中所含元素电负性从大到小的顺序为___________ 。
(3) 离子又叫叠氮酸根,它的空间构型为
离子又叫叠氮酸根,它的空间构型为___________ ;与 互为等电子体的一种分子为
互为等电子体的一种分子为___________ (填化学式)。
(4)鉴别L中含有碳碳三键的一种试剂为___________ 。
(5) 晶胞如图所示,
晶胞如图所示, 位于
位于 构成的
构成的___________ 空隙中,B的坐标为___________ 。

 反应作为点击化学的典型代表,其反应原理如下:
反应作为点击化学的典型代表,其反应原理如下:
科学家以
 为催化剂、以
为催化剂、以 和水的混合溶剂作为反应介质进行了一种
和水的混合溶剂作为反应介质进行了一种 反应:
反应:
回答下列问题:
(1)基态铜原子核外电子占据能量最高的能层符号为
(2)化合物P的结构简式为
(3)
 离子又叫叠氮酸根,它的空间构型为
离子又叫叠氮酸根,它的空间构型为 互为等电子体的一种分子为
互为等电子体的一种分子为(4)鉴别L中含有碳碳三键的一种试剂为
(5)
 晶胞如图所示,
晶胞如图所示, 位于
位于 构成的
构成的
您最近一年使用:0次
8 . 化合物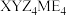 可作肥料,所含的5种元素位于主族,在每个短周期均有分布,仅有Y和M同族。Y的基态原子价层p轨道半充满,X的基态原子价层电子排布式为
可作肥料,所含的5种元素位于主族,在每个短周期均有分布,仅有Y和M同族。Y的基态原子价层p轨道半充满,X的基态原子价层电子排布式为 ,X与M同周期,E在地壳中含量最多。下列说法正确的是
,X与M同周期,E在地壳中含量最多。下列说法正确的是
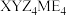 可作肥料,所含的5种元素位于主族,在每个短周期均有分布,仅有Y和M同族。Y的基态原子价层p轨道半充满,X的基态原子价层电子排布式为
可作肥料,所含的5种元素位于主族,在每个短周期均有分布,仅有Y和M同族。Y的基态原子价层p轨道半充满,X的基态原子价层电子排布式为 ,X与M同周期,E在地壳中含量最多。下列说法正确的是
,X与M同周期,E在地壳中含量最多。下列说法正确的是A.元素电负性: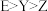 | B.氢化物沸点: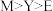 |
C.第一电离能: | D.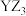 和 和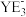 的空间结构均为三角锥形 的空间结构均为三角锥形 |
您最近一年使用:0次
2023-07-04更新
|
8135次组卷
|
15卷引用:福建省南安市侨光中学2023-2024学年高二下学期4月月考化学试题
福建省南安市侨光中学2023-2024学年高二下学期4月月考化学试题2023年高考广东卷化学真题(已下线)2023年广东卷高考真题变式题(选择题11-16)(已下线)第19讲元素周期律与元素周期表江西省宜春市宜丰中学2023-2024学年高三上学期开学考试化学试题(已下线)考点18 元素周期律与元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)广东省江门市第一中学2023-2024学年高二上学期第一次段考化学试题(已下线)选择题1-5陕西师范大学附属中学2023-2024学年高二上学期期中考试化学试题(已下线)题型20 物质结构与性质基础-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)重庆市第七中学校2023-2024学年高三上学期月考(12月)化学试题河北省石家庄二中教育集团2023-2024学年高二年级上学期期末考试化学试题安徽省合肥市第七中学2023-2024学年高二下学期第一次段考化学试卷 四川省南充市阆中中学校2023-2024学年高二下学期3月月考化学试卷甘肃省白银市靖远县第四中学2023-2024学年高二下学期4月月考化学试题
名校
解题方法
9 . X、Y、Z、Q是原子序数依次增大的前四周期元素,其中X是宇宙中含量最多的元素;Y元素基态原子的价层电子排布是 ;Z、Q元素原子的最外层均只有1个电子,Z元素原子中只有两种形状的电子云,Q元素基态原子内层轨道均排满电子。下列说法正确的是
;Z、Q元素原子的最外层均只有1个电子,Z元素原子中只有两种形状的电子云,Q元素基态原子内层轨道均排满电子。下列说法正确的是
 ;Z、Q元素原子的最外层均只有1个电子,Z元素原子中只有两种形状的电子云,Q元素基态原子内层轨道均排满电子。下列说法正确的是
;Z、Q元素原子的最外层均只有1个电子,Z元素原子中只有两种形状的电子云,Q元素基态原子内层轨道均排满电子。下列说法正确的是A.电负性: | B.ZX属于共价化合物 |
C. 的阴阳离子数之比为1:1 的阴阳离子数之比为1:1 | D.Q元素位于元素周期表的ds区 |
您最近一年使用:0次
2023-05-05更新
|
590次组卷
|
3卷引用:福建省三明市2022-2023学年普通高中高三下学期5月份质量检测化学试题
福建省三明市2022-2023学年普通高中高三下学期5月份质量检测化学试题(已下线)第06练 元素“位—构—性”的综合推断 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)山东省烟台市龙口某校2023-2024学年高二上学期12月月考化学试题
名校
10 . 以红土镍矿(主要成分是 ,含
,含 (等)为原料制备硝酸镍的流程如图所示:
(等)为原料制备硝酸镍的流程如图所示:

注: 为
为 和
和 的混合气体。回答下列问题:
的混合气体。回答下列问题:
(1)基态镍原子价电子排布式为_______ 。
(2)“除铁铝”阶段需要先用 溶液将
溶液将 氧化为
氧化为 。
。 属于
属于_______ (“极性”或“非极性”)分子。
(3)“除镁钙”阶段为加入 除尽
除尽 ,除
,除 后的滤液中
后的滤液中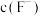 至少应为
至少应为_______  [当溶液中某离子浓度小于
[当溶液中某离子浓度小于 时,可认为该离子沉淀完全。已知该实验条件下
时,可认为该离子沉淀完全。已知该实验条件下 ,
, ]。
]。
(4)“净化液电解”阶段,析镍过程中存在竞争反应,该竞争反应的电极反应式为_______ 。
(5)工业制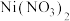 成品时,先用硝酸将
成品时,先用硝酸将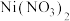 溶液酸化至
溶液酸化至 ,再经减压蒸发浓缩,然后冷却结晶、离心分离。其中“减压蒸发”的目的是
,再经减压蒸发浓缩,然后冷却结晶、离心分离。其中“减压蒸发”的目的是_______ (任答两点)。
(6)工业上用 溶液吸收
溶液吸收 制备硝酸钠,其流程如图所示:
制备硝酸钠,其流程如图所示:
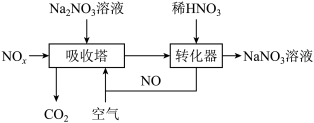
①吸收塔得到 、
、 混合溶液。键角:
混合溶液。键角:
_______  (填“>”、“=”或“<”),
(填“>”、“=”或“<”), 、N、O三种元素中电负性最大的是
、N、O三种元素中电负性最大的是_______ (填元素符号)。
②写出转化器中发生反应的化学方程式:_______ 。
 ,含
,含 (等)为原料制备硝酸镍的流程如图所示:
(等)为原料制备硝酸镍的流程如图所示:
注:
 为
为 和
和 的混合气体。回答下列问题:
的混合气体。回答下列问题:(1)基态镍原子价电子排布式为
(2)“除铁铝”阶段需要先用
 溶液将
溶液将 氧化为
氧化为 。
。 属于
属于(3)“除镁钙”阶段为加入
 除尽
除尽 ,除
,除 后的滤液中
后的滤液中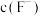 至少应为
至少应为 [当溶液中某离子浓度小于
[当溶液中某离子浓度小于 时,可认为该离子沉淀完全。已知该实验条件下
时,可认为该离子沉淀完全。已知该实验条件下 ,
, ]。
]。(4)“净化液电解”阶段,析镍过程中存在竞争反应,该竞争反应的电极反应式为
(5)工业制
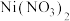 成品时,先用硝酸将
成品时,先用硝酸将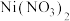 溶液酸化至
溶液酸化至 ,再经减压蒸发浓缩,然后冷却结晶、离心分离。其中“减压蒸发”的目的是
,再经减压蒸发浓缩,然后冷却结晶、离心分离。其中“减压蒸发”的目的是(6)工业上用
 溶液吸收
溶液吸收 制备硝酸钠,其流程如图所示:
制备硝酸钠,其流程如图所示:
①吸收塔得到
 、
、 混合溶液。键角:
混合溶液。键角:
 (填“>”、“=”或“<”),
(填“>”、“=”或“<”), 、N、O三种元素中电负性最大的是
、N、O三种元素中电负性最大的是②写出转化器中发生反应的化学方程式:
您最近一年使用:0次
2023-04-27更新
|
415次组卷
|
3卷引用:福建省厦门第一中学2023届高三下学期模拟考试化学试题



