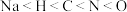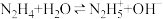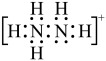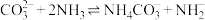叠氮化钠( )可用于汽车安全气囊的制造,
)可用于汽车安全气囊的制造, 与
与 发生反应可以生成
发生反应可以生成 ,反应方程式为
,反应方程式为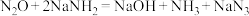 。下列有关说法错误的是
。下列有关说法错误的是
 )可用于汽车安全气囊的制造,
)可用于汽车安全气囊的制造, 与
与 发生反应可以生成
发生反应可以生成 ,反应方程式为
,反应方程式为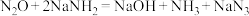 。下列有关说法错误的是
。下列有关说法错误的是A.键角: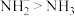 | B.电负性: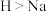 |
C. 溶液显碱性 溶液显碱性 | D.1 mol  中含2 mol σ键 中含2 mol σ键 |
更新时间:2024-02-01 23:36:05
|
相似题推荐
【推荐1】已知25℃时,二元酸H2X的电离平衡常数K1=5.0×10-2,K2=5.4×10-3。此温度下用AgNO3溶液分别滴定浓度均为0.01mol/L的KY和K2X溶液,所得的沉淀(AgY和Ag2X)溶解平衡图象如图所示。下列叙述正确的是
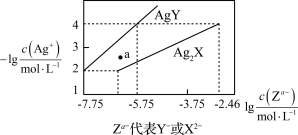

| A.25℃时,KHX的溶液pH>7 |
B.反应Ag2X+2Y- 2AgY+X2-的平衡常数为103.25 2AgY+X2-的平衡常数为103.25 |
| C.a点既可以表示AgY的不饱和溶液也可以表示Ag2X的过饱和溶液 |
| D.向c(Y-)=c(X2-)=0.01mol/L的混合液中滴入AgNO3溶液时,先生成AgY沉淀 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】常温下,向某浓度的 溶液中逐滴加入NaOH溶液,溶液中-lgc(x)(x为H2A、HA-或A2-)与溶液pH的变化关系如图所示。则下列说法正确的是
溶液中逐滴加入NaOH溶液,溶液中-lgc(x)(x为H2A、HA-或A2-)与溶液pH的变化关系如图所示。则下列说法正确的是

 溶液中逐滴加入NaOH溶液,溶液中-lgc(x)(x为H2A、HA-或A2-)与溶液pH的变化关系如图所示。则下列说法正确的是
溶液中逐滴加入NaOH溶液,溶液中-lgc(x)(x为H2A、HA-或A2-)与溶液pH的变化关系如图所示。则下列说法正确的是
| A.c点溶液中c(Na+)>3c(A2-) |
| B.整个过程中[c(H2A)+c(HA-)+c(A2-)]保持不变 |
| C.将等物质的量浓度的NaHA与H2A溶液等体积混合,所得溶液pH=0.8 |
| D.b点对应溶液的pH为3.05 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】下列说法正确的是
| A.元素C、N、O的第一电离能由大到小的顺序为O>N>C |
B. 中电负性最小的元素是N 中电负性最小的元素是N |
C.基态 的价电子排布式为 的价电子排布式为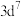 |
D. 的键角为120°, 的键角为120°, 的键角为120° 的键角为120° |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】中山大学化学学院廖培钦教授利用HAB合成了有机金属框架(Cu-HAB),为开发催化 制乙醇的催化剂取得突破,合成过程如图所示。
制乙醇的催化剂取得突破,合成过程如图所示。

下列叙述错误的是
 制乙醇的催化剂取得突破,合成过程如图所示。
制乙醇的催化剂取得突破,合成过程如图所示。
下列叙述错误的是
| A.1molHAB最多能消耗6molHCl |
B.上述变化中N原子由 杂化变为 杂化变为 杂化 杂化 |
C.Cu-HAB中N原子提供孤电子对与 形成配位键 形成配位键 |
| D.在Cu-HAB中氮元素电负性最大 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐1】胆矾(CuSO4·5H2O)的结构示意图如下所示。下列说法不正确 的是

A.基态Cu2+的价层电子轨道表示式是  |
| B.H2O中氧原子的VSEPR的价层电子对数是4 |
C.SO 中的O-S-O的键角小于H2O中的H-O-H的键角 中的O-S-O的键角小于H2O中的H-O-H的键角 |
D.胆矾中的H2O与Cu2+、H2O与SO 的作用力分别为配位键和氢键 的作用力分别为配位键和氢键 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐2】 的配位化合物较稳定且用运广泛。
的配位化合物较稳定且用运广泛。 可与
可与 等配体形成溶液呈浅紫色的
等配体形成溶液呈浅紫色的 、红色的
、红色的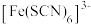 、无色的
、无色的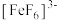 配离子。某同学按如下步骤完成实验:
配离子。某同学按如下步骤完成实验: 的溶液中加入
的溶液中加入 溶液生成蓝色的
溶液生成蓝色的 的配离子,
的配离子, 不能与
不能与 形成配位离子。下列说法正确的是
形成配位离子。下列说法正确的是
 的配位化合物较稳定且用运广泛。
的配位化合物较稳定且用运广泛。 可与
可与 等配体形成溶液呈浅紫色的
等配体形成溶液呈浅紫色的 、红色的
、红色的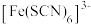 、无色的
、无色的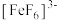 配离子。某同学按如下步骤完成实验:
配离子。某同学按如下步骤完成实验:
 的溶液中加入
的溶液中加入 溶液生成蓝色的
溶液生成蓝色的 的配离子,
的配离子, 不能与
不能与 形成配位离子。下列说法正确的是
形成配位离子。下列说法正确的是A. 第四电离能 第四电离能 远小于第三电离能 远小于第三电离能 |
B.基态 和基态 和基态 的核外电子排布中,未成对电子数之比 的核外电子排布中,未成对电子数之比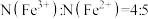 |
C.配离子 中 中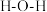 的键角与 的键角与 分子中 分子中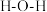 的键角相等 的键角相等 |
D.可用 和 和 溶液检验 溶液检验 溶液中是否含有 溶液中是否含有 |
您最近一年使用:0次






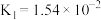
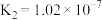
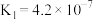

 和NaCN溶液中的离子总数大小:前者<后者
和NaCN溶液中的离子总数大小:前者<后者
 ,则a一定大于b
,则a一定大于b )为二元弱碱,在水中的电离方程式与氨相似。下列说法错误的是
)为二元弱碱,在水中的电离方程式与氨相似。下列说法错误的是