名校
解题方法
1 . Ⅰ.尿素[CO(NH2)2]是人工合成的第一种有机物,可用于制有机铁肥,主要代表有[Fe(H2NCONH2)6](NO3)3。
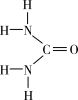
(1)[Fe(H2NCONH2)6](NO3)3中所含元素的电负性由大到小的顺序是______________ 。
(2)尿素中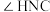
______________ 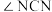 (填“>”“=”“<”),理由是
(填“>”“=”“<”),理由是______________ 。
(3)[Fe(H2NCONH2)6](NO3)3中不存在 的化学键____________ (填序号)。
A.离子键 B.金属键 C.配位键 D. 键 E.
键 E. 键
键
Ⅱ.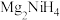 是一种贮氢的金属氢化物,可通过氢化镁和镍单质球磨制成。
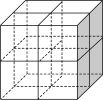
是一种贮氢的金属氢化物,可通过氢化镁和镍单质球磨制成。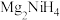 晶胞形状为如图立方体,边长为
晶胞形状为如图立方体,边长为 ,
, 原子占据顶点和面心,
原子占据顶点和面心, 处于八个小立方体的体心。
处于八个小立方体的体心。
(4) 原子的价电子排布式为
原子的价电子排布式为______________ 。
(5) 位于
位于 原子形成的
原子形成的______________ (填“八面体空隙”或“四面体空隙”)。
(6)该晶体的密度为___________  (用含a、
(用含a、 代数式表示)。
代数式表示)。

(1)[Fe(H2NCONH2)6](NO3)3中所含元素的电负性由大到小的顺序是
(2)尿素中
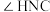
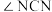 (填“>”“=”“<”),理由是
(填“>”“=”“<”),理由是(3)[Fe(H2NCONH2)6](NO3)3中
A.离子键 B.金属键 C.配位键 D.
 键 E.
键 E. 键
键Ⅱ.
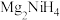 是一种贮氢的金属氢化物,可通过氢化镁和镍单质球磨制成。
是一种贮氢的金属氢化物,可通过氢化镁和镍单质球磨制成。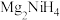 晶胞形状为如图立方体,边长为
晶胞形状为如图立方体,边长为 ,
, 原子占据顶点和面心,
原子占据顶点和面心, 处于八个小立方体的体心。
处于八个小立方体的体心。
(4)
 原子的价电子排布式为
原子的价电子排布式为(5)
 位于
位于 原子形成的
原子形成的(6)该晶体的密度为
 (用含a、
(用含a、 代数式表示)。
代数式表示)。
您最近一年使用:0次
解题方法
2 . 前四周期的A、B、C、D、E、F六种元素,原子序数依次增大。基态A原子核外电子的L层电子数是K层的2倍;B原子基态时的2p轨道上未成对的电子数最多;C元素为最活泼的非金属元素;D元素核外有3个电子层,最外层电子数是核外电子总数的 ;E元素正三价离子的3d轨道为半充满状态;F元素与B元素位于同一主族,其某种氧化物有剧毒。
;E元素正三价离子的3d轨道为半充满状态;F元素与B元素位于同一主族,其某种氧化物有剧毒。
(1)E元素在周期表中位置为_______ ,E3+价电子轨道表示式为_______ 。
(2)B、C、F三种元素电负性由大到小的顺序为_______ (用元素符号表示),第一电离能D_______ (填“>”、“<”或“=”)Al,其原因是_______ 。
(3)相同条件下,A、B的简单氢化物在水中溶解度较大的是_______ (填化学式),理由是_______ 。
(4)F元素可能的性质_______ (填标号)。
 ;E元素正三价离子的3d轨道为半充满状态;F元素与B元素位于同一主族,其某种氧化物有剧毒。
;E元素正三价离子的3d轨道为半充满状态;F元素与B元素位于同一主族,其某种氧化物有剧毒。(1)E元素在周期表中位置为
(2)B、C、F三种元素电负性由大到小的顺序为
(3)相同条件下,A、B的简单氢化物在水中溶解度较大的是
(4)F元素可能的性质
| A.其单质可作半导体材料 |
| B.存在-3、+3、+5等多种化合价 |
| C.最高价氧化物对应的水化物是强酸 |
| D.单质还原性弱于磷单质 |
您最近一年使用:0次
2022-04-16更新
|
298次组卷
|
3卷引用:福建省龙岩市一级校联盟(九校)2021-2022学年高二下学期期中联考化学试题
名校
解题方法
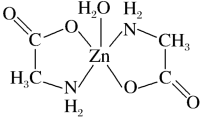
3 . 一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图。 的价电子排布式为
的价电子排布式为_______ ;一水合甘氨酸锌中所涉及的非金属元素电负性由大到小的顺序是_______ 。
(2)甘氨酸(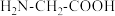 )中N的杂化轨道类型为
)中N的杂化轨道类型为_______ ;甘氨酸易溶于水,试从结构角度解释_______ 。
(3)一水合甘氨酸锌中 的配位数为
的配位数为_______ 。 填入
填入 组成
组成_______ 空隙中;
②由①能否判断出 、
、 相切?
相切?_______ (填“能”或“否”);
③已知晶体密度为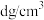 ,
, 半径为a pm,若要使
半径为a pm,若要使 、
、 相切,则
相切,则 半径为
半径为_______ pm(写计算表达式)。
 的价电子排布式为
的价电子排布式为(2)甘氨酸(
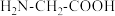 )中N的杂化轨道类型为
)中N的杂化轨道类型为(3)一水合甘氨酸锌中
 的配位数为
的配位数为(4) 是
是 的另一种配合物,IMI的结构为
的另一种配合物,IMI的结构为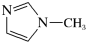 ,常温下IMI的某种衍生物与甘氨酸形成的离子化合物
,常温下IMI的某种衍生物与甘氨酸形成的离子化合物 为液态而非固态。原因是
为液态而非固态。原因是
 填入
填入 组成
组成②由①能否判断出
 、
、 相切?
相切?③已知晶体密度为
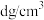 ,
, 半径为a pm,若要使
半径为a pm,若要使 、
、 相切,则
相切,则 半径为
半径为
您最近一年使用:0次
2021-01-03更新
|
379次组卷
|
6卷引用:福建省福州市第三中学2021届高三上学期第四次质量检测化学试题
解题方法
4 . Q、R、X、Y、Z是原子序数依次增大的前四周期元素,Q的一种单质是天然存在的最硬的物质,X原子的核外电子有八种运动状态,Y元素的离子半径是第三周期中最小的,Z是第四周期中未成对电子最多的原子。
(1)Z原子的价电子排布式为_________________ 。
(2)Q、R、X、Y四种元素的电负性由大到小的顺序是_______________ 。
(3)杂化轨道理论指出原子中能量相近的s、p或s、p、d轨道之间可以通过杂化形成种类丰富的杂化轨道。RCl3分子中心原子的杂化方式为___________ ,从原子结构的角度解释不存在RCl5分子的原因_______ 。
(4)配合物甲的分子式为ZCl3·4H2O,配位数为6。取1mol甲溶于水,加入足量的AgNO3溶液,得到143.5g白色沉淀。在酸性溶液中,甲发生水合反应转化为乙(ZCl3·6H2O)。乙的配位原子只有一种,配位数为6。
①甲的结构简式为_______________ 。
②甲→乙的化学方程式为______________ 。
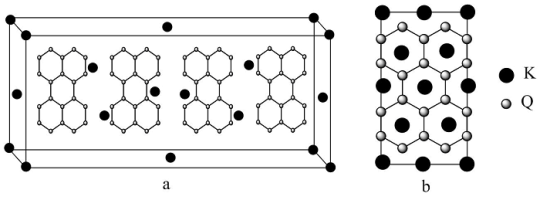
(5)图a是Q的一种同素异形体和钾形成的插层化合物的晶胞图,图b是晶胞沿侧面的投影图。该插层化合物的化学式为______________ 。
(1)Z原子的价电子排布式为
(2)Q、R、X、Y四种元素的电负性由大到小的顺序是
(3)杂化轨道理论指出原子中能量相近的s、p或s、p、d轨道之间可以通过杂化形成种类丰富的杂化轨道。RCl3分子中心原子的杂化方式为
(4)配合物甲的分子式为ZCl3·4H2O,配位数为6。取1mol甲溶于水,加入足量的AgNO3溶液,得到143.5g白色沉淀。在酸性溶液中,甲发生水合反应转化为乙(ZCl3·6H2O)。乙的配位原子只有一种,配位数为6。
①甲的结构简式为
②甲→乙的化学方程式为
(5)图a是Q的一种同素异形体和钾形成的插层化合物的晶胞图,图b是晶胞沿侧面的投影图。该插层化合物的化学式为

您最近一年使用:0次



