解题方法
1 . 材料的发展水平始终是时代进步和人类文明的标志。当前含铁的磁性材料在国防、电子信息等领域中具有广泛应用。请回答下列问题:
(1)基态铁原子的价电子排布图为_______ ,基态铁原子核外电子的空间运动状态有_______ 种, 其处在最高能层的电子的电子云形状为_______ 。
(2)一种新研发出的铁磁性材料M的分子结构如图1所示。
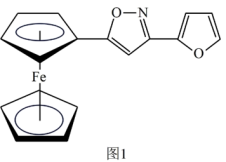
①M分子中C、N、O三种元素的电负性由大到小的顺序为_______ 。
②M分子中的Fe2+与上下两个五元碳环通过配位键相连且Fe2+共提供了6个杂化轨道,则铁原子最可能的杂化方式为_______ (填序号)。
A.sp2 B.sp3 C.dsp2 D.d2sp3
③分子中的大π键可用符号π 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π ), 则M分子中由碳、氧组成的五元环中的大π键应表示为
), 则M分子中由碳、氧组成的五元环中的大π键应表示为_______ 。
(3)铁氮化合物因其特殊的组成和结构而具有优异的铁磁性能,某铁氮化合物的立方晶胞结构如图2所示。
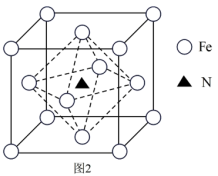
①若以氮原子为晶胞顶点,则铁原子在晶胞中的位置为_______ 。
②该化合物的化学式为_______
(1)基态铁原子的价电子排布图为
(2)一种新研发出的铁磁性材料M的分子结构如图1所示。

①M分子中C、N、O三种元素的电负性由大到小的顺序为
②M分子中的Fe2+与上下两个五元碳环通过配位键相连且Fe2+共提供了6个杂化轨道,则铁原子最可能的杂化方式为
A.sp2 B.sp3 C.dsp2 D.d2sp3
③分子中的大π键可用符号π
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π ), 则M分子中由碳、氧组成的五元环中的大π键应表示为
), 则M分子中由碳、氧组成的五元环中的大π键应表示为(3)铁氮化合物因其特殊的组成和结构而具有优异的铁磁性能,某铁氮化合物的立方晶胞结构如图2所示。

①若以氮原子为晶胞顶点,则铁原子在晶胞中的位置为
②该化合物的化学式为
您最近一年使用:0次
解题方法
2 . 环己酮是重要的化工原料和化工溶剂,某研究小组对其进行了一些探究。
Ⅰ.环己酮的制备。反应原理为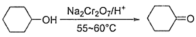 ,还原产物为
,还原产物为 ,反应过程放热,温度过高时环己酮易进一步被氧化,实验装置如图所示。
,反应过程放热,温度过高时环己酮易进一步被氧化,实验装置如图所示。
已知: 溶液呈橙红色,
溶液呈橙红色, 溶液呈墨绿色。
溶液呈墨绿色。
(1)分液漏斗中盛放的试剂为_______ 。(填字母)
a. 溶液 b.环己醇的硫酸溶液
溶液 b.环己醇的硫酸溶液
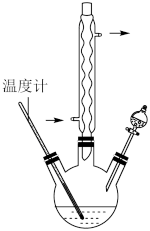
(2)三颈烧瓶中反应体系的温度需控制在55~60℃,其加热方式为_______ 。
(3)反应结束后,还需滴加甲醇,直到_______ (填实验现象)为止,随后分离提纯得到环己酮。
(4)若20.0 mL环己醇(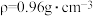 )完全反应并提纯后,得到纯环己酮(
)完全反应并提纯后,得到纯环己酮(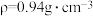 )9.6 mL,则环己酮的产率为
)9.6 mL,则环己酮的产率为_______ 。(计算结果保留2位有效数字)
Ⅱ.环己酮的结构与性质
(5)环己酮中三种元素的电负性由小到大的顺序为_______ 。(用元素符号表示)
(6)若要测定环己酮的相对分子质量,可以采用的波谱分析手段为_______ 。
(7)已知: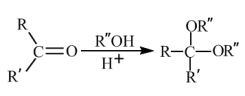 。环己酮和乙二醇在酸性条件下反应生成分子式为
。环己酮和乙二醇在酸性条件下反应生成分子式为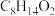 的产物,其结构简式为
的产物,其结构简式为_______ 。
Ⅰ.环己酮的制备。反应原理为
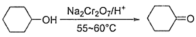 ,还原产物为
,还原产物为 ,反应过程放热,温度过高时环己酮易进一步被氧化,实验装置如图所示。
,反应过程放热,温度过高时环己酮易进一步被氧化,实验装置如图所示。
已知:
 溶液呈橙红色,
溶液呈橙红色, 溶液呈墨绿色。
溶液呈墨绿色。(1)分液漏斗中盛放的试剂为
a.
 溶液 b.环己醇的硫酸溶液
溶液 b.环己醇的硫酸溶液(2)三颈烧瓶中反应体系的温度需控制在55~60℃,其加热方式为
(3)反应结束后,还需滴加甲醇,直到
(4)若20.0 mL环己醇(
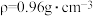 )完全反应并提纯后,得到纯环己酮(
)完全反应并提纯后,得到纯环己酮(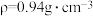 )9.6 mL,则环己酮的产率为
)9.6 mL,则环己酮的产率为Ⅱ.环己酮的结构与性质
(5)环己酮中三种元素的电负性由小到大的顺序为
(6)若要测定环己酮的相对分子质量,可以采用的波谱分析手段为
(7)已知:
 。环己酮和乙二醇在酸性条件下反应生成分子式为
。环己酮和乙二醇在酸性条件下反应生成分子式为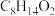 的产物,其结构简式为
的产物,其结构简式为
您最近一年使用:0次
2021-07-02更新
|
420次组卷
|
2卷引用:江苏省泰州市2020-2021学年高二下学期期末考试化学试题
名校
解题方法
3 . 原子序数小于等于36的Q、W、X、Y、Z五种元素,其中Q是形成化合物种类最多的元素,W和Y的基态原子2p能级所含成单电子数均为2,Z的基态原子核外含有13种运动状态不同的电子。回答下列问题(涉及元素时用对应的元素符号表示):
(1)X、Y、Z三种元素的第一电离能由大到小的顺序是______ 。
(2)1molQWX与1molWQ2Y所含σ键的比值为______ 。
(3)根据等电子体理论可以预测WXY-的空间构型为______ 。
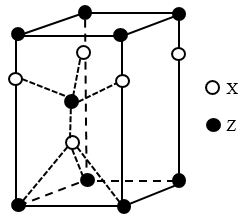
(4)一种由X和Z两种元素形成化合物的晶胞如图所示,该晶胞的化学式为______ 。
(5)实验室合成一种由W和X两种元素形成的化合物,该化合物具有空间网状结构,其中每个W原子与4个X原子形成共价键,每个X原子与3个W原子形成共价键。
①该化合物的化学式为。______ 。
②该化合物所属晶体类型为______ 晶体,预测其熔点应______ 金刚石(填“高于”或“低于”)。
(1)X、Y、Z三种元素的第一电离能由大到小的顺序是
(2)1molQWX与1molWQ2Y所含σ键的比值为
(3)根据等电子体理论可以预测WXY-的空间构型为
(4)一种由X和Z两种元素形成化合物的晶胞如图所示,该晶胞的化学式为

(5)实验室合成一种由W和X两种元素形成的化合物,该化合物具有空间网状结构,其中每个W原子与4个X原子形成共价键,每个X原子与3个W原子形成共价键。
①该化合物的化学式为。
②该化合物所属晶体类型为
您最近一年使用:0次
2021-03-14更新
|
325次组卷
|
3卷引用:江苏省如皋中学2020届高三阶段检测化学试题
名校
解题方法
4 . 铬是一种应用广泛的金属材料。请回答下列问题:
(1)基态铬的价电子排布式为_____________ ,其单电子数目为______________ 。
(2)Cr(NH3)3F3中所含非金属元素的电负性由大到小的顺序是_______________ 。
(3)NH3中N的价层电子对数为____________ ,已知Cr(NH3)3F3中Cr的配位数为6,Cr的配位原子是_____________ ,NH3与Cr3+成键后,N的杂化类型为 ____________ 。
(4)Cr(NH3)3F3固体易升华,其熔沸点均较NaCl 低很多,其原因是________________ 。
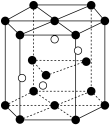
(5)将Cr(NH3)3F3在充足氧气中灼烧有Cr2O3生成,从Cr2O3晶体中取出的具有重复性的六棱柱结构如图所示,已知Cr2O3的摩尔质量为Mg/mol,晶体的密度为ρg/cm3,六棱柱的体积为Vcm3。六棱柱结构内部的小白球代表________ (填“铬离子”或“氧离子”)阿伏加 德罗常数NA =___________ mol-1(用含M,V,ρ的代数式表示)。
(1)基态铬的价电子排布式为
(2)Cr(NH3)3F3中所含非金属元素的电负性由大到小的顺序是
(3)NH3中N的价层电子对数为
(4)Cr(NH3)3F3固体易升华,其熔沸点均较NaCl 低很多,其原因是
(5)将Cr(NH3)3F3在充足氧气中灼烧有Cr2O3生成,从Cr2O3晶体中取出的具有重复性的六棱柱结构如图所示,已知Cr2O3的摩尔质量为Mg/mol,晶体的密度为ρg/cm3,六棱柱的体积为Vcm3。六棱柱结构内部的小白球代表

您最近一年使用:0次
2020-04-18更新
|
610次组卷
|
5卷引用:江苏省镇江第一中学2021-2022学年高三下学期模拟考试化学试题
名校
5 . 晶体硅是制备太阳能电池板的主要原料,电池板中还含有硼、氮、钛、钻、钙等多种化学物质。
请回答下列问题:
1.第二周期元素的电负性按由小到大的顺序排列,B元素排在第__________ 位。
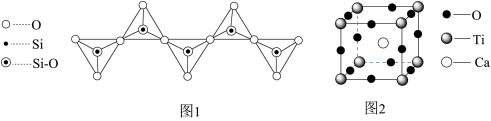
2.硅酸根有多种结构形式,一种无限长链状结构如图1所示,其化学式为____________ ,Si原子的杂化类型为__________________ 。
3.N元素位于元素周期表_____________ 区;基态N原子中,核外电子占据最高能级的电子云有____ 个伸展方向。
4. [Co(NH3)6]3+的几何构型为正八面体形,Co在中心。
①[Co(NH3)6]3+中,1个Co提供_______________ 个空轨道。
②若将[Co(NH3)6]3+中的两个NH3分子换成两个Cl-,可以形成_________ 种不同的结构形式。
5.—种由Ca、Ti、O三种元素形成的晶体的立方晶胞结构如图2所示。
①与Ti紧邻的Ca有___________________ 个。
②若Ca与O之间的最短距离为α pm,阿伏伽德罗常数的值为NA,则晶体的密度ρ=__________________ g· cm-3(用含α、NA的代数式表示)。
请回答下列问题:
1.第二周期元素的电负性按由小到大的顺序排列,B元素排在第
2.硅酸根有多种结构形式,一种无限长链状结构如图1所示,其化学式为
3.N元素位于元素周期表
4. [Co(NH3)6]3+的几何构型为正八面体形,Co在中心。
①[Co(NH3)6]3+中,1个Co提供
②若将[Co(NH3)6]3+中的两个NH3分子换成两个Cl-,可以形成
5.—种由Ca、Ti、O三种元素形成的晶体的立方晶胞结构如图2所示。
①与Ti紧邻的Ca有
②若Ca与O之间的最短距离为α pm,阿伏伽德罗常数的值为NA,则晶体的密度ρ=
您最近一年使用:0次
2018-01-08更新
|
378次组卷
|
2卷引用:江苏省溧水高级中学2017-2018学年高二下学期期末考试(选修)化学试题



