1 . 以 、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
(1)基态O原子的电子排布式_______ ,其中未成对电子有_______ 个。
(2)Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是_______ 。
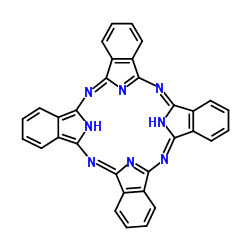
(3)酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取_______ 杂化。邻苯二甲酸酐( )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺(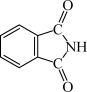 )都是合成酞菁的原料,后者熔点高于前者,主要原因是
)都是合成酞菁的原料,后者熔点高于前者,主要原因是_______ 。
(4)金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为_______ 。
(5)ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn-N键中离子键成分的百分数小于Zn-O键,原因是_______ 。
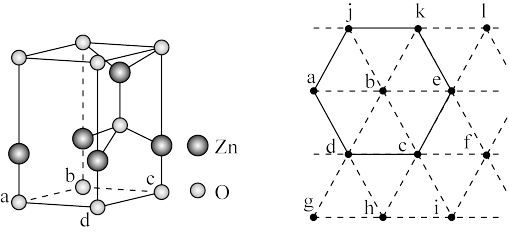
(6)下图为某ZnO晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。 为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面_______ 、_______ 。
 、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:(1)基态O原子的电子排布式
(2)Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是
(3)酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取
 )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺( )都是合成酞菁的原料,后者熔点高于前者,主要原因是
)都是合成酞菁的原料,后者熔点高于前者,主要原因是
(4)金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为
(5)ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn-N键中离子键成分的百分数小于Zn-O键,原因是
(6)下图为某ZnO晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。
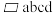 为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
您最近一年使用:0次
2022-07-04更新
|
8991次组卷
|
11卷引用:2022年海南省高考真题化学试题
2022年海南省高考真题化学试题(已下线)2022年海南省高考真题变式题15-19(已下线)专题17 物质结构与性质(综合题)-2022年高考真题模拟题分项汇编(已下线)第19练 物质结构与性质综合题难点突破-2022年【暑假分层作业】高二化学(2023届一轮复习通用)山西省晋中市祁县中学2022-2023学年高三上学期10月月考化学试题(已下线)热点情景汇编-专题十四 结构性质中的新材料(已下线)【知识图鉴】单元讲练测选择性必修2第三章03单元测(已下线)专题九 物质结构与性质-实战高考·二轮复习核心突破(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)专题17 物质结构与性质综合题-2023年高考化学真题题源解密(新高考专用)
2022·四川攀枝花·模拟预测
解题方法
2 . 材料是人类进步的基石,深入认识物质的结构有助于进一步开发新的材料。回答下列问题:
(1)按照杂化轨道理论,基态B原子的价电子先激发,再杂化成键形成BCl3。杂化前,处于激发态的B原子的价电子轨道表示式为_______ ( 选填标号)。
(2)已知:第四周期中3d轨道上没有未成对电子的过渡元素离子的水合离子为无色。下列离子形成的水合离子为无色的是_______。
(3)K3[Fe(CN)6]中所含元素电负性由大到小的顺序为_______ ,lmol K3[Fe(CN)6]含有_______ molσ键;Ti3+能形成化合物[TiCl(H2O)5]Cl2·H2O,该化合物中Ti3+的配位数为_______ 。
(4)Ni(CO)4常温下呈液态,其分子空间构型为正四面体。解释其易溶于CCl4、苯等有机溶剂的原因:_______ 。
(5)纯水电离产生H3O+、OH-,研究发现在某些水溶液中还存在 、
、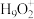 等微粒。
等微粒。
①H2O分子的键角小于H3O+离子的键角,原因是_______ 。
②画出 可能的一种结构式
可能的一种结构式_______ 。
(6)TiO2通过氮掺杂反应生成TiO2-xNy,表示如图。
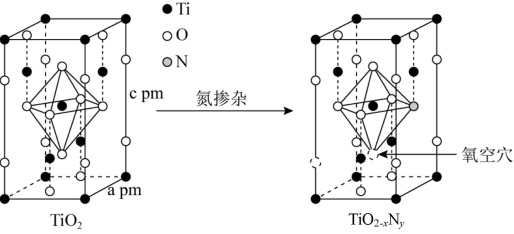
①立方晶系TiO2晶胞参数如图甲所示,若用NA表示阿伏加德罗常数,其晶体的密度为_______ g/cm3。
②图乙的结构可用化学式TiO2-xNy表示,其中x=_______ 。
(1)按照杂化轨道理论,基态B原子的价电子先激发,再杂化成键形成BCl3。杂化前,处于激发态的B原子的价电子轨道表示式为_______ ( 选填标号)。
A.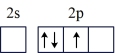 | B.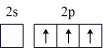 |
C.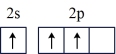 | D.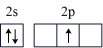 |
| A.Sc3+ | B.Cr3+ | C.Fe3+ | D.Zn2+ |
(4)Ni(CO)4常温下呈液态,其分子空间构型为正四面体。解释其易溶于CCl4、苯等有机溶剂的原因:
(5)纯水电离产生H3O+、OH-,研究发现在某些水溶液中还存在
 、
、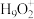 等微粒。
等微粒。①H2O分子的键角小于H3O+离子的键角,原因是
②画出
 可能的一种结构式
可能的一种结构式(6)TiO2通过氮掺杂反应生成TiO2-xNy,表示如图。

①立方晶系TiO2晶胞参数如图甲所示,若用NA表示阿伏加德罗常数,其晶体的密度为
②图乙的结构可用化学式TiO2-xNy表示,其中x=
您最近一年使用:0次
3 . 我国科学家研究发现,在KOH催化下,CO(NH2)2和LiTPSI还原形成稳定的LiF/高分子双层SEI,使LiMn2O4//Li4T15O12电池稳定工作。请回答下列问题:
(1)基态Mn2+的电子排布式为[Ar]____ 。基态K原子核外电子云轮廓图呈球形的能级上占据的电子总数为____ 。
(2)Mn的第三电离能大于Fe的第三电离能的主要原因是____ 。
(3)CO(NH2)2中元素电负性由大到小的顺序为____ (用元素符号表示)。CO(NH2)2分子中碳原子的杂化方式为____ 。
(4)几种钛的卤化物的熔点如表所示:
钛的卤化物熔点呈上述变化的主要原因是____ 。
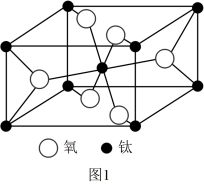
(5)一种钛的氧化物晶胞如图1所示,其化学式为____ 。
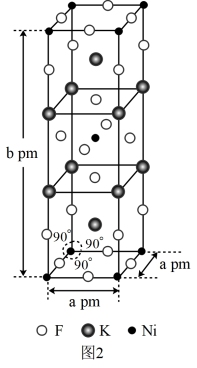
(6)由钾、镍、氟组成的一种晶体结构如图2所示,该晶体密度为____ g·cm-3(只列计算式即可)。
(1)基态Mn2+的电子排布式为[Ar]
(2)Mn的第三电离能大于Fe的第三电离能的主要原因是
(3)CO(NH2)2中元素电负性由大到小的顺序为
(4)几种钛的卤化物的熔点如表所示:
| 卤化物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | -25 | 39 | 150 |
(5)一种钛的氧化物晶胞如图1所示,其化学式为

(6)由钾、镍、氟组成的一种晶体结构如图2所示,该晶体密度为

您最近一年使用:0次



