名校
解题方法
1 . 氢能是一种极具发展潜力的清洁能源,下列物质都是具有广阔应用前景的储氢材料。按要求回答下列问题:
(1)氢化钠( )是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂的电子式为
)是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂的电子式为___________ 。
(2)钛系贮氢合金中的钛锰合金具成本低,吸氢量大,室温下易活化等优点,基态钛的价层电子排布式为___________ 。
(3) (氨硼烷)具有很高的储氢容量及相对低的放氢温度(
(氨硼烷)具有很高的储氢容量及相对低的放氢温度(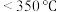 )而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、
)而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、 与
与 进行合成,则涉及的元素H、B、C、N、O电负性最大的是
进行合成,则涉及的元素H、B、C、N、O电负性最大的是___________ ,键角:
___________  (填“
(填“ ”或“
”或“ ”)。
”)。
(4)咔唑(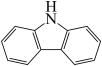 )是一种新型有机液体储氢材料,它的沸点比(
)是一种新型有机液体储氢材料,它的沸点比(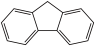 )的高,其主要原因是
)的高,其主要原因是___________ 。
(5)氢气的安全贮存和运输是氢能应用的关键,铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。
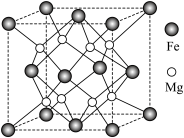
①距离 原子最近的
原子最近的 原子个数是
原子个数是___________ 。
②铁镁合金的化学式为___________ 。
③若该晶胞的晶胞边长为dnm,阿伏加德罗常数为NA,则该合金的密度为___________  。
。
④若该晶体储氢时, 分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下
分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下 的体积约为
的体积约为___________ L。
(1)氢化钠(
 )是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂的电子式为
)是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂的电子式为(2)钛系贮氢合金中的钛锰合金具成本低,吸氢量大,室温下易活化等优点,基态钛的价层电子排布式为
(3)
 (氨硼烷)具有很高的储氢容量及相对低的放氢温度(
(氨硼烷)具有很高的储氢容量及相对低的放氢温度(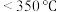 )而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、
)而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、 与
与 进行合成,则涉及的元素H、B、C、N、O电负性最大的是
进行合成,则涉及的元素H、B、C、N、O电负性最大的是
 (填“
(填“ ”或“
”或“ ”)。
”)。(4)咔唑(
 )是一种新型有机液体储氢材料,它的沸点比(
)是一种新型有机液体储氢材料,它的沸点比( )的高,其主要原因是
)的高,其主要原因是(5)氢气的安全贮存和运输是氢能应用的关键,铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。

①距离
 原子最近的
原子最近的 原子个数是
原子个数是②铁镁合金的化学式为
③若该晶胞的晶胞边长为dnm,阿伏加德罗常数为NA,则该合金的密度为
 。
。④若该晶体储氢时,
 分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下
分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下 的体积约为
的体积约为
您最近一年使用:0次
2023-05-25更新
|
342次组卷
|
3卷引用:天津市新华中学2023届高三二模化学试题
名校
解题方法
2 . I.非金属氟化物在生产、生活和科研中应用广泛。回答下列问题:
(1)基态 原子核外电子的运动状态有
原子核外电子的运动状态有___________ 种
(2) 、
、 、
、 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为___________ 。
(3) 中
中 的杂化类型是
的杂化类型是___________ ; 分子的空间结构为
分子的空间结构为___________ 。
(4) 的熔、沸点
的熔、沸点___________ (填“高于”或“低于”) ,原因是
,原因是___________ 。
II.过渡金属元素铬()是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
(5)对于基态 原子,下列叙述正确的是
原子,下列叙述正确的是___________ 。
A.轨道处于半充满时体系总能量低,核外电子排布应为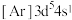
B.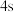 电子能量较高,总是在比
电子能量较高,总是在比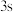 电子离核更远的地方运动
电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(1)基态
 原子核外电子的运动状态有
原子核外电子的运动状态有(2)
 、
、 、
、 的第一电离能由大到小的顺序为
的第一电离能由大到小的顺序为(3)
 中
中 的杂化类型是
的杂化类型是 分子的空间结构为
分子的空间结构为(4)
 的熔、沸点
的熔、沸点 ,原因是
,原因是II.过渡金属元素铬()是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
(5)对于基态
 原子,下列叙述正确的是
原子,下列叙述正确的是A.轨道处于半充满时体系总能量低,核外电子排布应为
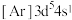
B.
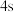 电子能量较高,总是在比
电子能量较高,总是在比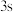 电子离核更远的地方运动
电子离核更远的地方运动C.电负性比钾高,原子对键合电子的吸引力比钾大
您最近一年使用:0次
解题方法
3 . C、O、Na、Cl、Fe、Cu是元素周期表前四周期中的常见元素。
(1)Fe在元素周期表中的位置是_____ ,Cu基态原子核外电子排布式为________ 。
(2)C和O的气态氢化物中,较稳定的是________ (写化学式)。C的电负性比Cl的________ (填“大”或“小”)。
(3)写出Na2O2与CO2反应的化学方程式____________________________ 。
(4)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:

①在石墨烯晶体中,每个C原子连接___________ 个六元环,每个六元环占有___________ 个C原子。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接__________ 个六元环,六元环中最多有_________ 个C原子在同一平面。
(5)刻蚀印刷电路的废液中含有大量的CuCl2、FeCl2、FeCl3,任意排放将导致环境污染和资源的浪费,为了使FeCl3循环利用和回收CuCl2,回收过程如下:
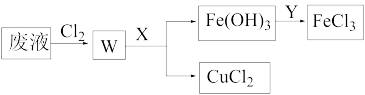
①试剂X的化学式为______________ ;
②若常温下1 L废液中含CuCl2、FeCl2、FeCl3的物质的量浓度均为0.5 mol·L-1,则加入Cl2和物质X后,过滤。为使溶液铁元素完全转化为Fe(OH)3,而CuCl2 不产生沉淀。则应控制pH的范围是____________________________ (设溶液体积保持不变),已知:Ksp[Fe(OH)3]=1.0×10-38、Ksp[Cu(OH)2]=2.0×10-20、lg5=0.7。
(1)Fe在元素周期表中的位置是
(2)C和O的气态氢化物中,较稳定的是
(3)写出Na2O2与CO2反应的化学方程式
(4)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:

①在石墨烯晶体中,每个C原子连接
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接
(5)刻蚀印刷电路的废液中含有大量的CuCl2、FeCl2、FeCl3,任意排放将导致环境污染和资源的浪费,为了使FeCl3循环利用和回收CuCl2,回收过程如下:

①试剂X的化学式为
②若常温下1 L废液中含CuCl2、FeCl2、FeCl3的物质的量浓度均为0.5 mol·L-1,则加入Cl2和物质X后,过滤。为使溶液铁元素完全转化为Fe(OH)3,而CuCl2 不产生沉淀。则应控制pH的范围是
您最近一年使用:0次



