解题方法
1 . 物质的结构决定物质的性质。请回答下列问题:
(1)下列有关物质结构与性质的说法中错误的有_______ (填标号)。
A.酸性强弱:三氟乙酸>三氯乙酸>乙酸
B.C2H4分子中的H原子与C原子之间形成s-sp2σ键
C.价层电子对互斥模型中,π键电子对数不计入中心原子的价层电子对数
D.H2S和NH3均是价层电子对数为4的极性分子,且H2S分子的键角较小
E.冰属于分子晶体,其中的氢键可以表示为O- H …O,具有“分子密堆积”特征
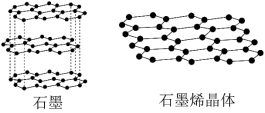
(2)石墨烯是从石墨材料中剥离出来,由碳原子组成的只有一层原子厚度的二维晶体(见下图)。从石墨中剥离出石墨烯需要破坏的作用力是_______ ,12g石墨烯中由碳原子连接成的六元环的物质的量约为_______ mol。
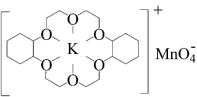
(3)冠醚是由多个二元醇分子之间失水形成的环状化合物,它们能与碱金属离子作用并随着环的大小不同而与不同金属离子作用。由于烯烃难溶于水,故被KMnO4水溶液氧化的效果较差。
①烯烃难溶于水的原因是_______ 。
②若在烯烃中溶人某冠醚,与KMnO4发生如下所示的变化后,氧化效果明显提升。加入该冠醚后,烯烃的氧化效果明显提升的原因是_______ 。
KMnO4+

(4)多原子分子中各原子若在同一平面内,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”。下列物质中存在“离域π键”的是_______(填标号)。
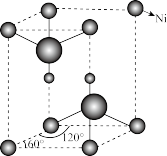
(5)硅的含氧化合物都以硅氧四面体(SiO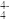 )作为基本结构单元,如图甲所示,可简化为图乙。硅氧四面体通过共用氧原子可形成各种不同的硅酸根离子,如图丙和图丁,则丙的化学式为
)作为基本结构单元,如图甲所示,可简化为图乙。硅氧四面体通过共用氧原子可形成各种不同的硅酸根离子,如图丙和图丁,则丙的化学式为_______ 。在无限长链的硅酸根离子中硅原子与氧原子个数比为_______ 。
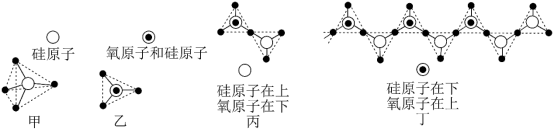
(1)下列有关物质结构与性质的说法中错误的有
A.酸性强弱:三氟乙酸>三氯乙酸>乙酸
B.C2H4分子中的H原子与C原子之间形成s-sp2σ键
C.价层电子对互斥模型中,π键电子对数不计入中心原子的价层电子对数
D.H2S和NH3均是价层电子对数为4的极性分子,且H2S分子的键角较小
E.冰属于分子晶体,其中的氢键可以表示为O- H …O,具有“分子密堆积”特征
(2)石墨烯是从石墨材料中剥离出来,由碳原子组成的只有一层原子厚度的二维晶体(见下图)。从石墨中剥离出石墨烯需要破坏的作用力是

(3)冠醚是由多个二元醇分子之间失水形成的环状化合物,它们能与碱金属离子作用并随着环的大小不同而与不同金属离子作用。由于烯烃难溶于水,故被KMnO4水溶液氧化的效果较差。
①烯烃难溶于水的原因是
②若在烯烃中溶人某冠醚,与KMnO4发生如下所示的变化后,氧化效果明显提升。加入该冠醚后,烯烃的氧化效果明显提升的原因是
KMnO4+



(4)多原子分子中各原子若在同一平面内,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”。下列物质中存在“离域π键”的是_______(填标号)。
| A.苯 | B.三氧化硫 | C.四氯化碳 | D.环己烷 |
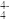 )作为基本结构单元,如图甲所示,可简化为图乙。硅氧四面体通过共用氧原子可形成各种不同的硅酸根离子,如图丙和图丁,则丙的化学式为
)作为基本结构单元,如图甲所示,可简化为图乙。硅氧四面体通过共用氧原子可形成各种不同的硅酸根离子,如图丙和图丁,则丙的化学式为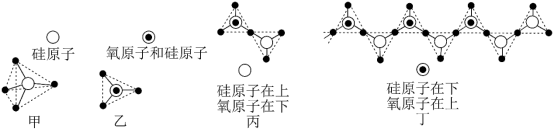
您最近一年使用:0次
2 . 近年来,科学家研究的以复合过渡金属镍的氢氧化物为催化剂、三乙醇胺为电子给体以及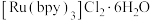 为光敏剂的催化体系,在可见光驱动下可高效催化还原
为光敏剂的催化体系,在可见光驱动下可高效催化还原 。
。
(1)下列有关Ni原子的叙述正确的是___________(填标号)。
(2)三乙醇胺的制备:3 +NH3
+NH3 N(CH2CH2OH)3
N(CH2CH2OH)3
①三乙醇胺中所含的元素(除H元素外),第一电离能由小到大的顺序为___________ 。
②下列关于 和
和 的叙述正确的是
的叙述正确的是___________ 。
A.中心原子的价层电子对数相同
B.中心原子的杂化方式不同
C.分子的VSEPR模型相同
D. 分子的键角比
分子的键角比 分子的键角大
分子的键角大
(3)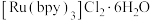 中配体bpy分子的结构简式为
中配体bpy分子的结构简式为 ,分子中N原子的杂化类型为
,分子中N原子的杂化类型为___________ ,则1mol配体bpy分子中含有σ键的数目为___________ 。与bpy分子有相似结构的单环分子吡啶的结构简式为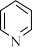 ,吡啶分子中的大
,吡啶分子中的大 键可表示为
键可表示为___________ (用 的形式表示,m表示原子数,n表示电子数)。
的形式表示,m表示原子数,n表示电子数)。
(4)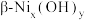 的晶胞结构如图(氧、氢原子均位于晶胞内部)所示。已知晶胞的底边长为apm,高为cpm,阿伏加德罗常数的值为NA,则该晶胞的密度为
的晶胞结构如图(氧、氢原子均位于晶胞内部)所示。已知晶胞的底边长为apm,高为cpm,阿伏加德罗常数的值为NA,则该晶胞的密度为___________ g/cm3(列出表达式)。
 为光敏剂的催化体系,在可见光驱动下可高效催化还原
为光敏剂的催化体系,在可见光驱动下可高效催化还原 。
。(1)下列有关Ni原子的叙述正确的是___________(填标号)。
| A.第一电离能比钙的大 |
B.基态Ni原子的核外价电子排布式为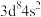 |
C.基态Ni原子形成基态 时,先失去3d轨道上的电子 时,先失去3d轨道上的电子 |
| D.基态Co原子第五电离能比基态Ni原子第五电离能大 |
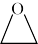 +NH3
+NH3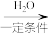 N(CH2CH2OH)3
N(CH2CH2OH)3①三乙醇胺中所含的元素(除H元素外),第一电离能由小到大的顺序为
②下列关于
 和
和 的叙述正确的是
的叙述正确的是A.中心原子的价层电子对数相同
B.中心原子的杂化方式不同
C.分子的VSEPR模型相同
D.
 分子的键角比
分子的键角比 分子的键角大
分子的键角大(3)
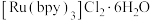 中配体bpy分子的结构简式为
中配体bpy分子的结构简式为 ,分子中N原子的杂化类型为
,分子中N原子的杂化类型为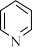 ,吡啶分子中的大
,吡啶分子中的大 键可表示为
键可表示为 的形式表示,m表示原子数,n表示电子数)。
的形式表示,m表示原子数,n表示电子数)。(4)
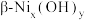 的晶胞结构如图(氧、氢原子均位于晶胞内部)所示。已知晶胞的底边长为apm,高为cpm,阿伏加德罗常数的值为NA,则该晶胞的密度为
的晶胞结构如图(氧、氢原子均位于晶胞内部)所示。已知晶胞的底边长为apm,高为cpm,阿伏加德罗常数的值为NA,则该晶胞的密度为
您最近一年使用:0次
2022-03-14更新
|
463次组卷
|
3卷引用:湖北省重点高中智学联盟2021-2022学年高二下学期3月联考化学试题
名校
解题方法
3 . 下表为长式周期表的一部分其中的编号代表对应的元素。
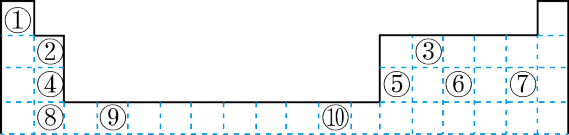
请回答下列问题:
(1)表中属于 ds 区的元素是___________ (填元素符号)它的基态原子的价电子排布式为___________ 。
(2)表中元素①的 6 个原子与元素③的 6 个原子形成的某种平面环状分子其分子式为___________ ,其中元素③的基态原子的电子排布图为_______ ;①和⑥形成的一种常见四原子分子的化学式为_______ ,该分子的立体构型为______ 。
(3)某元素原子的价电子排布式为 nsnnpn+1,该元素原子的电子层上未成对电子数为___________ ;该元素与元素①形成的最简单分子 X 的电子式为___________ 。
(4)元素⑤的电负性___________ ④元素的电负性(选填>、=、<下同);元素⑥的第一电离能___________ 原子序数为 16 的元素的第一电离能。
(5)用电子式表示元素④和⑦组成的化合物的形成过程___________ 。

请回答下列问题:
(1)表中属于 ds 区的元素是
(2)表中元素①的 6 个原子与元素③的 6 个原子形成的某种平面环状分子其分子式为
(3)某元素原子的价电子排布式为 nsnnpn+1,该元素原子的电子层上未成对电子数为
(4)元素⑤的电负性
(5)用电子式表示元素④和⑦组成的化合物的形成过程
您最近一年使用:0次



