名校
解题方法
1 . 我国是世界上最早制得和使用金属锌的国家,锌在人类生产生活中有重要应用。回答下列问题:
I. 一种 Zn2+配合物广泛应用于催化剂,光导体,光动力疗法,其结构如图所示:
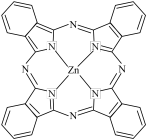
(1)Zn2+价电子轨道表示式为__________ 。
(2)该配合物中电负性最大的元素是__________ 。
(3)下列状态的氮中,电离最外层一个电子所需能量最大的是__________。(填序号)
(4)该配合物中 C 的轨道杂化类型为__________ 。
(5)该配合物中 Zn2+的配位数为__________ 个。
Ⅱ. ZnS 常用作分析试剂、荧光体、白色颜料等。
(6)ZnS 常见有 2 种晶胞结构如下图:立方晶胞(左图)和六方晶胞(右图)。
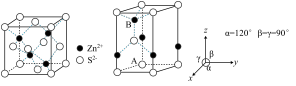
下列说法错误的是__________。(填序号)
(7)立方 ZnS 中,若 Zn2+与 S2-最短距离为 a nm,则晶胞密度ρ=__________ g·cm-3(列出计算式,阿伏加德罗常数的值为 NA)。
I. 一种 Zn2+配合物广泛应用于催化剂,光导体,光动力疗法,其结构如图所示:

(1)Zn2+价电子轨道表示式为
(2)该配合物中电负性最大的元素是
(3)下列状态的氮中,电离最外层一个电子所需能量最大的是__________。(填序号)
| A.[He]2s22p3 | B.[He]2s22p2 |
| C.[He]2s22p23s1 | D.[He]2s22p13s1 |
(5)该配合物中 Zn2+的配位数为
Ⅱ. ZnS 常用作分析试剂、荧光体、白色颜料等。
(6)ZnS 常见有 2 种晶胞结构如下图:立方晶胞(左图)和六方晶胞(右图)。

下列说法错误的是__________。(填序号)
| A.立方 ZnS 中与 S2—最近的 S2—有 12 个 | B.两种晶胞中 Zn2+的个数都为4 |
| C.立方 ZnS 中 S2—的配位数为 4 | D.可用 X—射线衍射实验鉴别六方 ZnS 是否属于晶体 |
您最近一年使用:0次
名校
解题方法
2 . 硼及其化合物广泛应用于高新材料领域,请回答下列有关问题:
(1)NaBH4是一种重要的储氢载体,其中涉及元素的电负性由大到小的顺序为______ 。
(2)硼氮苯被称为无机苯,其结构如图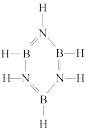 ,分子中氮原子的杂化方式是
,分子中氮原子的杂化方式是___________ 。已知硼氮苯分子在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“大π键”,该“大π键”可表示为__________ (用 表示,其中n表示参与形成大π键的原子数,m表示形成大π键的电子数)。
表示,其中n表示参与形成大π键的原子数,m表示形成大π键的电子数)。
(3)硼酸(H3BO3)为白色片状晶体,有与石墨相似的层状结构,则硼酸晶体中存在的作用力有共价键、_______ 。
(4)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。
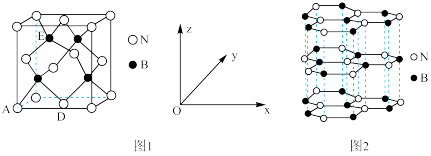
①晶胞中的原子坐标参数可表示晶胞内部各原子的相对位置。图1中原子坐标参数A为(0,0,0),D为( ,
, ,0),则E原子的坐标参数为
,0),则E原子的坐标参数为___________ 。X-射线衍射实验测得立方氮化硼晶胞边长为a pm,则立方氮化硼晶体中N与B的原子半径之和为________ pm(用含a的式子表示)。
②已知六方氮化硼同层中B-N距离为145 pm,层与层之间距离为333 pm,则晶体密度的计算式为_________ g·cm-3。(已知正六边形面积为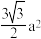 ,a为边长,NA表示阿伏加 德罗常数)
,a为边长,NA表示阿伏加 德罗常数)
(1)NaBH4是一种重要的储氢载体,其中涉及元素的电负性由大到小的顺序为
(2)硼氮苯被称为无机苯,其结构如图
 ,分子中氮原子的杂化方式是
,分子中氮原子的杂化方式是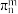 表示,其中n表示参与形成大π键的原子数,m表示形成大π键的电子数)。
表示,其中n表示参与形成大π键的原子数,m表示形成大π键的电子数)。(3)硼酸(H3BO3)为白色片状晶体,有与石墨相似的层状结构,则硼酸晶体中存在的作用力有共价键、
(4)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。

①晶胞中的原子坐标参数可表示晶胞内部各原子的相对位置。图1中原子坐标参数A为(0,0,0),D为(
 ,
, ,0),则E原子的坐标参数为
,0),则E原子的坐标参数为②已知六方氮化硼同层中B-N距离为145 pm,层与层之间距离为333 pm,则晶体密度的计算式为
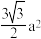 ,a为边长,NA表示阿伏加 德罗常数)
,a为边长,NA表示阿伏加 德罗常数)
您最近一年使用:0次
2020-08-03更新
|
287次组卷
|
3卷引用:广西钦州市第一中学2021届高三8月月考理科综合化学试题
解题方法
3 . 碳、氧、氮、镁、铬、铁、锌是几种重要的元素,请回答下列问题:
(1)铝的基态原子的价电子排布式是_________________ 。
(2)用水解法制备一种磁性材料铁氧体时常加入尿素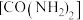 、醋酸钠等碱性物质。尿素分子中所含非金属元素的电负性由大到小的顺序是
、醋酸钠等碱性物质。尿素分子中所含非金属元素的电负性由大到小的顺序是_________ ,分子中 键和
键和 键的数目之比为
键的数目之比为__________ 。醋酸钠中碳原子的杂化类型为____________ 。
(3)Mg2+、 等金属离子与
等金属离子与 、
、 能形成稳定金属配离子,其中形成的化合物稳定性相对较高的是
能形成稳定金属配离子,其中形成的化合物稳定性相对较高的是__________  填“
填“ ”或“
”或“ ”
” ,其原因是
,其原因是__________ ;已知氨 熔点:
熔点: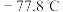 、沸点:
、沸点: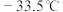 ,联氨
,联氨 熔点:
熔点: 、沸点:
、沸点: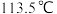 ,解释其熔沸点高低的主要原因:
,解释其熔沸点高低的主要原因:______________ 。
(4)碳溶解在 中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为
中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为__________ 。若晶体密度为 ,则晶胞中最近的两个碳原子的距离为
,则晶胞中最近的两个碳原子的距离为__________ 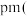 阿伏加 德罗常数的值用
阿伏加 德罗常数的值用 表示,写出简化后的计算式即可
表示,写出简化后的计算式即可 。
。

(1)铝的基态原子的价电子排布式是
(2)用水解法制备一种磁性材料铁氧体时常加入尿素
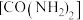 、醋酸钠等碱性物质。尿素分子中所含非金属元素的电负性由大到小的顺序是
、醋酸钠等碱性物质。尿素分子中所含非金属元素的电负性由大到小的顺序是 键和
键和 键的数目之比为
键的数目之比为(3)Mg2+、
 等金属离子与
等金属离子与 、
、 能形成稳定金属配离子,其中形成的化合物稳定性相对较高的是
能形成稳定金属配离子,其中形成的化合物稳定性相对较高的是 填“
填“ ”或“
”或“ ”
” ,其原因是
,其原因是 熔点:
熔点: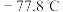 、沸点:
、沸点: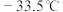 ,联氨
,联氨 熔点:
熔点: 、沸点:
、沸点: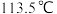 ,解释其熔沸点高低的主要原因:
,解释其熔沸点高低的主要原因:(4)碳溶解在
 中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为
中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为 ,则晶胞中最近的两个碳原子的距离为
,则晶胞中最近的两个碳原子的距离为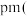 阿伏加 德罗常数的值用
阿伏加 德罗常数的值用 表示,写出简化后的计算式即可
表示,写出简化后的计算式即可 。
。 
您最近一年使用:0次
2020-01-27更新
|
189次组卷
|
2卷引用:广西贵港市2020届高三上学期12月月考理科综合化学试题
解题方法
4 . 天宫二号空间实验室于2016年9月15 日在酒泉卫星发射中心发射成功。实验室承载了10余项太空实验,其中包含了好比科幻英雄“综合材料”多晶碲化锌(ZnTe)的实验。
(1)电负性Zn___________ Te(填“>”或“<”或“=”)。
(2)O、S、Se与Te元素位于同一主族。基态碲(Te)原子核外电子排布式为[Kr]________ ,有_______ 个未成对电子。
(3)H2O、H2S、H2Se沸点由低到高顺序为______ ,推断的依据是_______ ;SO2分子中S原子采取_____ 杂化;用价层电子对互斥理论解释SO42-的键角大于SO32-的原因是____________ 。
(4)向氯化锌溶液中加入过量的氨水,得到[Zn(NH3)4]Cl2,此配位化合物中含有的化学键有共价键、____ 、_______ 。
(5)碲化锌晶体有两种结构,其中一种晶胞结构如下图:
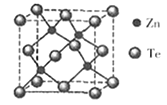
晶胞中含有_____ 个Te原子;与Te原子距离最近的Te原子有______ 个;若两个距离最近的Te原子间距为apm.则晶体密度为_________ g/cm3。
(1)电负性Zn
(2)O、S、Se与Te元素位于同一主族。基态碲(Te)原子核外电子排布式为[Kr]
(3)H2O、H2S、H2Se沸点由低到高顺序为
(4)向氯化锌溶液中加入过量的氨水,得到[Zn(NH3)4]Cl2,此配位化合物中含有的化学键有共价键、
(5)碲化锌晶体有两种结构,其中一种晶胞结构如下图:

晶胞中含有
您最近一年使用:0次



