铬是一种应用广泛的金属材料。请回答下列问题:
(1)基态铬的价电子排布式为_____________ ,其单电子数目为______________ 。
(2)Cr(NH3)3F3中所含非金属元素的电负性由大到小的顺序是_______________ 。
(3)NH3中N的价层电子对数为____________ ,已知Cr(NH3)3F3中Cr的配位数为6,Cr的配位原子是_____________ ,NH3与Cr3+成键后,N的杂化类型为 ____________ 。
(4)Cr(NH3)3F3固体易升华,其熔沸点均较NaCl 低很多,其原因是________________ 。
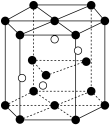
(5)将Cr(NH3)3F3在充足氧气中灼烧有Cr2O3生成,从Cr2O3晶体中取出的具有重复性的六棱柱结构如图所示,已知Cr2O3的摩尔质量为Mg/mol,晶体的密度为ρg/cm3,六棱柱的体积为Vcm3。六棱柱结构内部的小白球代表________ (填“铬离子”或“氧离子”)阿伏加 德罗常数NA =___________ mol-1(用含M,V,ρ的代数式表示)。
(1)基态铬的价电子排布式为
(2)Cr(NH3)3F3中所含非金属元素的电负性由大到小的顺序是
(3)NH3中N的价层电子对数为
(4)Cr(NH3)3F3固体易升华,其熔沸点均较NaCl 低很多,其原因是
(5)将Cr(NH3)3F3在充足氧气中灼烧有Cr2O3生成,从Cr2O3晶体中取出的具有重复性的六棱柱结构如图所示,已知Cr2O3的摩尔质量为Mg/mol,晶体的密度为ρg/cm3,六棱柱的体积为Vcm3。六棱柱结构内部的小白球代表

更新时间:2020-04-18 14:48:01
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
【推荐1】短周期元素a、b、c、d的原子序数依次增大,c和d位于同主族且原子序数相差8;基态a原子核外有3个能级上容纳电子且每个能级上电子数相等,c原子s能级电子总数与p能级电子数相等,基态e原子的M层上有2个未成对电子且无空轨道。
(1)在a、b、c中,第一电离能由大到小排序为_______ (用元素符号表示);基态e原子的价层电子排布式为_____________ 。
(2)配合物e(ac)4在常温下呈液态,易溶于四氯化碳、苯等有机溶剂。固态e(ac)4的晶体类型是________ 。已知(dab)2分子中含非极性键,分子中每个原子最外层都达到8个电子稳定结构,1mol(dab)2分子含σ键的数目为_________ 。
(3)写出一种与dab-互为等电子体的分子__________ (填化学式)。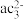 的中心原子杂化类型为
的中心原子杂化类型为______ ; 的空间构型为
的空间构型为___________ 。
(4)ec晶胞结构如图所示,其晶胞参数为a pm,列式计算该晶胞的密度为_________ g·cm-3(不必计算出结果,阿伏加德罗常数的值为NA),晶胞中c粒子的配位数为_____________ 。
(5)人工合成的ec晶胞存在缺陷,即阳离子有+3、+2价两种。某人工合成的晶体样品组成为e0.96c,则该晶体中+3价、+2价两种离子的个数之比为__________ 。
(1)在a、b、c中,第一电离能由大到小排序为
(2)配合物e(ac)4在常温下呈液态,易溶于四氯化碳、苯等有机溶剂。固态e(ac)4的晶体类型是
(3)写出一种与dab-互为等电子体的分子
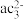 的中心原子杂化类型为
的中心原子杂化类型为 的空间构型为
的空间构型为(4)ec晶胞结构如图所示,其晶胞参数为a pm,列式计算该晶胞的密度为

(5)人工合成的ec晶胞存在缺陷,即阳离子有+3、+2价两种。某人工合成的晶体样品组成为e0.96c,则该晶体中+3价、+2价两种离子的个数之比为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】铁元素是人体必需的元素之一,补铁剂常用于防治缺铁性贫血。第一代口服补铁剂以硫酸亚铁为代表;第二代口服补铁剂以乳酸亚铁、富马酸亚铁等为代表。
(1)铁元素位于元素周期表的_____。
(2)基态Fe2+的核外电子排布式是_____。
(3)实验室配制FeSO4溶液时,常加入少量的_____。
(4)检验FeSO4溶液是否变质的试剂可用_____。
(5)血红蛋白是红细胞内运输氧的特殊蛋白质。血红蛋白中电负性最大的元素是______ (填写元素符号);O2通过配位键与血红蛋白中的Fe2+结合,O2提供_______ ,Fe2+提供_______ 。
(6)某兴趣小组用酸性KMnO4溶液滴定Fe2+,通过测定Fe2+的含量来计算某补铁剂中[CH3CH(OH)COO]2Fe·3H2O(乳酸亚铁)的质量分数,发现乳酸亚铁的质量分数总是大于100%,其原因可能是______ 。
(7)富马酸( )和马来酸(
)和马来酸( )为顺反异构体,两者的熔点及电离平衡常数如下表:
)为顺反异构体,两者的熔点及电离平衡常数如下表:
①富马酸分子中的σ键和π键个数比为______ 。
②氢键不仅存在于分子之间,也可以存在于分子内。解释富马酸的熔点比马来酸的熔点高的原因_______ 。预测a____ b(填“>”、“<”或“=”)。
(1)铁元素位于元素周期表的_____。
| A.s区 | B.d区 | C.p区 | D.f区 |
(2)基态Fe2+的核外电子排布式是_____。
| A.[Ar]3d54s2 | B.[Ar]3d54s1 | C.[Ar]3d5 | D.[Ar]3d6 |
(3)实验室配制FeSO4溶液时,常加入少量的_____。
| A.铁粉 | B.铜粉 | C.盐酸 | D.硫酸 |
(4)检验FeSO4溶液是否变质的试剂可用_____。
| A.稀盐酸 | B.酚酞试液 | C.KSCN溶液 | D.苯酚 |
(5)血红蛋白是红细胞内运输氧的特殊蛋白质。血红蛋白中电负性最大的元素是
(6)某兴趣小组用酸性KMnO4溶液滴定Fe2+,通过测定Fe2+的含量来计算某补铁剂中[CH3CH(OH)COO]2Fe·3H2O(乳酸亚铁)的质量分数,发现乳酸亚铁的质量分数总是大于100%,其原因可能是
(7)富马酸(
 )和马来酸(
)和马来酸( )为顺反异构体,两者的熔点及电离平衡常数如下表:
)为顺反异构体,两者的熔点及电离平衡常数如下表:| 物质名称 | 熔点 | Ka1 |
| 富马酸 | 300℃ | a |
| 马来酸 | 140℃ | b |
②氢键不仅存在于分子之间,也可以存在于分子内。解释富马酸的熔点比马来酸的熔点高的原因
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】75号元素铼(Re),熔点仅次于钨,是制造航空发动机的必需元素。地壳中铼的含量极低,多伴生于钼、铜、锌、铅等矿物中。
(1)锰与铼处于同一族,锰原子电子排布式为___________ ,它处于周期的___________ 区。
(2)与铼伴生的铜能形成多种配合物。如醋酸二氨合铜(Ⅰ) 可用于吸收合成氨中对催化剂有害的CO气体:
可用于吸收合成氨中对催化剂有害的CO气体: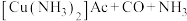
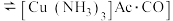 (Ac表示醋酸根)。
(Ac表示醋酸根)。
①与铜离子形成配合物的分子或离子应具备的结构特征是___________ 。
②配位体 中N原子的杂化类型为
中N原子的杂化类型为___________ , 配离子
配离子 中含有
中含有 键的数目为
键的数目为___________ 。
③写出与CO互为等电子体的一种分子的化学式___________ 。
(3)分别向 、
、 溶液加氨水至过量,前者为深蓝色溶液,后者为白色沉淀。
溶液加氨水至过量,前者为深蓝色溶液,后者为白色沉淀。
① 与
与 形成配合物的能力大于
形成配合物的能力大于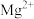 的原因为
的原因为___________ 。
②溶液中的水存在 、
、 等微粒形式,
等微粒形式, 可看作是
可看作是 与
与 通过氢键形成的离子,写出
通过氢键形成的离子,写出 的结构式
的结构式___________ 。
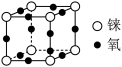
(4)三氧化铼为立方晶胞,结构如图,晶胞参数为3.74pm,铼原子占据顶点,氧原子占据所有棱心。则铼原子的配位数为___________ ,三氧化铼的密度为___________  (用
(用 表示阿伏加德罗常数的值,写计算式即可)。
表示阿伏加德罗常数的值,写计算式即可)。
(1)锰与铼处于同一族,锰原子电子排布式为
(2)与铼伴生的铜能形成多种配合物。如醋酸二氨合铜(Ⅰ)
 可用于吸收合成氨中对催化剂有害的CO气体:
可用于吸收合成氨中对催化剂有害的CO气体: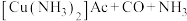
 (Ac表示醋酸根)。
(Ac表示醋酸根)。①与铜离子形成配合物的分子或离子应具备的结构特征是
②配位体
 中N原子的杂化类型为
中N原子的杂化类型为 配离子
配离子 中含有
中含有 键的数目为
键的数目为③写出与CO互为等电子体的一种分子的化学式
(3)分别向
 、
、 溶液加氨水至过量,前者为深蓝色溶液,后者为白色沉淀。
溶液加氨水至过量,前者为深蓝色溶液,后者为白色沉淀。①
 与
与 形成配合物的能力大于
形成配合物的能力大于 的原因为
的原因为②溶液中的水存在
 、
、 等微粒形式,
等微粒形式, 可看作是
可看作是 与
与 通过氢键形成的离子,写出
通过氢键形成的离子,写出 的结构式
的结构式(4)三氧化铼为立方晶胞,结构如图,晶胞参数为3.74pm,铼原子占据顶点,氧原子占据所有棱心。则铼原子的配位数为
 (用
(用 表示阿伏加德罗常数的值,写计算式即可)。
表示阿伏加德罗常数的值,写计算式即可)。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】(1)红细胞中血红素结构如图所示,回答下列问题:
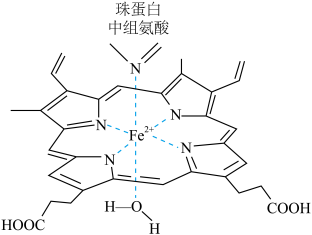
①Fe2+的轨道表示式[Ar]________ 。
②所含短周期元素电负性从大到小的顺序是___________ 。
③羧基中碳原子的杂化轨道方式是______________ 。
④在肺部,血红素中的Fe2+结合的水分子与氧分子交换,形成氧合血红蛋白,经动脉运送到组织释放出O2;然后血红素结合组织代谢所产生的CO2,经静脉送回肺中与水分子交换,最后将CO2排出体外,完成呼吸过程。血红素中Fe2+与CO2中____ 原子以____ 形式结合,这种结合是可逆的,比Fe2+与N的结合弱的原因是______________ 。
(2)磁性氧化铁Fe3O4含有Fe2+和Fe3+,其晶体属于立方晶系,氧原子呈面心立方密堆积,Fe3+和一半的Fe3+随机占据八面体空穴,电子可在Fe2+、Fe3+间迅速发生转移,另一半Fe3+作阳离占据四面体空穴。Fe3O4是一种盐,其真实结构可较好地表示为_________ [Fe2+和Fe3+分别用Fe(II)、Fe(III)表示];该晶体_____ 导电(填“能”、“不能”);该晶体的密度为5.18g·cm-3,其晶胞中最近的两个氧原子之间的核间距_________ cm(列出计算式,不必计算最终结果)。

①Fe2+的轨道表示式[Ar]
②所含短周期元素电负性从大到小的顺序是
③羧基中碳原子的杂化轨道方式是
④在肺部,血红素中的Fe2+结合的水分子与氧分子交换,形成氧合血红蛋白,经动脉运送到组织释放出O2;然后血红素结合组织代谢所产生的CO2,经静脉送回肺中与水分子交换,最后将CO2排出体外,完成呼吸过程。血红素中Fe2+与CO2中
(2)磁性氧化铁Fe3O4含有Fe2+和Fe3+,其晶体属于立方晶系,氧原子呈面心立方密堆积,Fe3+和一半的Fe3+随机占据八面体空穴,电子可在Fe2+、Fe3+间迅速发生转移,另一半Fe3+作阳离占据四面体空穴。Fe3O4是一种盐,其真实结构可较好地表示为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】硒、铁是人体不可缺少的微量元素,它们的化合物在生产、生活中有着广泛的应用。回答下列问题:
(1)基态 原子的核外价电子排布式为
原子的核外价电子排布式为___________ 。
(2)“依布硒”是一种有机硒化物,具有良好的抗炎活性,其结构简式如图所示。分子中元素Se、O、N的第一电离能由大到小的顺序为___________ 。
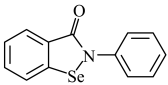
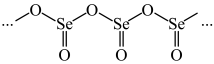
(3)硒的某种氧化物为链状聚合结构(如图),该氧化物的最简式为___________ 。
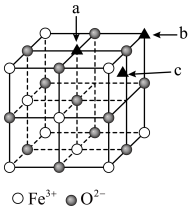
(4) 是一种优良的磁性材料,该
是一种优良的磁性材料,该 晶胞的
晶胞的 的结构如图所示,研究发现结构中的
的结构如图所示,研究发现结构中的 只可能出现在图中某一“▲”所示位置上,请确定
只可能出现在图中某一“▲”所示位置上,请确定 所在晶胞的位置
所在晶胞的位置___________ 。
(5)科学家利用 在Fe基催化剂上加氢成功制得甲酸,已知
在Fe基催化剂上加氢成功制得甲酸,已知 (加成反应),
(加成反应), 。根据电负性的相对大小,画出中间体X的结构简式:
。根据电负性的相对大小,画出中间体X的结构简式:______ 。
(6)1183K以下纯铁晶体的基本结构单元如下左图所示,1183K以上转变为如下右图所示结构的基本结构单元,在两种晶体中最邻近的铁原子间距离相同。
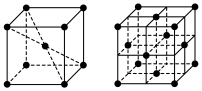
①在1183K以下的纯铁晶体中,铁原子的配位数为___________ 。
②两种晶胞中含铁原子数之比___________ 。
(1)基态
 原子的核外价电子排布式为
原子的核外价电子排布式为(2)“依布硒”是一种有机硒化物,具有良好的抗炎活性,其结构简式如图所示。分子中元素Se、O、N的第一电离能由大到小的顺序为

(3)硒的某种氧化物为链状聚合结构(如图),该氧化物的最简式为

(4)
 是一种优良的磁性材料,该
是一种优良的磁性材料,该 晶胞的
晶胞的 的结构如图所示,研究发现结构中的
的结构如图所示,研究发现结构中的 只可能出现在图中某一“▲”所示位置上,请确定
只可能出现在图中某一“▲”所示位置上,请确定 所在晶胞的位置
所在晶胞的位置
(5)科学家利用
 在Fe基催化剂上加氢成功制得甲酸,已知
在Fe基催化剂上加氢成功制得甲酸,已知 (加成反应),
(加成反应), 。根据电负性的相对大小,画出中间体X的结构简式:
。根据电负性的相对大小,画出中间体X的结构简式:(6)1183K以下纯铁晶体的基本结构单元如下左图所示,1183K以上转变为如下右图所示结构的基本结构单元,在两种晶体中最邻近的铁原子间距离相同。

①在1183K以下的纯铁晶体中,铁原子的配位数为
②两种晶胞中含铁原子数之比
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐3】环烷酸金属(Cu、Ni、Co、Sn、Zn)盐常作为合成聚氨酯过程中的有效催化剂。回答下列问题:
(1)基态Cu原子的价电子排布____ ,金属Cu晶体采取的是以下____ (填序号)面心立方最密堆积方式。

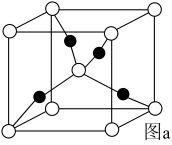
如图a所示,(●代表Cu原子,○代表O原子),一个Cu2O晶胞中Cu原子的数目为___ 。
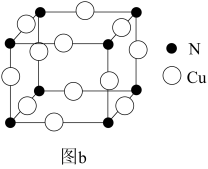
N和Cu形成的化合物的晶胞结构如图所示,该化合物的相对分子质量为M,NA为阿伏加德罗常数。若该晶胞的边长为apm,则该晶体的密度是____ g•cm-3。
(2)镍的氨合离子[Ni(NH3)6]2+中存在的化学键有___ 。
A.离子键B.共价键C.配位键D.氢键E.σ键F.π键
(3)Ni、Co的第五电离能:I5(Ni)=73339kJ·mol-1,I5(Co)=7670kJ·mol-1,I5(Ni)<I5(Co),其原因是____ 。橙红色晶体羰基钴[Co2(Co)8]的熔点为52℃,可溶于多数有机溶剂。该晶体中三种元素电负性由大到小的顺序为___ (填元素符号)。配体CO中σ键与π键数目之比是___ 。
(4)硒化锌晶胞结构如图所示,其晶胞参数为apm。

①相邻的Se2+与Zn2+之间的距离为___ pm。
②已知原子坐标:A点为(0,0,0),B点为(1,1,1),则C点的原子坐标___ 。
(1)基态Cu原子的价电子排布

如图a所示,(●代表Cu原子,○代表O原子),一个Cu2O晶胞中Cu原子的数目为

N和Cu形成的化合物的晶胞结构如图所示,该化合物的相对分子质量为M,NA为阿伏加德罗常数。若该晶胞的边长为apm,则该晶体的密度是

(2)镍的氨合离子[Ni(NH3)6]2+中存在的化学键有
A.离子键B.共价键C.配位键D.氢键E.σ键F.π键
(3)Ni、Co的第五电离能:I5(Ni)=73339kJ·mol-1,I5(Co)=7670kJ·mol-1,I5(Ni)<I5(Co),其原因是
(4)硒化锌晶胞结构如图所示,其晶胞参数为apm。

①相邻的Se2+与Zn2+之间的距离为
②已知原子坐标:A点为(0,0,0),B点为(1,1,1),则C点的原子坐标
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】ⅢA族与ⅤA族元素及其化合物具有众多优良特性,可用于制作航天器等耐高温设备。回答下列问题。
(1)Al原子中电子占据的最高能层符号为_______ ,第三周期元素中第一电离能介于Al和P有_______ 种
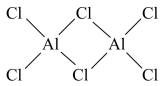
(2)AlCl3在气态时可以发生二聚,其分子式为Al2Cl6,其二聚体结构如图,请在图中以“→”表示该结构中存在的配位键。其中Cl-Al-Cl键角的大小情况是AlCl3_______ Al2Cl6(填“<”、“>”或“=”下同)原因为_______ 。
(3)咪唑结构为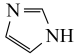 ,N原子的杂化类型为
,N原子的杂化类型为_______ ,分子中的大π键可以用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则咪唑中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则咪唑中的大π键可表示为_______ 。
(4)噻唑结构与咪唑很相似,结构为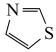 ,噻唑的熔沸点
,噻唑的熔沸点_______ 咪唑,原因是_______ 。
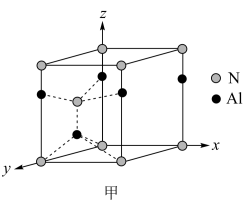
(5)氮化铝晶体是第三代半导体材料的典型代表之一,属于六方晶系,其晶胞结构如图甲所示,Al原子位于氮原子形成的_______ 空隙(填“正四面体”或“正八面体”)。已知晶胞的密度为ρ g·cm-3,两种原子半径分别为rN nm和rAl nm,阿伏加德罗常数值为NA,则该晶胞中原子的体积占晶胞体积的百分率为_______ 。(用含ρ、rN 、rAl和NA的代数式表示)
(1)Al原子中电子占据的最高能层符号为
(2)AlCl3在气态时可以发生二聚,其分子式为Al2Cl6,其二聚体结构如图,请在图中以“→”表示该结构中存在的配位键。其中Cl-Al-Cl键角的大小情况是AlCl3

(3)咪唑结构为
 ,N原子的杂化类型为
,N原子的杂化类型为 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则咪唑中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数。则咪唑中的大π键可表示为(4)噻唑结构与咪唑很相似,结构为
 ,噻唑的熔沸点
,噻唑的熔沸点(5)氮化铝晶体是第三代半导体材料的典型代表之一,属于六方晶系,其晶胞结构如图甲所示,Al原子位于氮原子形成的

您最近一年使用:0次
【推荐2】含铬废水中通常含有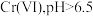 时主要以
时主要以 形式存在,
形式存在,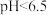 时主要以
时主要以 、
、 形式存在。采用沉淀法、吸附法能对含铬废水进行有效处理。
形式存在。采用沉淀法、吸附法能对含铬废水进行有效处理。
(1)酸性条件下,加入 溶液能将
溶液能将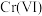 还原为
还原为 ,再加碱沉淀出
,再加碱沉淀出 。
。 将
将 还原为
还原为 的离子方程式为
的离子方程式为___________ 。
(2)将含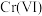 废水调至酸性,加入NaCl固体,利用Fe作电极进行电解,阳极生成的
废水调至酸性,加入NaCl固体,利用Fe作电极进行电解,阳极生成的 将
将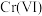 还原为
还原为 ,并生成
,并生成 和
和 。
。
①加入NaCl固体的目的是___________ 。
②电解过程中能生成 和
和 的原因是
的原因是___________ 。
(3)石墨烯经化学处理能获得连有酰胺基、羧基等基团的氧化石墨烯(AGO),AGO在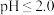 时能失去
时能失去 电子。如图为AGO表面Zeta电位(“±”和数值分别表示吸附剂表面电荷的电性和相对数量)随pH变化的曲线。
电子。如图为AGO表面Zeta电位(“±”和数值分别表示吸附剂表面电荷的电性和相对数量)随pH变化的曲线。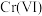 的去除率较高,可能的原因是
的去除率较高,可能的原因是___________ 。
②如图为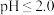 时AGO去除
时AGO去除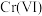 的机制。研究表明AGO对
的机制。研究表明AGO对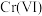 的去除率pH=2.0时高于pH=4.72时,可能的原因是
的去除率pH=2.0时高于pH=4.72时,可能的原因是___________ 。
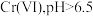 时主要以
时主要以 形式存在,
形式存在,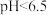 时主要以
时主要以 、
、 形式存在。采用沉淀法、吸附法能对含铬废水进行有效处理。
形式存在。采用沉淀法、吸附法能对含铬废水进行有效处理。(1)酸性条件下,加入
 溶液能将
溶液能将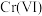 还原为
还原为 ,再加碱沉淀出
,再加碱沉淀出 。
。 将
将 还原为
还原为 的离子方程式为
的离子方程式为(2)将含
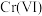 废水调至酸性,加入NaCl固体,利用Fe作电极进行电解,阳极生成的
废水调至酸性,加入NaCl固体,利用Fe作电极进行电解,阳极生成的 将
将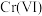 还原为
还原为 ,并生成
,并生成 和
和 。
。①加入NaCl固体的目的是
②电解过程中能生成
 和
和 的原因是
的原因是(3)石墨烯经化学处理能获得连有酰胺基、羧基等基团的氧化石墨烯(AGO),AGO在
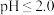 时能失去
时能失去 电子。如图为AGO表面Zeta电位(“±”和数值分别表示吸附剂表面电荷的电性和相对数量)随pH变化的曲线。
电子。如图为AGO表面Zeta电位(“±”和数值分别表示吸附剂表面电荷的电性和相对数量)随pH变化的曲线。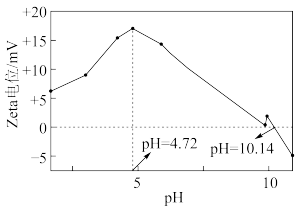
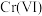 的去除率较高,可能的原因是
的去除率较高,可能的原因是②如图为
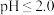 时AGO去除
时AGO去除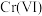 的机制。研究表明AGO对
的机制。研究表明AGO对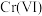 的去除率pH=2.0时高于pH=4.72时,可能的原因是
的去除率pH=2.0时高于pH=4.72时,可能的原因是
您最近一年使用:0次
【推荐3】氮及其化合物与我们的生产、生活联系非常密切。
(1)工业上以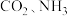 为原料生产尿素
为原料生产尿素 ,反应分两步进行:
,反应分两步进行:
Ⅰ:
Ⅱ: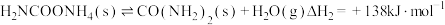
已知: 。
。
①请写出以 为原料,合成尿素和液态水的热化学方程式:
为原料,合成尿素和液态水的热化学方程式:___________ 。
② 时,在
时,在 的密闭容器中充入
的密闭容器中充入 和
和 模拟工业生产,
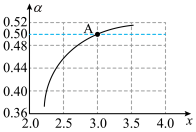
模拟工业生产, ,如图是
,如图是 平衡转化率
平衡转化率 与x的关系,计算图中A点
与x的关系,计算图中A点 的平衡转化率
的平衡转化率
___________ (填分数)。 转变为
转变为 ,其工作原理如图,M极接电源的
,其工作原理如图,M极接电源的___________ 极,N极的电极反应式为___________ 。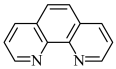 ,简写为phen,遇
,简写为phen,遇 溶液生成橙红色配合物
溶液生成橙红色配合物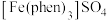 ,其中
,其中 的配位数为6。
的配位数为6。
① 中,phen的
中,phen的___________ 个N参与配位;
② 中,
中,___________ 提供空轨道,___________ 提供孤对电子。
(1)工业上以
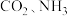 为原料生产尿素
为原料生产尿素 ,反应分两步进行:
,反应分两步进行:Ⅰ:

Ⅱ:
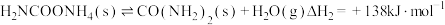
已知:
 。
。①请写出以
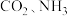 为原料,合成尿素和液态水的热化学方程式:
为原料,合成尿素和液态水的热化学方程式:②
 时,在
时,在 的密闭容器中充入
的密闭容器中充入 和
和 模拟工业生产,
模拟工业生产, ,如图是
,如图是 平衡转化率
平衡转化率 与x的关系,计算图中A点
与x的关系,计算图中A点 的平衡转化率
的平衡转化率
 转变为
转变为 ,其工作原理如图,M极接电源的
,其工作原理如图,M极接电源的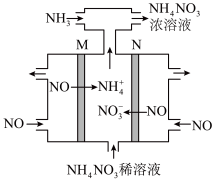
 ,简写为phen,遇
,简写为phen,遇 溶液生成橙红色配合物
溶液生成橙红色配合物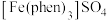 ,其中
,其中 的配位数为6。
的配位数为6。①
 中,phen的
中,phen的②
 中,
中,
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐1】 是生物医药、太阳能电池等领域的理想荧光材料。回答下列问题:
是生物医药、太阳能电池等领域的理想荧光材料。回答下列问题:
(1)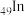 的价层电子排布式为
的价层电子排布式为_______ 。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋量子数,对于基态S原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋量子数,对于基态S原子,其价电子自旋磁量子数的代数和为_______ 。S可以形成两种常见含氧酸,其通式为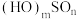 ,解释
,解释 酸性更强的原因
酸性更强的原因_______ 。
(3)矾土含 ,《诗经》言“缟衣茹藘(茜草)”,茜草中的茜素与矾土中的
,《诗经》言“缟衣茹藘(茜草)”,茜草中的茜素与矾土中的 、
、 生成的红色配合物X是最早的媒染染料。
生成的红色配合物X是最早的媒染染料。_______ 。
②X中C的杂化轨道类型是_______ ,X中不存在的作用力有_______ (填标号)。
A.配位键 B.离子键 C.共价键 D.氢键 F.范德华力
③茜素水溶性较好的原因是_______ 。
(4) (相对分子质量为Mr)的晶胞结构如图a所示,阿伏加德罗常数为
(相对分子质量为Mr)的晶胞结构如图a所示,阿伏加德罗常数为 ,则
,则 晶体的密度为
晶体的密度为_______  (列计算式),图b为Cu原子沿z轴方向向x-y平面投影的位置,在图b中画出S原子在该方向的投影位置
(列计算式),图b为Cu原子沿z轴方向向x-y平面投影的位置,在图b中画出S原子在该方向的投影位置_______ (用“ ”表示S原子)。
”表示S原子)。
 是生物医药、太阳能电池等领域的理想荧光材料。回答下列问题:
是生物医药、太阳能电池等领域的理想荧光材料。回答下列问题:(1)
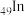 的价层电子排布式为
的价层电子排布式为(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用
 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋量子数,对于基态S原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋量子数,对于基态S原子,其价电子自旋磁量子数的代数和为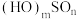 ,解释
,解释 酸性更强的原因
酸性更强的原因(3)矾土含
 ,《诗经》言“缟衣茹藘(茜草)”,茜草中的茜素与矾土中的
,《诗经》言“缟衣茹藘(茜草)”,茜草中的茜素与矾土中的 、
、 生成的红色配合物X是最早的媒染染料。
生成的红色配合物X是最早的媒染染料。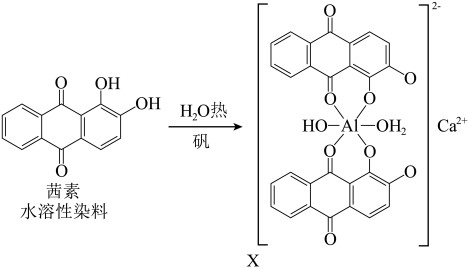
②X中C的杂化轨道类型是
A.配位键 B.离子键 C.共价键 D.氢键 F.范德华力
③茜素水溶性较好的原因是
(4)
 (相对分子质量为Mr)的晶胞结构如图a所示,阿伏加德罗常数为
(相对分子质量为Mr)的晶胞结构如图a所示,阿伏加德罗常数为 ,则
,则 晶体的密度为
晶体的密度为 (列计算式),图b为Cu原子沿z轴方向向x-y平面投影的位置,在图b中画出S原子在该方向的投影位置
(列计算式),图b为Cu原子沿z轴方向向x-y平面投影的位置,在图b中画出S原子在该方向的投影位置 ”表示S原子)。
”表示S原子)。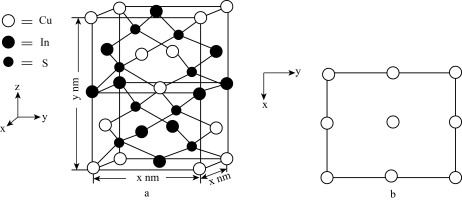
您最近一年使用:0次
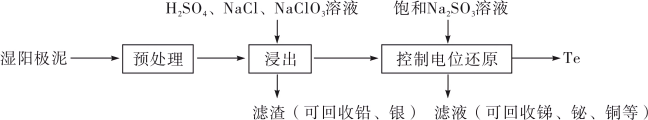
【推荐2】碲(Te)是一种重要的稀有分散元素,广泛应用于冶金、石油、化工、航空、电子等领域。以某冶炼厂的湿阳极泥(含水26%,主要含锑、砷、铅、铋、银和少量铜、碲等)为原料回收碲的流程如下:
请回答下列问题:
(1)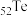 的基态原子的电子排布式为
的基态原子的电子排布式为___________ 。
(2)原料预处理可采用干燥箱中加热氧化或自然堆放氧化(四天以上)两种方式,两相比较,后者的主要优点是___________ ;氧化后的原料还需粉碎、过筛,目的是___________ 。
(3)浸出时,所得滤渣主要含铅、银的化合物,其化学式分别为___________ 、___________ ;添加 可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出
可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出 转化为
转化为 、
、 而被浸出的离子方程式
而被浸出的离子方程式___________ 。
(4)电解时为防止除Te以外的单质生成,需控制电位的范围为___________ ;加入饱和 溶液还原
溶液还原 可减少电能消耗并防止阳极生成
可减少电能消耗并防止阳极生成___________ (填化学式)。
(5)碲可用于制备半导体材料碲化锌,其立方晶胞结构如图所示。以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。A点碲原子坐标为 ,C点锌原子坐标为
,C点锌原子坐标为 ,则B点锌原子坐标为
,则B点锌原子坐标为___________ 。若Te的原子半径为rpm,碲化锌晶胞中面心与顶点的碲原子相切,晶体的密度为 ,则阿伏加德罗常数
,则阿伏加德罗常数
___________  (列出计算式)。
(列出计算式)。
| 物质 | 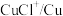 | 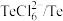 | 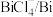 | 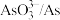 | 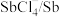 |
| 氧化还原电位(E)/V | 0.342 | 0.568 | 0.16 | 小于0.16 | 小于0.16 |
(1)
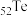 的基态原子的电子排布式为
的基态原子的电子排布式为(2)原料预处理可采用干燥箱中加热氧化或自然堆放氧化(四天以上)两种方式,两相比较,后者的主要优点是
(3)浸出时,所得滤渣主要含铅、银的化合物,其化学式分别为
 可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出
可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出 转化为
转化为 、
、 而被浸出的离子方程式
而被浸出的离子方程式(4)电解时为防止除Te以外的单质生成,需控制电位的范围为
 溶液还原
溶液还原 可减少电能消耗并防止阳极生成
可减少电能消耗并防止阳极生成(5)碲可用于制备半导体材料碲化锌,其立方晶胞结构如图所示。以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位置,称为原子坐标。A点碲原子坐标为
 ,C点锌原子坐标为
,C点锌原子坐标为 ,则B点锌原子坐标为
,则B点锌原子坐标为 ,则阿伏加德罗常数
,则阿伏加德罗常数
 (列出计算式)。
(列出计算式)。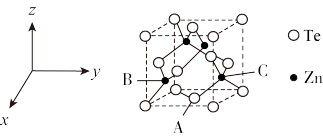
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】碳、氮、氧是构建化合物的常见元素。
(1)尿素[CO(NH2)2]的晶体结构如图所示,在其晶胞中心位置有一个尿素分子,其晶胞棱长 ,
,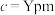 ,晶胞相邻棱夹角均为90°,尿素中碳原子的杂化方式为
,晶胞相邻棱夹角均为90°,尿素中碳原子的杂化方式为___________ ,每个尿素分子含有___________ 个 键,尿素晶体的密度为
键,尿素晶体的密度为___________ g/cm3。
(3)①NH3的键角小于 的,原因是
的,原因是___________ 。
②N4分子结构与白磷相似,请写出N4分子与足量的H+反应生成产物的结构式___________ 。
(1)尿素[CO(NH2)2]的晶体结构如图所示,在其晶胞中心位置有一个尿素分子,其晶胞棱长
 ,
,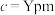 ,晶胞相邻棱夹角均为90°,尿素中碳原子的杂化方式为
,晶胞相邻棱夹角均为90°,尿素中碳原子的杂化方式为 键,尿素晶体的密度为
键,尿素晶体的密度为
| A.尿素所含元素中N的电负性最大 |
| B.CO(NH2)2、NH3、H2O均能形成分子间氢键 |
| C.H原子的电子由激发态跃迁到基态时,测得的是吸收光谱 |
| D.N、O基态原子中能量最高的电子所占据的原子轨道,均有3个空间伸展方向 |
(3)①NH3的键角小于
 的,原因是
的,原因是②N4分子结构与白磷相似,请写出N4分子与足量的H+反应生成产物的结构式
您最近一年使用:0次



