名校
解题方法
1 . A、B、C、D、E、F、G、H是元素周期表前四周期常见元素,且原子序数依次增大,相关信息如下表:
请用化学用语填空:
(1)A元素在元素周期表中的位置___________ ;C元素和F元素的电负性比较,较小的是___________ (填元素符号)。
(2)B元素与宇宙中含量最丰富的元素形成的最简单化合物的电子式为___________ ,B元素所形成的单质分子中σ键与π键数目之比为___________ 。
(3)F元素原子的价电子的轨道表示式是___________ ;G的高价阳离子的溶液与H单质反应的离子方程式为___________ ;元素X与元素E在周期表中呈对角线关系,且元素X的最高价氧化物的水化物也具有两性,试写出X元素的最高价氧化物的水化物与D元素的最高价氧化物的水化物反应的化学方程式___________ 。
| 元素 | 元素相关信息 |
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 基态原子最外层电子排布式为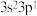 |
| F | 基态原子的最外层p轨道有两个电子的自旋方向与其他电子的自旋方向相反 |
| G | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
| H | 是我国使用最早的合金中的最主要元素 |
(1)A元素在元素周期表中的位置
(2)B元素与宇宙中含量最丰富的元素形成的最简单化合物的电子式为
(3)F元素原子的价电子的轨道表示式是
您最近一年使用:0次
解题方法
2 . 四种短周期主族元素在元素周期表中的相对位置如图所示,且X、Y、Z和Q四种元素的p轨道电子总数为24。化学家鲍林以Y的电负性作为参照标准,得出了各元素的电负性。下列叙述错误的是
| X | Y | |||
| Z | Q |
| A.最简单氢化物的稳定性:Y>Q>Z |
B. 分子中每个原子最外层都达到8电子稳定结构 分子中每个原子最外层都达到8电子稳定结构 |
| C.最高价氧化物对应水化物的酸性: Z<Q |
D.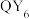 分子呈正八面体形 分子呈正八面体形 |
您最近一年使用:0次
2023-10-28更新
|
337次组卷
|
2卷引用:福建省宁德市部分达标学校2023-2024学年高三上学期期中考试化学试题
名校
解题方法
3 . 阴离子 和二脲基分子能通过一种弱相互作用形成超分子阴离子配合物,如下图所示(图中省略阴离子配合物中部分原子)。下列关于该阴离子配合物的说法正确的是
和二脲基分子能通过一种弱相互作用形成超分子阴离子配合物,如下图所示(图中省略阴离子配合物中部分原子)。下列关于该阴离子配合物的说法正确的是
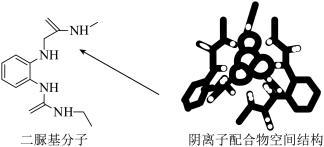
 和二脲基分子能通过一种弱相互作用形成超分子阴离子配合物,如下图所示(图中省略阴离子配合物中部分原子)。下列关于该阴离子配合物的说法正确的是
和二脲基分子能通过一种弱相互作用形成超分子阴离子配合物,如下图所示(图中省略阴离子配合物中部分原子)。下列关于该阴离子配合物的说法正确的是
A.所含元素电负性最大的是 |
| B.二脲基分子中所有碳原子不可能共平面 |
C. 离子与 离子与 离子的空间结构不同 离子的空间结构不同 |
D.二脲基分子中 的 的 和 和 离子的 离子的 形成氢键 形成氢键 |
您最近一年使用:0次
名校
解题方法
4 . 中国科学家首次在月球上发现新矿物,将其命名为“嫦娥石”,“嫦娥石”中包含了Fe、Cu、Ti、Cr、Ni、Mo、N、O等多种元素。
(1)鉴定月球土壤的元素组成,可采用的方法是___________ 。
A.光谱分析 B.X-射线衍射分析
(2)在第二周期中,第一电离能比N高的主族元素是___________ 。氮原子的电子排布图表示的状态中,能量由低到高的顺序是___________ (填序号)。
A.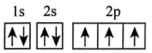 B.
B.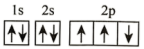
C.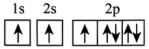 D.
D.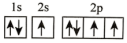
(3)已知有关氮、磷的单键和三键的键能( )如下表:
)如下表:
从能量角度看,氮以 、而白磷以
、而白磷以 (结构式可表示为
(结构式可表示为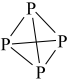 )形式存在的原因是
)形式存在的原因是___________ 。
(4)已知 分子的键角约为107°,而同主族磷的氢化物
分子的键角约为107°,而同主族磷的氢化物 分子的键角约为94°,试用价层电子对互斥模型解释
分子的键角约为94°,试用价层电子对互斥模型解释 的键角比
的键角比 的键角大的原因:
的键角大的原因:___________
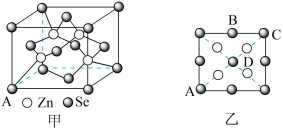
(5)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,已知晶胞边长为apm,乙图为甲图的俯视图,若原子坐标A为(0,0,0),B为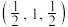 ,则D原子坐标为
,则D原子坐标为___________ ;若该晶胞密度为 ,则阿伏加德罗常数
,则阿伏加德罗常数 为
为_________________ 。
(1)鉴定月球土壤的元素组成,可采用的方法是
A.光谱分析 B.X-射线衍射分析
(2)在第二周期中,第一电离能比N高的主族元素是
A.
 B.
B.
C.
 D.
D.
(3)已知有关氮、磷的单键和三键的键能(
 )如下表:
)如下表:| N-N |  | P-P |  |
| 193 | 946 | 197 | 489 |
从能量角度看,氮以
 、而白磷以
、而白磷以 (结构式可表示为
(结构式可表示为 )形式存在的原因是
)形式存在的原因是(4)已知
 分子的键角约为107°,而同主族磷的氢化物
分子的键角约为107°,而同主族磷的氢化物 分子的键角约为94°,试用价层电子对互斥模型解释
分子的键角约为94°,试用价层电子对互斥模型解释 的键角比
的键角比 的键角大的原因:
的键角大的原因:(5)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,已知晶胞边长为apm,乙图为甲图的俯视图,若原子坐标A为(0,0,0),B为
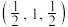 ,则D原子坐标为
,则D原子坐标为 ,则阿伏加德罗常数
,则阿伏加德罗常数 为
为
您最近一年使用:0次
名校
解题方法
5 . 硒化锌是一种重要的半导体材料;其晶胞结构如图甲所示,已知晶胞参数为pnm,乙图为晶胞的俯视图,下列说法正确的是
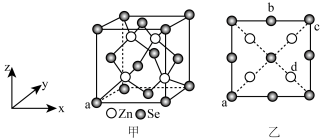
| A.晶胞中硒原子的配位数为12 |
B.晶胞中d点原子分数坐标为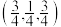 |
C.相邻两个Zn原子的最短距离为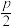 nm nm |
| D.电负性:Zn>Se |
您最近一年使用:0次
2023-03-03更新
|
1854次组卷
|
10卷引用:福建省龙岩市连城县第一中学2022-2023学年高二下学期5月月考化学试题
福建省龙岩市连城县第一中学2022-2023学年高二下学期5月月考化学试题山东省济宁市2023届高三一模考试(3月)化学试题山东省德州市第一中学2022-2023学年高二下学期3月月考化学试题(已下线)湖北省七市(州)2023届高三3月联合统一调研测试化学试题变式题(选择题11-15)河南省郑州市六校联盟2022-2023学年高二下学期4月期中考试化学试题(已下线)专题十 晶胞示意图(练)河北省张家口市宣化第一中学2023届高三模拟试题(三)化学试题河南省驻马店市环际大联考2022-2023学年高二下学期4月期中考试化学试题(已下线)热点08 金属晶体和离子晶体山东省烟台市第一中学2023-2024学年高三下学期3月月考化学试题
解题方法
6 . 前四周期的A、B、C、D、E、F六种元素,原子序数依次增大。基态A原子核外电子的L层电子数是K层的2倍;B原子基态时的2p轨道上未成对的电子数最多;C元素为最活泼的非金属元素;D元素核外有3个电子层,最外层电子数是核外电子总数的 ;E元素正三价离子的3d轨道为半充满状态;F元素与B元素位于同一主族,其某种氧化物有剧毒。
;E元素正三价离子的3d轨道为半充满状态;F元素与B元素位于同一主族,其某种氧化物有剧毒。
(1)E元素在周期表中位置为_______ ,E3+价电子轨道表示式为_______ 。
(2)B、C、F三种元素电负性由大到小的顺序为_______ (用元素符号表示),第一电离能D_______ (填“>”、“<”或“=”)Al,其原因是_______ 。
(3)相同条件下,A、B的简单氢化物在水中溶解度较大的是_______ (填化学式),理由是_______ 。
(4)F元素可能的性质_______ (填标号)。
 ;E元素正三价离子的3d轨道为半充满状态;F元素与B元素位于同一主族,其某种氧化物有剧毒。
;E元素正三价离子的3d轨道为半充满状态;F元素与B元素位于同一主族,其某种氧化物有剧毒。(1)E元素在周期表中位置为
(2)B、C、F三种元素电负性由大到小的顺序为
(3)相同条件下,A、B的简单氢化物在水中溶解度较大的是
(4)F元素可能的性质
| A.其单质可作半导体材料 |
| B.存在-3、+3、+5等多种化合价 |
| C.最高价氧化物对应的水化物是强酸 |
| D.单质还原性弱于磷单质 |
您最近一年使用:0次
2022-04-16更新
|
298次组卷
|
3卷引用:福建省龙岩市一级校联盟(九校)2021-2022学年高二下学期期中联考化学试题
名校
解题方法
7 . 按要求回答下列问题
(1)中国古代四大发明之一-黑火药,它的爆炸反应为:2KNO3 + 3C+S A + N2↑+ 3CO2↑(已配平)
A + N2↑+ 3CO2↑(已配平)
①除S外,上列元素的电负性从大到小依次为_______ 。
②在生成物中,A的电子式_______ ,含极性共价键的分子的中心原子轨道杂化类型为_______ 。
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为_______ 。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为_______ ,Q2+的未成对电子数是_______ 。
(3)ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
①O、S、Se原子的第一电离能由大到小的顺序为_______ 。
②H2Se的酸性比H2S_______ (填“强”或“弱”)。气态SeO3分子的价层电子对互斥模型为_______ ,SeO 离子中Se的杂化方式为
离子中Se的杂化方式为_______ 。
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是_______ 。
(5)已知Ti3+可形成配位数为6的配合物。现有紫色和绿色两种含钛晶体的配合物,其组成均为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种晶体的样品配成溶液;
b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤,经洗涤干燥后称量,发现绿色晶体产生沉淀的质量为紫色晶体产生沉淀质量的三分之二。则绿色晶体的配合物为_______ 。
(1)中国古代四大发明之一-黑火药,它的爆炸反应为:2KNO3 + 3C+S
 A + N2↑+ 3CO2↑(已配平)
A + N2↑+ 3CO2↑(已配平)①除S外,上列元素的电负性从大到小依次为
②在生成物中,A的电子式
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为
(3)ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
①O、S、Se原子的第一电离能由大到小的顺序为
②H2Se的酸性比H2S
 离子中Se的杂化方式为
离子中Se的杂化方式为(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是
(5)已知Ti3+可形成配位数为6的配合物。现有紫色和绿色两种含钛晶体的配合物,其组成均为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种晶体的样品配成溶液;
b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤,经洗涤干燥后称量,发现绿色晶体产生沉淀的质量为紫色晶体产生沉淀质量的三分之二。则绿色晶体的配合物为
您最近一年使用:0次
名校
8 . (1)Cd与Zn同族且相邻,若Cd基态原子将次外层1个d电子激发进入最外层的np能级,则该激发态原子的外围电子排布式为_______ 。
(2)一水合甘氨酸锌[(H2NCH2COO)2Zn·H2O]是一种饲料添加剂,该化合物中所涉及的 第二周期元素的第一电离能由大到小的顺序是_______ (用元素符号表示);
(3)噻吩(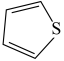 )和吡咯(
)和吡咯(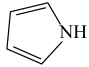 )形成配位化合物。噻吩难溶于水,吡咯能溶于水,原因为:
)形成配位化合物。噻吩难溶于水,吡咯能溶于水,原因为:_______ 。
(4)含砷有机物“对氨基苯胂酸”的结构简式如图,As原子轨道杂化类型为_______ ,1mol对氨基苯胂酸含σ键数目为_______
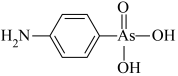
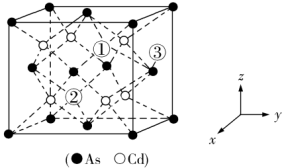
(5)砷化镉可以看作是石墨烯的3D版,其晶胞结构如图,As为面心立方堆积,Cd占据As围成的四面体空隙,空隙占有率75%,故Cd为“具有两个真空的立方晶格”,如图“①”和“②”位是“真空”。建立如图的原子坐标系,①号位的坐标为( ,
, ,
, ),则③号位原子坐标参数为
),则③号位原子坐标参数为_______ 。晶胞参数为apm,阿伏加德罗常数的值为NA,砷化镉的摩尔质量为Mg·mol-1,则该晶胞的密度为_______ g·cm-3(列计算式即可)
(2)一水合甘氨酸锌[(H2NCH2COO)2Zn·H2O]是一种饲料添加剂,该化合物中所涉及的 第二周期元素的第一电离能由大到小的顺序是
(3)噻吩(
 )和吡咯(
)和吡咯( )形成配位化合物。噻吩难溶于水,吡咯能溶于水,原因为:
)形成配位化合物。噻吩难溶于水,吡咯能溶于水,原因为:(4)含砷有机物“对氨基苯胂酸”的结构简式如图,As原子轨道杂化类型为

(5)砷化镉可以看作是石墨烯的3D版,其晶胞结构如图,As为面心立方堆积,Cd占据As围成的四面体空隙,空隙占有率75%,故Cd为“具有两个真空的立方晶格”,如图“①”和“②”位是“真空”。建立如图的原子坐标系,①号位的坐标为(
 ,
, ,
, ),则③号位原子坐标参数为
),则③号位原子坐标参数为
您最近一年使用:0次
2021-06-01更新
|
544次组卷
|
2卷引用:福建省厦门外国语学校2021届高三5月高考适应性考试化学试题
名校
解题方法
9 . 砷化镓是继硅之后研究最深入、应用最广泛的半导体材料。回答下列问题:
(1)Ga基态原子核外电子排布式为________________ ,As基态原子核外有__________ 个未成对电子。
(2)Ga、As、Se的第一电离能由大到小的顺序是__________ ,Ga、As、Se的电负性由大到小的顺序是__________________ 。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:________ ,GaF的熔点超过1000℃,可能的原因是__________________________ 。
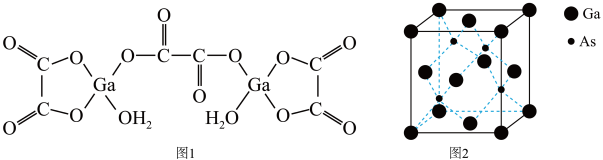
(4)二水合草酸镓的结构如图1所示,其中镓原子的配位数为__________ ,草酸根离子中碳原子的杂化轨道类型为__________ 。
(5)砷化镓的立方晶胞结构如图2所示,晶胞参数为a=0.565nm,砷化镓晶体的密度为__________ g·cm-3(设NA为阿伏加 德罗常数的值,列出计算式即可)。
(1)Ga基态原子核外电子排布式为
(2)Ga、As、Se的第一电离能由大到小的顺序是
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:
| 镓的卤化物 | CaCl3 | CaBr3 | CaI3 |
| 熔点/℃ | 77.75 | 122.3 | 211.5 |
| 沸点/℃ | 201.2 | 279 | 346 |
(5)砷化镓的立方晶胞结构如图2所示,晶胞参数为a=0.565nm,砷化镓晶体的密度为

您最近一年使用:0次
2020-02-11更新
|
239次组卷
|
6卷引用:福建省莆田市第九中学2019届高三上学期第一次调研考试理科综合化学试题
名校
解题方法
10 . Fe、Co、Ni均为第Ⅷ族元素,它们的化合物在生产、生活中有着广泛的应用。
(1)基态Co原子的价电子排布式为_______ ,Co2+核外3d能级上有_____ 对成对电子。
(2)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+的配位数是________ 。1 mol配离子中所含σ键的数目为________ ,配位体N3-中心原子的杂化类型为________ 。
(3)Co2+在水溶液中以[Co(H2O)6]2+存在。向含Co2+的溶液中加入过量氨水可生成更稳定的[Co(NH3)6]2+,其原因是_________________________________________________ 。
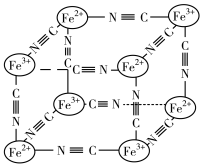
(4)某蓝色晶体晶体结构如图,Fe2+、Fe3+分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个CN-,K+位于立方体的体心上。据此可知该晶体的化学式为________ ,立方体中Fe2+间连接起来形成的空间构型是________ 。K+空缺率(体心中没有K+的占总体心的百分比)为_____________ 。
(5)NiO的晶胞结构如图甲所示,其中原子坐标参数A为(0,0,0),B为(1,1,0),则C原子坐标参数为________ 。
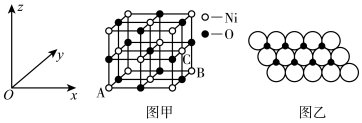
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图乙),已知O2-的半径为a pm,每平方米面积上分散的该晶体的质量为________ g(用含a、NA的代数式表示)。
(1)基态Co原子的价电子排布式为
(2)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+的配位数是
(3)Co2+在水溶液中以[Co(H2O)6]2+存在。向含Co2+的溶液中加入过量氨水可生成更稳定的[Co(NH3)6]2+,其原因是
(4)某蓝色晶体晶体结构如图,Fe2+、Fe3+分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个CN-,K+位于立方体的体心上。据此可知该晶体的化学式为

(5)NiO的晶胞结构如图甲所示,其中原子坐标参数A为(0,0,0),B为(1,1,0),则C原子坐标参数为

(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图乙),已知O2-的半径为a pm,每平方米面积上分散的该晶体的质量为
您最近一年使用:0次



