(1)Cd与Zn同族且相邻,若Cd基态原子将次外层1个d电子激发进入最外层的np能级,则该激发态原子的外围电子排布式为_______ 。
(2)一水合甘氨酸锌[(H2NCH2COO)2Zn·H2O]是一种饲料添加剂,该化合物中所涉及的 第二周期元素的第一电离能由大到小的顺序是_______ (用元素符号表示);
(3)噻吩(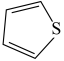 )和吡咯(
)和吡咯(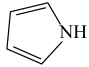 )形成配位化合物。噻吩难溶于水,吡咯能溶于水,原因为:
)形成配位化合物。噻吩难溶于水,吡咯能溶于水,原因为:_______ 。
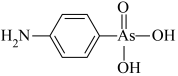
(4)含砷有机物“对氨基苯胂酸”的结构简式如图,As原子轨道杂化类型为_______ ,1mol对氨基苯胂酸含σ键数目为_______
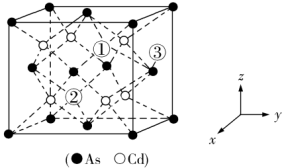
(5)砷化镉可以看作是石墨烯的3D版,其晶胞结构如图,As为面心立方堆积,Cd占据As围成的四面体空隙,空隙占有率75%,故Cd为“具有两个真空的立方晶格”,如图“①”和“②”位是“真空”。建立如图的原子坐标系,①号位的坐标为( ,
, ,
, ),则③号位原子坐标参数为
),则③号位原子坐标参数为_______ 。晶胞参数为apm,阿伏加德罗常数的值为NA,砷化镉的摩尔质量为Mg·mol-1,则该晶胞的密度为_______ g·cm-3(列计算式即可)
(2)一水合甘氨酸锌[(H2NCH2COO)2Zn·H2O]是一种饲料添加剂,该化合物中所涉及的 第二周期元素的第一电离能由大到小的顺序是
(3)噻吩(
 )和吡咯(
)和吡咯( )形成配位化合物。噻吩难溶于水,吡咯能溶于水,原因为:
)形成配位化合物。噻吩难溶于水,吡咯能溶于水,原因为:(4)含砷有机物“对氨基苯胂酸”的结构简式如图,As原子轨道杂化类型为

(5)砷化镉可以看作是石墨烯的3D版,其晶胞结构如图,As为面心立方堆积,Cd占据As围成的四面体空隙,空隙占有率75%,故Cd为“具有两个真空的立方晶格”,如图“①”和“②”位是“真空”。建立如图的原子坐标系,①号位的坐标为(
 ,
, ,
, ),则③号位原子坐标参数为
),则③号位原子坐标参数为
更新时间:2021-06-01 12:05:37
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】铁、铁合金及其化合物用途非常广泛。回答下列问题:
(1)基态铁原子价电子排布式为______ ,元素Mn与Fe的第三电离能分别为:
IMn=3248 KJ/mol、IFe=2957Kj/mol,IMn>IFe的原因是__________ 。
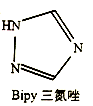
(2)铁能形成[Fe(Bipy)2C12]ClO4等多种配合物(Bipy结构如右图)。
①该配合物中中心原子的化合价为________ ;与中心原子形成配位键的原子是________ 。
②ClO4-的空间构型为_______ ,与其互为等电子体的一种非极性分子是_______ (举1例)。
③1 mol Bipy中所含σ键______ mol;碳原子杂化方式是_______ ;Bipy 的沸点为260℃,结构类似且相对分子质量接近的环戊二烯(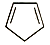 )的沸点为42.5℃,前者较大的原因是
)的沸点为42.5℃,前者较大的原因是_____ 。
(3)Fe3O4的晶胞结构图示如下(8个小立方体内各含有一个I 或Ⅱ):
①可表示二价Fe的是图中_____ 原子(填“A” 或“B”)。
②已知Fe3O4的熔点为1594.5℃,FeCl3的熔点306℃,两者熔点相差较大的原因是______ 。
③四氧化三铁晶体晶胞边长为a pm,则其密度为_____ g·cm-3。(列出表达式即可)。
(1)基态铁原子价电子排布式为
IMn=3248 KJ/mol、IFe=2957Kj/mol,IMn>IFe的原因是
(2)铁能形成[Fe(Bipy)2C12]ClO4等多种配合物(Bipy结构如右图)。
①该配合物中中心原子的化合价为
②ClO4-的空间构型为
③1 mol Bipy中所含σ键
 )的沸点为42.5℃,前者较大的原因是
)的沸点为42.5℃,前者较大的原因是(3)Fe3O4的晶胞结构图示如下(8个小立方体内各含有一个I 或Ⅱ):
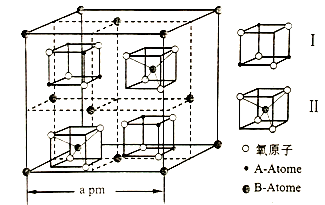
①可表示二价Fe的是图中
②已知Fe3O4的熔点为1594.5℃,FeCl3的熔点306℃,两者熔点相差较大的原因是
③四氧化三铁晶体晶胞边长为a pm,则其密度为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐2】人体必需的元素包括常量元素与微量元素,常量元素包括碳、氢、氧、氮、钙、镁等,微量元素包括铁、铜、锌、氟、碘等,这些元素形成的化合物种类繁多,应用广泛。
(1)锌、铜、铁、钙四种元素与少儿生长发育息息相关,请写出Fe2+的核外电子排布式___________ 。
(2)1个Cu2+与2个H2N—CH2—COO−形成含两个五元环结构的内配盐(化合物),其结构简式为___________ (用→标出配位键),在H2N—CH2—COO−中,属于第二周期的元素的第一电离能由大到小的顺序是___________ (用元素符号表示),N、C原子存在的相同杂化方式是___________ 杂化。
(3)碳酸盐中的阳离子不同,热分解温度就不同,查阅文献资料可知,离子半径r(Mg2+)=66 pm,r(Ca2+)=99 pm,r(Sr2+)=112 pm,r(Ba2+)=135 pm;碳酸盐分解温度T(MgCO3)=402℃,T(CaCO3)=825℃,T(SrCO3)=1172℃,T(BaCO3)=1360℃。分析数据得出的规律是___________ ,解释出现此规律的原因是___________ 。
(4)自然界的氟化钙矿物为萤石或氟石,CaF2的晶体结构呈立方体形,其结构如下:

①两个最近的F−之间的距离是___________ pm(用含m的代数式表示)。
②CaF2晶胞体积与8个F−形成的立方体的体积比为___________ 。
③CaF2晶胞的密度是___________ g·cm−3(化简至带根号的最简式,NA表示阿伏加 德罗常数的值)。
(1)锌、铜、铁、钙四种元素与少儿生长发育息息相关,请写出Fe2+的核外电子排布式
(2)1个Cu2+与2个H2N—CH2—COO−形成含两个五元环结构的内配盐(化合物),其结构简式为
(3)碳酸盐中的阳离子不同,热分解温度就不同,查阅文献资料可知,离子半径r(Mg2+)=66 pm,r(Ca2+)=99 pm,r(Sr2+)=112 pm,r(Ba2+)=135 pm;碳酸盐分解温度T(MgCO3)=402℃,T(CaCO3)=825℃,T(SrCO3)=1172℃,T(BaCO3)=1360℃。分析数据得出的规律是
(4)自然界的氟化钙矿物为萤石或氟石,CaF2的晶体结构呈立方体形,其结构如下:

①两个最近的F−之间的距离是
②CaF2晶胞体积与8个F−形成的立方体的体积比为
③CaF2晶胞的密度是
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】研究表明TiO2-aNb、Cu(In1-xGaxSe2)是光学活性物质,具有非常好的发展前景。
(1)已知铟的原子序数为49,基态铟原子的电子排布式为[Kr]_______ ;Ga、In、Se,第一电离能从大到小顺序为_______ 。
(2)H2SeO3与H2SO3中酸性更强的是_______ ;原因是_______ 。
(3)31Ga可以形成GaCl3·xNH3(x=3、4、5、6)等一系列配位数为6的配合物,向上述某物质的溶液中加入足量AgNO3溶液,有沉淀生成;过滤后,充分加热滤液有氨逸出,且又有沉淀生成,两次沉淀的物质的量之比为1∶2.则该溶液中溶质的化学式为_______ 。
(4)Cu2+与NH3形成的配离子为[Cu(NH3)4]2+,在该配离子中,氮氢键的键角比独立存在的气态氨分子中键角略大,其原因是_______ 。
向[Cu(NH3)4]SO4溶液中加入乙醇能够析出深蓝色的晶体,试分析加入乙醇的作用:_______ 。
(5)常见的铜的硫化物有CuS和Cu2S两种。已知:晶胞中S2-的位置如图1所示,铜离子位于硫离子所构成的四面体中心,它们晶胞具有相同的侧视图,如图2所示。已知CuS和Cu2S的晶胞参数分别为apm和bpm,阿伏加德罗常数的值为NA。
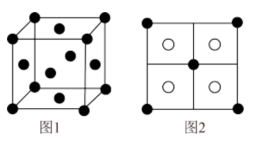
①CuS晶体中,相邻的两个铜离子间的距离为_______ pm。
②Cu2S晶体的密度为ρ=_______ g·cm-3(列出计算式即可)。
(6)近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为FeSmAsFO组成的化合物。一种四方结构的超导化合物的晶胞如图1所示,晶胞中Sm和As原子的投影位置如图2所示。回答下列问题:
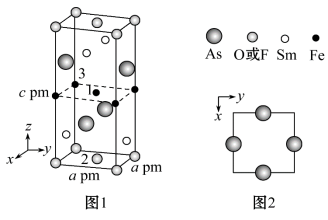
①图中F-和O2-共同占据晶胞的上下底面位置,若两者的比例依次用x和1-x代表,则该化合物的化学式表示为_______ ;
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为( ,
, ,
, ),则原子2和3的坐标分别为
),则原子2和3的坐标分别为_______ 、_______ 。
(1)已知铟的原子序数为49,基态铟原子的电子排布式为[Kr]
(2)H2SeO3与H2SO3中酸性更强的是
(3)31Ga可以形成GaCl3·xNH3(x=3、4、5、6)等一系列配位数为6的配合物,向上述某物质的溶液中加入足量AgNO3溶液,有沉淀生成;过滤后,充分加热滤液有氨逸出,且又有沉淀生成,两次沉淀的物质的量之比为1∶2.则该溶液中溶质的化学式为
(4)Cu2+与NH3形成的配离子为[Cu(NH3)4]2+,在该配离子中,氮氢键的键角比独立存在的气态氨分子中键角略大,其原因是
向[Cu(NH3)4]SO4溶液中加入乙醇能够析出深蓝色的晶体,试分析加入乙醇的作用:
(5)常见的铜的硫化物有CuS和Cu2S两种。已知:晶胞中S2-的位置如图1所示,铜离子位于硫离子所构成的四面体中心,它们晶胞具有相同的侧视图,如图2所示。已知CuS和Cu2S的晶胞参数分别为apm和bpm,阿伏加德罗常数的值为NA。

①CuS晶体中,相邻的两个铜离子间的距离为
②Cu2S晶体的密度为ρ=
(6)近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为FeSmAsFO组成的化合物。一种四方结构的超导化合物的晶胞如图1所示,晶胞中Sm和As原子的投影位置如图2所示。回答下列问题:

①图中F-和O2-共同占据晶胞的上下底面位置,若两者的比例依次用x和1-x代表,则该化合物的化学式表示为
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(
 ,
, ,
, ),则原子2和3的坐标分别为
),则原子2和3的坐标分别为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐1】钛硅分子筛是一种新型固体催化剂,可催化合成重要有机合成活性试剂甲乙酮肟(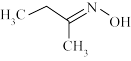 )。回答下列问题:
)。回答下列问题:
(1)基态硅原子的核外电子空间运动状态有____ 种。
(2)甲乙酮肟中同周期三种元素电负性由大到小的顺序为____ ,氮原子的杂化方式为____ ,C=N与C—C键夹角____ (填“<”“>”或“=”)C=N与N—O键夹角。
(3)TiO2和TiCl4均是制备钛硅分子筛的重要中间体。
①TiO2与光气COCl2反应可用于制取四氯化钛。COCl2中σ键和π键的数目比为____ ,其空间构型为____ 。
②TiCl4与金属Ti在高温条件下可反应生成TiCl3,TiCl3中Ti3+极易被氧化,还原性很强。试解释Ti3+还原性强的原因____ 。
(4)研究表明,在TiO2通过氮掺杂反应生成TiO2-mNn,能使TiO2对可见光具有活性,反应如图所示。

若TiO2晶体密度为ρg·cm-3,则阿伏加德罗常数的值NA=____ ,TiO2-mNn晶体中m=____ 。
 )。回答下列问题:
)。回答下列问题:(1)基态硅原子的核外电子空间运动状态有
(2)甲乙酮肟中同周期三种元素电负性由大到小的顺序为
(3)TiO2和TiCl4均是制备钛硅分子筛的重要中间体。
①TiO2与光气COCl2反应可用于制取四氯化钛。COCl2中σ键和π键的数目比为
②TiCl4与金属Ti在高温条件下可反应生成TiCl3,TiCl3中Ti3+极易被氧化,还原性很强。试解释Ti3+还原性强的原因
(4)研究表明,在TiO2通过氮掺杂反应生成TiO2-mNn,能使TiO2对可见光具有活性,反应如图所示。

若TiO2晶体密度为ρg·cm-3,则阿伏加德罗常数的值NA=
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】金属镍及其化合物在合成材料以及催化剂等方面应用广泛。请回答下列问题:
(1)基态Ni原子的原子结构示意图为_____ 。
(2)NiO、FeO晶体类型与晶胞与NaCl相同,则NiO晶胞结构中Ni2+的配位数为_____ ;又知Ni2+、Fe2+的离子半径分别为69pm、78pm,则NiO熔点_____ FeO(填“>”、“<”、“=”)。
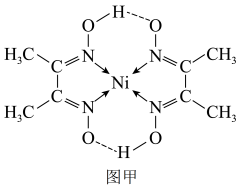
(3)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图甲所示,则该沉淀中Ni2+的配位数为_____ ;元素H、C、N、O、 电负性由大到小的顺序为
电负性由大到小的顺序为____ 。
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图及晶胞参数如图乙所示。该晶体的化学式为_____ ;晶体密度为_____ g•cm-3(列出含a、b、NA计算表达式,NA表示阿伏加德罗常数的值)。

(1)基态Ni原子的原子结构示意图为
(2)NiO、FeO晶体类型与晶胞与NaCl相同,则NiO晶胞结构中Ni2+的配位数为
(3)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如图甲所示,则该沉淀中Ni2+的配位数为
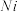 电负性由大到小的顺序为
电负性由大到小的顺序为
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图及晶胞参数如图乙所示。该晶体的化学式为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】氮气、羟基乙胺(HOCH2CH2NH2)和氮化镓都含氮元素,其用途非常广泛。回答下列问题:
(1)基态氮原子价层电子排布图为___ ,其中电子能量最高的能级是___ 。
(2)HOCH2CH2NH2所含非金属元素电负性由大到小顺序为___ ,其中C和N的杂化方式均为___ HOCH2CH2NH2中∠HOC小于∠HNC,其原因是___ 。
(3)HOCH2CH2NH2是一种常见的二齿配体,能和Co2+形成环状配离子。Co位于元素周期表中___ 区,该环状配离子的配位原子为___ 。
(4)氮化镓为六方晶胞,其结构如图,其中Ga作六方最密堆积。Ga填充在N围成的___ (选填:八面体空隙、正四面体空隙、立方体空隙或三角形空隙);已知该晶胞底边边长为apm,高为cpm,阿伏加 德罗常数的值为NA,则该晶体的密度为___ g•cm-3(列出计算式即可)。

(1)基态氮原子价层电子排布图为
(2)HOCH2CH2NH2所含非金属元素电负性由大到小顺序为
(3)HOCH2CH2NH2是一种常见的二齿配体,能和Co2+形成环状配离子。Co位于元素周期表中
(4)氮化镓为六方晶胞,其结构如图,其中Ga作六方最密堆积。Ga填充在N围成的

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】铁氰化钾,化学式为K3[Fe(CN)6],主要应用于制药、电镀、造纸、钢铁生产等工业。其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
(1)基态K原子核外电子排布简写式为___________ 。 K3[Fe(CN)6]中所涉及的元素的基态原子核外未成对电子数最多的是_________ ,各元素的第一电离能由大到小的顺序为_________ 。
(2)(CN)2分子中存在碳碳键,则分子中σ键与π键数目之比为_______ 。KCN与盐酸作用可生成HCN,HCN的中心原子的杂化轨道类型为_________ 。
(3)CO能与金属Fe形成Fe(CO)5,该化合物熔点为253 K,沸点为为376 K,其固体属于_____ 晶体。
(4)右图是金属单质常见的两种堆积方式的晶胞模型。
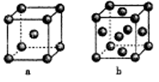
①铁采纳的是a堆积方式.铁原子的配位数为_____ ,该晶体中原子总体积占晶体体积的比值为____ (用含π的最简代数式表示)。
②常见的金属铝采纳的是b堆积方式,铝原子的半径为r pm,则其晶体密度为_____ g·cm-3(用含有r、NA的最简代数式表示)。
(1)基态K原子核外电子排布简写式为
(2)(CN)2分子中存在碳碳键,则分子中σ键与π键数目之比为
(3)CO能与金属Fe形成Fe(CO)5,该化合物熔点为253 K,沸点为为376 K,其固体属于
(4)右图是金属单质常见的两种堆积方式的晶胞模型。

①铁采纳的是a堆积方式.铁原子的配位数为
②常见的金属铝采纳的是b堆积方式,铝原子的半径为r pm,则其晶体密度为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】Ⅰ.MnS 纳米粒子被广泛应用于除去重金属离子中的隔离子。
(1)锰的价层电子排布式为_______ 。
(2)磁性氧化铁纳米粒子除隔效率不如 MnS 纳米粒子,试比较两种纳米材料中的阴离子的半径大小O2-_______ S2-(填>、<或=)。H3O+中H-O-H的键角比H2O中的_______ (填大或小)
(3)Mn 可以形成多种配合物,[Mn(CO)(H2O)2(NH3)3]Cl2·H2O中第二周期元素第一电离能由大到小关系为_______ ,配体H2O中心原子杂化类型为_______ 配体NH3的空间构型为_______ (用文字描述)。
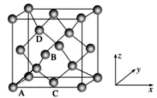
II.(1)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为_______ 。

(2)图为金刚石晶胞,其中原子坐标参数A为(0,0,0);B为( ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为_______ 。已知金刚石的晶胞参数为a pm,则其密度为_______ g·cm-3(列出计算式)。
(1)锰的价层电子排布式为
(2)磁性氧化铁纳米粒子除隔效率不如 MnS 纳米粒子,试比较两种纳米材料中的阴离子的半径大小O2-
(3)Mn 可以形成多种配合物,[Mn(CO)(H2O)2(NH3)3]Cl2·H2O中第二周期元素第一电离能由大到小关系为
II.(1)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为

(2)图为金刚石晶胞,其中原子坐标参数A为(0,0,0);B为(
 ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】下图是使用离子交换树脂的“离子交换法”从海带中提取碘的主要流程。 可被其它更易被吸附的阴离子替代)对
可被其它更易被吸附的阴离子替代)对 有很强的交换吸附能力;②步骤“交换吸附”发生的反应:
有很强的交换吸附能力;②步骤“交换吸附”发生的反应: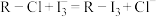 。
。
请回答:
(1)写出海带浸出液被氧化生成粗碘水过程中的反应方程式:__________ 。
(2)下列说法正确的是__________。
(3)“氧化”过程不能加入过量 ,原因是
,原因是__________ 。
(4)流程中的中间产物 可在淀粉指示剂下与酸化的过氧化氢反应,现象为蓝色—无色—蓝色—无色的重复现象,称为“碘钟实验”,写出a过程的离子方程式。
可在淀粉指示剂下与酸化的过氧化氢反应,现象为蓝色—无色—蓝色—无色的重复现象,称为“碘钟实验”,写出a过程的离子方程式。
a.蓝色出现,并伴有大量气泡:__________ ;
b.蓝色消失:
(5)设计实验方案验证氧化过程得到粗碘水中碘元素除 外可能的存在形式。(不考虑其它杂质阴离子)
外可能的存在形式。(不考虑其它杂质阴离子)__________ 。
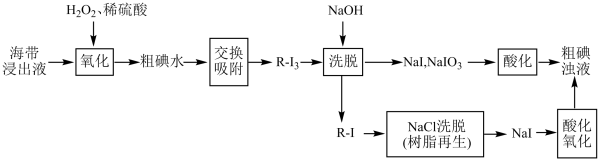
 可被其它更易被吸附的阴离子替代)对
可被其它更易被吸附的阴离子替代)对 有很强的交换吸附能力;②步骤“交换吸附”发生的反应:
有很强的交换吸附能力;②步骤“交换吸附”发生的反应: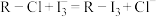 。
。请回答:
(1)写出海带浸出液被氧化生成粗碘水过程中的反应方程式:
(2)下列说法正确的是__________。
A.已知 的VSEPR模型为 的VSEPR模型为 ,推测 ,推测 为sp杂化 为sp杂化 |
B.可用KI溶液提取 中的碘单质 中的碘单质 |
C.该制备流程中“洗脱”、“酸化”、“ 洗脱”均涉及到氧化还原反应 洗脱”均涉及到氧化还原反应 |
D.“酸化氧化”过程若选择 为氧化剂,反应生成一种无色气体,遇空气立即变为红棕色,则 为氧化剂,反应生成一种无色气体,遇空气立即变为红棕色,则 与 与 的物质的量比应不少于 的物质的量比应不少于 |
(3)“氧化”过程不能加入过量
 ,原因是
,原因是(4)流程中的中间产物
 可在淀粉指示剂下与酸化的过氧化氢反应,现象为蓝色—无色—蓝色—无色的重复现象,称为“碘钟实验”,写出a过程的离子方程式。
可在淀粉指示剂下与酸化的过氧化氢反应,现象为蓝色—无色—蓝色—无色的重复现象,称为“碘钟实验”,写出a过程的离子方程式。a.蓝色出现,并伴有大量气泡:
b.蓝色消失:

(5)设计实验方案验证氧化过程得到粗碘水中碘元素除
 外可能的存在形式。(不考虑其它杂质阴离子)
外可能的存在形式。(不考虑其它杂质阴离子)
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】元素周期表中,第四周期元素单质及其化合物在化工生产和研究中有重要的应用。
(1)Ti能形成化合物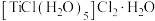 ,该化合物中
,该化合物中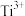 的配位数为
的配位数为______ ,在该化合物中不含______ (填标号)。
A. 键 B.
键 B. 键 C.配位键 D.离子键 E.极性键 F.非极性键
键 C.配位键 D.离子键 E.极性键 F.非极性键
(2)在ZnO催化作用下,呋喃( )可与氨反应,转化为吡咯(
)可与氨反应,转化为吡咯( ),吡咯分子中所有原子共平面,已知大π键可以用
),吡咯分子中所有原子共平面,已知大π键可以用 表示,其中m表示参与形成大
表示,其中m表示参与形成大 键的原子数,n代表大
键的原子数,n代表大 键中的电子数,则吡咯中大
键中的电子数,则吡咯中大 键可以表示为
键可以表示为______ 。呋喃的熔、沸点______ 吡咯(填“高于”或“低于”),原因是______ 。
(3)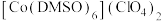 是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为
是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为 。
。 中
中 键角
键角______  中
中 键角(填“大于”“小于”或“等于”)。
键角(填“大于”“小于”或“等于”)。
(4)硒氧化铋是一类:全新二维半导体芯片材料,为四方晶系晶胞结构(如图所示),可以看成带正电的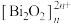 层与带负电的
层与带负电的 层交替堆叠。据此推断硒氧化铋的化学式为
层交替堆叠。据此推断硒氧化铋的化学式为______ 。晶胞棱边夹角均为90°,则晶体密度的计算式为______  (
( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(1)Ti能形成化合物
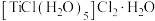 ,该化合物中
,该化合物中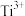 的配位数为
的配位数为A.
 键 B.
键 B. 键 C.配位键 D.离子键 E.极性键 F.非极性键
键 C.配位键 D.离子键 E.极性键 F.非极性键(2)在ZnO催化作用下,呋喃(
 )可与氨反应,转化为吡咯(
)可与氨反应,转化为吡咯( ),吡咯分子中所有原子共平面,已知大π键可以用
),吡咯分子中所有原子共平面,已知大π键可以用 表示,其中m表示参与形成大
表示,其中m表示参与形成大 键的原子数,n代表大
键的原子数,n代表大 键中的电子数,则吡咯中大
键中的电子数,则吡咯中大 键可以表示为
键可以表示为(3)
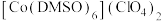 是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为
是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为 。
。 中
中 键角
键角 中
中 键角(填“大于”“小于”或“等于”)。
键角(填“大于”“小于”或“等于”)。(4)硒氧化铋是一类:全新二维半导体芯片材料,为四方晶系晶胞结构(如图所示),可以看成带正电的
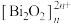 层与带负电的
层与带负电的 层交替堆叠。据此推断硒氧化铋的化学式为
层交替堆叠。据此推断硒氧化铋的化学式为 (
( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E、F和C位于同一主族,F处于第一个长周期。
(1)F原子基态的外围核外电子排布式为___________ ;
(2)由A、B、C形成的离子CAB﹣与AC2互为等电子体,则CAB﹣的结构式为___________ ;
(3)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为___________ ;
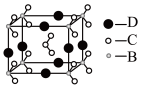
(4)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为___________ ;
(5)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NOx、CH2═CHCHO、HCOOH、CH3COONO2(PAN)等二次污染物。下列说法正确的是___________;
(6)NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4该配合物中心离子的配体为___________ ,其中提供空轨道的是___________ (填微粒符号)。
(1)F原子基态的外围核外电子排布式为
(2)由A、B、C形成的离子CAB﹣与AC2互为等电子体,则CAB﹣的结构式为
(3)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为
(4)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为

(5)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NOx、CH2═CHCHO、HCOOH、CH3COONO2(PAN)等二次污染物。下列说法正确的是___________;
| A.N2O为直线型分子 |
| B.C、N、O的第一电离能依次增大 |
| C.CH2═CH一CHO分子中碳原子均采用sp2杂化 |
| D.相同压强下,HCOOH沸点比CH3OCH3高,说明前者是极性分子,后者是非极性分子 |
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐3】卤族元素可以与很多元素形成多种具有不同组成、结构、性质的物质。请回答下列问题:
(1)基态氟原子价电子的轨道表示式为_______ 。
(2)亚硝酰氯(NOCl)是有机合成中的重要试剂,其中中心原子的杂化形式为_______ 。等电子体是指价电子数和原子数相同的分子、离子或原子团,写出与(NOCl)互为等电子体的一种分子_______ (填化学式)。
(3)东南大学某课题组合成了一种新型具有平面分子结构的醌类聚合物PPPA,PPPA可作为有机锌离子电池的正极材料。_______ 。
②NaCl溶液中存在水合钠离子,其示意图如图1所示。从电负性角度来解释这一现象_______ 。
(4)磷和硫均能形成多种卤化物。下列说法正确的是_______ (填标号)。
A.SCl2、PCl5均属于非极性分子
B.PCl3、S2Cl2的空间构型分别为三角锥形、直线形
C.NF3、S2Br2分子中各原子最外层均满足8电子稳定结构
(5)γ-AgI晶胞为立方结构,晶胞中I-采取面心立方堆积方式(如图3);γ-AgI晶胞沿x、y、z轴方向的投影均如图4所示。_______ (填“正四面体”或“正八面体”)空隙,其填充率为_______ 。
②γ-AgI晶胞的密度为ρg•cm-3,则晶胞中两个最近的Ag+之间的距离为_______ nm(NA表示阿伏加德罗常数的值)。
(1)基态氟原子价电子的轨道表示式为
(2)亚硝酰氯(NOCl)是有机合成中的重要试剂,其中中心原子的杂化形式为
(3)东南大学某课题组合成了一种新型具有平面分子结构的醌类聚合物PPPA,PPPA可作为有机锌离子电池的正极材料。

②NaCl溶液中存在水合钠离子,其示意图如图1所示。从电负性角度来解释这一现象
(4)磷和硫均能形成多种卤化物。下列说法正确的是
A.SCl2、PCl5均属于非极性分子
B.PCl3、S2Cl2的空间构型分别为三角锥形、直线形
C.NF3、S2Br2分子中各原子最外层均满足8电子稳定结构
(5)γ-AgI晶胞为立方结构,晶胞中I-采取面心立方堆积方式(如图3);γ-AgI晶胞沿x、y、z轴方向的投影均如图4所示。

②γ-AgI晶胞的密度为ρg•cm-3,则晶胞中两个最近的Ag+之间的距离为
您最近一年使用:0次



