Ⅰ.MnS 纳米粒子被广泛应用于除去重金属离子中的隔离子。
(1)锰的价层电子排布式为_______ 。
(2)磁性氧化铁纳米粒子除隔效率不如 MnS 纳米粒子,试比较两种纳米材料中的阴离子的半径大小O2-_______ S2-(填>、<或=)。H3O+中H-O-H的键角比H2O中的_______ (填大或小)
(3)Mn 可以形成多种配合物,[Mn(CO)(H2O)2(NH3)3]Cl2·H2O中第二周期元素第一电离能由大到小关系为_______ ,配体H2O中心原子杂化类型为_______ 配体NH3的空间构型为_______ (用文字描述)。
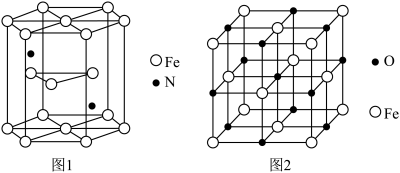
II.(1)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为_______ 。

(2)图为金刚石晶胞,其中原子坐标参数A为(0,0,0);B为( ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为_______ 。已知金刚石的晶胞参数为a pm,则其密度为_______ g·cm-3(列出计算式)。
(1)锰的价层电子排布式为
(2)磁性氧化铁纳米粒子除隔效率不如 MnS 纳米粒子,试比较两种纳米材料中的阴离子的半径大小O2-
(3)Mn 可以形成多种配合物,[Mn(CO)(H2O)2(NH3)3]Cl2·H2O中第二周期元素第一电离能由大到小关系为
II.(1)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为

(2)图为金刚石晶胞,其中原子坐标参数A为(0,0,0);B为(
 ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为
更新时间:2021-05-24 12:22:31
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】卤族元素是重要的非金属元素,用途广泛。回答下列问题:
(1)卤族元素位于元素周期表___________ 区,其中电负性最大的是___________ (填元素符号)。
(2)基态氟原子核外有___________ 种运动状态不同的电子,其中含有单电子的轨道形状为___________ 。
(3)溴元素对应的含氧酸 HBrO4酸性比 HBrO3酸性___________ (填“强”或“弱”),原因是___________ 。
(4)化合物 I3 AsF6为离子化合物,其中阳离子(I )中心原子的杂化方式为
)中心原子的杂化方式为___________ 。该晶体中不含有的化学键类型为___________ (填选项字母)。
a.配位键 b.金属键 c.极性键 d.非极性键
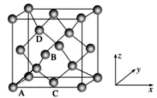
(5)由钾、氧、碘三种元素构成的晶体晶胞结构如图1所示。则该晶体的化学式为___________ ,晶胞中位置与 K+紧邻的 O 的个数为___________ 。
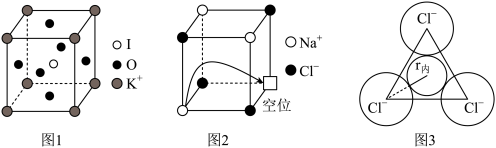
(6)有“点缺陷”的 NaCl 晶体可导电,其结构如图 2 所示。有人认为:高温下有“点缺陷”的 NaCl 晶体能导电,是因为 Na+经过一个由 3 个 Cl-组成的最小三角形窗孔(如图 3 所示),迁移到另一空位而造成的。已知立方体边长 a=282pm,粒子半径 r(Na+)=115pm,r(Cl-)=167pm,计算内切圆半径 r内的值并判断该观点是否正确___________ 。(已知: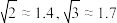 )
)
(1)卤族元素位于元素周期表
(2)基态氟原子核外有
(3)溴元素对应的含氧酸 HBrO4酸性比 HBrO3酸性
(4)化合物 I3 AsF6为离子化合物,其中阳离子(I
 )中心原子的杂化方式为
)中心原子的杂化方式为a.配位键 b.金属键 c.极性键 d.非极性键
(5)由钾、氧、碘三种元素构成的晶体晶胞结构如图1所示。则该晶体的化学式为

(6)有“点缺陷”的 NaCl 晶体可导电,其结构如图 2 所示。有人认为:高温下有“点缺陷”的 NaCl 晶体能导电,是因为 Na+经过一个由 3 个 Cl-组成的最小三角形窗孔(如图 3 所示),迁移到另一空位而造成的。已知立方体边长 a=282pm,粒子半径 r(Na+)=115pm,r(Cl-)=167pm,计算内切圆半径 r内的值并判断该观点是否正确
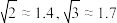 )
)
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】过渡金属元素及其化合物的应用研究是目前科学研究的前沿之一。请回答下列问题:
二茂铁[(C5H5)2Fe]的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。已知二茂铁熔点是173℃(在100℃时开始升华),沸点是249℃。
(1)基态Fe2+离子的价电子排布式为_______________________________
(2)二茂铁属于___________________ 晶体;测定表明二茂铁中所有氢原子的化学环境都相同,则二茂铁的结构应为下图中的________________ (选填“a”或“b”)

(3)环戊二烯( )中C的杂化方式
)中C的杂化方式 _______________ 。1mol环戊二烯中含有σ键的数目为___________ 。
(4)分子中的大π键可用符号πmn表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π66),在C5H5—中的每个碳原子上都有一个未参与σ键的电子,这些电子占据与环的平面垂直的p轨道上。C5H5—的大π键可以表示为______________ 。
(5)如图,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。下列说法正确的是_______
A.γ﹣Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
B.α﹣Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
C.若δ﹣Fe晶胞边长为acm,α﹣Fe晶胞边长为bcm,则两种晶体密度比为2b3:a3
D.将铁加热到1500℃分别急速冷却和缓慢冷却,得到的晶体类型相同
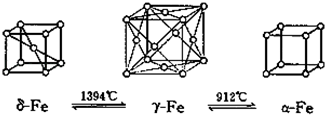
(6)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体性质会产生重大影响。由于晶体缺陷,晶体中Fe和O的个数比发生了变化,变为FexO(x<1),若测得某FexO晶体密度为5.71g•cm-3,晶胞边长为4.28×10-10 m,则FexO中x=_____ (用代数式表示,不要求算出具体结果)。
二茂铁[(C5H5)2Fe]的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。已知二茂铁熔点是173℃(在100℃时开始升华),沸点是249℃。
(1)基态Fe2+离子的价电子排布式为
(2)二茂铁属于

(3)环戊二烯(
 )中C的杂化方式
)中C的杂化方式 (4)分子中的大π键可用符号πmn表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π66),在C5H5—中的每个碳原子上都有一个未参与σ键的电子,这些电子占据与环的平面垂直的p轨道上。C5H5—的大π键可以表示为
(5)如图,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。下列说法正确的是
A.γ﹣Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
B.α﹣Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
C.若δ﹣Fe晶胞边长为acm,α﹣Fe晶胞边长为bcm,则两种晶体密度比为2b3:a3
D.将铁加热到1500℃分别急速冷却和缓慢冷却,得到的晶体类型相同

(6)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体性质会产生重大影响。由于晶体缺陷,晶体中Fe和O的个数比发生了变化,变为FexO(x<1),若测得某FexO晶体密度为5.71g•cm-3,晶胞边长为4.28×10-10 m,则FexO中x=
您最近一年使用:0次
【推荐3】随着科学技术不断发展,新型材料层出不穷,如3D打印材料、柔性电极材料、稀土抛光材料等。回答下列问题:
(1)目前常用的3D打印材料主要有光敏树脂、铝合金、钛合金等。
①基态Al原子核外共有___________ 种空间运动状态不同的电子,基态钛原子的价电子排布为___________ 。
②光敏树脂是由高分子组成的胶状物质。在紫外线照射下,这些分子结合成坚硬的交联聚合物高分子。从胶状到固态的打印过程中,光敏树脂中的___________ (填作用力类型)发生了改变。
(2)某柔性电极材料由聚吡咯( )、二维层状材料Ti3C2和聚乙烯醇复合而成。
)、二维层状材料Ti3C2和聚乙烯醇复合而成。
①上述三种物质中涉及的非金属元素(除H外)的电负性从大到小的顺序为___________ ,聚吡咯的单体吡咯( )分子为平面结构,则其中氮原子的杂化方式为
)分子为平面结构,则其中氮原子的杂化方式为___________ 。
②吡咯、呋喃( )、噻吩(
)、噻吩( )都是杂环化合物,沸点:吡咯>噻吩>呋喃,原因是
)都是杂环化合物,沸点:吡咯>噻吩>呋喃,原因是___________ 。
(3)CeO2是重要的稀土抛光材料,图甲为理想的CeO2的立方晶胞模型,但是几乎不存在完美的晶型,实际晶体中常存在缺陷(如图乙)。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标。已知:CeO2缺陷晶型中X处原子的分数坐标为(0,0,0),Y处原子的分数坐标为( ,
, ,0),则氧空位处原子的分数坐标为
,0),则氧空位处原子的分数坐标为___________ ,该缺陷晶型的化学式可表示为___________ 。
②设阿伏加德罗常数的值为NA,CeO2理想晶型的密度为ρ g·cm-3,则Ce原子与O原子的最近距离为___________ pm(列出表达式)。
(1)目前常用的3D打印材料主要有光敏树脂、铝合金、钛合金等。
①基态Al原子核外共有
②光敏树脂是由高分子组成的胶状物质。在紫外线照射下,这些分子结合成坚硬的交联聚合物高分子。从胶状到固态的打印过程中,光敏树脂中的
(2)某柔性电极材料由聚吡咯(
 )、二维层状材料Ti3C2和聚乙烯醇复合而成。
)、二维层状材料Ti3C2和聚乙烯醇复合而成。①上述三种物质中涉及的非金属元素(除H外)的电负性从大到小的顺序为
 )分子为平面结构,则其中氮原子的杂化方式为
)分子为平面结构,则其中氮原子的杂化方式为②吡咯、呋喃(
 )、噻吩(
)、噻吩( )都是杂环化合物,沸点:吡咯>噻吩>呋喃,原因是
)都是杂环化合物,沸点:吡咯>噻吩>呋喃,原因是(3)CeO2是重要的稀土抛光材料,图甲为理想的CeO2的立方晶胞模型,但是几乎不存在完美的晶型,实际晶体中常存在缺陷(如图乙)。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标。已知:CeO2缺陷晶型中X处原子的分数坐标为(0,0,0),Y处原子的分数坐标为(
 ,
, ,0),则氧空位处原子的分数坐标为
,0),则氧空位处原子的分数坐标为②设阿伏加德罗常数的值为NA,CeO2理想晶型的密度为ρ g·cm-3,则Ce原子与O原子的最近距离为
您最近一年使用:0次
【推荐1】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
(1)基态 的电子排布式为
的电子排布式为____________________ 。
(2)实验室用 溶液、苯酚(
溶液、苯酚( )检验
)检验 。N、O、S的第一电离能由大到小的顺序为
。N、O、S的第一电离能由大到小的顺序为__________ (用元素符号表示),苯酚中碳原子的杂化轨道类型为__________ 。
(3)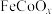 是一种新型光电催化剂。第四电离能大小关系是
是一种新型光电催化剂。第四电离能大小关系是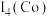
__________ 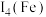 (填“>”或“<”),原因是
(填“>”或“<”),原因是____________________ 。
(4)铁晶体有面心立方最密堆积和体心立方堆积两种晶体,这两种晶体铁原子的配位数之比为__________ 。
(5)某种磁性氮化铁的晶胞结构如图1所示,该化合物的化学式为__________ 。若晶胞底边长为 ,高为
,高为 ,则这种磁性炎化铁的晶体密度为
,则这种磁性炎化铁的晶体密度为__________  (用含a、c和
(用含a、c和 的式子表示并化到最简)。
的式子表示并化到最简)。
(6)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为 ,
, 代表阿伏加德罗常数的值。在该晶胞中,
代表阿伏加德罗常数的值。在该晶胞中, 与
与 的最短核间距为
的最短核间距为__________  。
。
(1)基态
 的电子排布式为
的电子排布式为(2)实验室用
 溶液、苯酚(
溶液、苯酚( )检验
)检验 。N、O、S的第一电离能由大到小的顺序为
。N、O、S的第一电离能由大到小的顺序为(3)
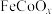 是一种新型光电催化剂。第四电离能大小关系是
是一种新型光电催化剂。第四电离能大小关系是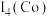
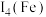 (填“>”或“<”),原因是
(填“>”或“<”),原因是(4)铁晶体有面心立方最密堆积和体心立方堆积两种晶体,这两种晶体铁原子的配位数之比为
(5)某种磁性氮化铁的晶胞结构如图1所示,该化合物的化学式为
 ,高为
,高为 ,则这种磁性炎化铁的晶体密度为
,则这种磁性炎化铁的晶体密度为 (用含a、c和
(用含a、c和 的式子表示并化到最简)。
的式子表示并化到最简)。(6)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为
 ,
, 代表阿伏加德罗常数的值。在该晶胞中,
代表阿伏加德罗常数的值。在该晶胞中, 与
与 的最短核间距为
的最短核间距为 。
。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】目前新合成的砷化镉(Cd3As2)三维材料具有超强导电性,这种材料的电气性能与石墨烯相当,可代替石墨烯使用。
(1)Cd与Zn同族且相邻,若Cd基态原子将次外层1个d电子激发进入最外层的np能级,则该激发态原子的外围电子排布式为___________ 。Cd原子中第一电离能相对较大的是___________ 原子(填“基态”或“激发态”)。
(2)与砷(As)同主族的N、P两种元素的氢化物水溶液的碱性:NH3___________ PH3(填“>”或“<”),原因是___________ 。
(3)As与Ge、Se同周期且相邻,它们的第一电离能由大到小的顺序为___________ (用元素符号表示)。
(4)含砷有机物“对氨基苯砷酸”的结构简式如图,As原子轨道杂化类型为___________ ,1mol对氨基苯砷酸含σ数目为___________ 。

(5)碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,C60分子占据顶点和面心处,K+占据的是C60分子围成的___________ 空隙和___________ 空隙(填几何空间构型);若C60分子的坐标参数分别为A(0,0,0),B( ,0,
,0, ),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为
),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为___________ 。
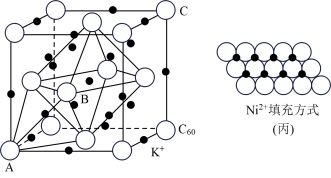
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图丙),已知O2-的半径为anm,每平方米面积上分散的该晶体的质量为___________ g(用a、NA表示)。
(1)Cd与Zn同族且相邻,若Cd基态原子将次外层1个d电子激发进入最外层的np能级,则该激发态原子的外围电子排布式为
(2)与砷(As)同主族的N、P两种元素的氢化物水溶液的碱性:NH3
(3)As与Ge、Se同周期且相邻,它们的第一电离能由大到小的顺序为
(4)含砷有机物“对氨基苯砷酸”的结构简式如图,As原子轨道杂化类型为

(5)碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,C60分子占据顶点和面心处,K+占据的是C60分子围成的
 ,0,
,0, ),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为
),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为
(6)一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充其中(如图丙),已知O2-的半径为anm,每平方米面积上分散的该晶体的质量为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐3】X、Y、Z、W、Q为元素周期表中前四周期的元素,其元素性质和原子结构如表所述。
回答下列问题:
(1)Y位于元素周期表的___________ 区,基态Z原子的核外电子排布式为___________ 。
(2)与W同周期且第一电离能比其大的元素为___________ (填元素符号),W与X形成的简单化合物分子中,中心原子的VSEPR模型为___________ 。
(3)基态Q原子核外电子有___________ 种空间运动状态,Q与X形成的简单化合物和W与X形成的简单化合物在水中___________ 溶解度较大的为(写分子式),原因是___________ 。
(4)W和Q形成的某种分子的空间构型为三角锥形,其中心原子的杂化轨道类型为___________ ,该分子为___________ (填“极性”或“非极性”)分子。
| 元素 | 元素性质或原子结构 |
| X | 基态原子只有一种形状的轨道填有电子,且易形成共价键 |
| Y | 基态原子核外的M层中只有两对成对电子 |
| Z | 前四周期元素中基态原子的未成对电子数最多 |
| W | 与Y同周期,且在该周期元素中第一电离能由大到小排第三位 |
| Q | 元素周期表中电负性最大的元素 |
(1)Y位于元素周期表的
(2)与W同周期且第一电离能比其大的元素为
(3)基态Q原子核外电子有
(4)W和Q形成的某种分子的空间构型为三角锥形,其中心原子的杂化轨道类型为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】Se与S同主族硒(Se)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(AIE)效应以来,AIE在发光材料、生物医学等领域引起广泛关注。一种含Se的新型AIE分子Ⅳ的合成路线如下:
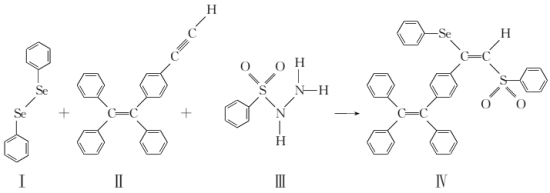
(1)关于Ⅰ~Ⅲ三种反应物,下列说法正确的有_______(填字母)。
(2)硒的两种含氧酸的酸性强弱为
_______  (填“>”或“<”)。
(填“>”或“<”)。 的立体构型为
的立体构型为_______ 。
(3)已知 晶胞为立方体,边长为a nm,如下图所示。
晶胞为立方体,边长为a nm,如下图所示。

①与 紧邻的阴离子个数为
紧邻的阴离子个数为_______ 。
②晶胞的密度为
_______  。(1 nm
。(1 nm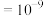 m)
m)
(4)以 为燃料,配合
为燃料,配合 可以制备铁粉精(
可以制备铁粉精( )和
)和 。结合图示解释可充分实现能源和资源有效利用的原因为
。结合图示解释可充分实现能源和资源有效利用的原因为_______ 。


(1)关于Ⅰ~Ⅲ三种反应物,下列说法正确的有_______(填字母)。
| A.Ⅰ中仅有σ键 |
| B.Ⅰ中的Se-Se键为非极性共价键 |
| C.Ⅱ易溶于水 |
D.Ⅱ中原子的杂化轨道类型只有sp与 |

 (填“>”或“<”)。
(填“>”或“<”)。 的立体构型为
的立体构型为(3)已知
 晶胞为立方体,边长为a nm,如下图所示。
晶胞为立方体,边长为a nm,如下图所示。
①与
 紧邻的阴离子个数为
紧邻的阴离子个数为②晶胞的密度为

 。(1 nm
。(1 nm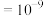 m)
m)(4)以
 为燃料,配合
为燃料,配合 可以制备铁粉精(
可以制备铁粉精( )和
)和 。结合图示解释可充分实现能源和资源有效利用的原因为
。结合图示解释可充分实现能源和资源有效利用的原因为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】钛与铁是很重要的金属。已成为化工生产中重要的材料。回答下列问题:
(1)基态钛原子的价电子排布式为__________________ ,金属钛晶胞如下左图所示,晶胞参数为a=b= 295.08pm,c=468.55pm,α=β=90%,y= 120%。金属钛为______________ 堆积(填堆积方式)。
(2)用熔融的镁在氩气中还原TiCl4可得到多空的海绵钛。已知TiCl4在通常情况下是无色液体,熔点为-23℃,沸点为136℃,可知TiCl4为____________ 晶 体。
(3)通过X-射线探明KCl、CaO、TiN晶体与NaCl晶体结构相似,且知两种离子晶体的晶格能数据如下:
解释KCl晶格能小于CaO的原因:_______________ 。
钛可与C、N、O等元素形成二元化合物。C、N、O元素的电负性由大到小的顺序是________ 。
(4)钙钛矿晶体的结构如下右图所示。晶体的化学式为_________________ 。

晶胞中的原子可用x、y、z组成的三数组来表达它在晶胞中的位置,称为原子坐标。已知原子坐标为A(0,0,0);B(0,1/2,0);则Ca 离子的原子坐标为______________ 。
(5)Fe有δ、γ、α三种同素异形体,其晶胞结构如下图所示:

①δ、α两种晶体晶胞中铁原子的配位数之比为_______________________ 。
②若Fe原子半径为rpm,NA表示阿伏伽德罗常数的值,则δ-Fe单质的密度为________ g/cm3(列出算式即可)。
(1)基态钛原子的价电子排布式为
(2)用熔融的镁在氩气中还原TiCl4可得到多空的海绵钛。已知TiCl4在通常情况下是无色液体,熔点为-23℃,沸点为136℃,可知TiCl4为
(3)通过X-射线探明KCl、CaO、TiN晶体与NaCl晶体结构相似,且知两种离子晶体的晶格能数据如下:
| 离子晶体 | KCl | CaO |
| 晶格能(kJ/mol) | 715 | 3401 |
解释KCl晶格能小于CaO的原因:
钛可与C、N、O等元素形成二元化合物。C、N、O元素的电负性由大到小的顺序是
(4)钙钛矿晶体的结构如下右图所示。晶体的化学式为

晶胞中的原子可用x、y、z组成的三数组来表达它在晶胞中的位置,称为原子坐标。已知原子坐标为A(0,0,0);B(0,1/2,0);则Ca 离子的原子坐标为
(5)Fe有δ、γ、α三种同素异形体,其晶胞结构如下图所示:

①δ、α两种晶体晶胞中铁原子的配位数之比为
②若Fe原子半径为rpm,NA表示阿伏伽德罗常数的值,则δ-Fe单质的密度为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】我国早期科技丛书《物理小识·金石类》写道:“青矾厂气熏人,衣服当之易烂,载木不盛,惟乌柏树不畏其气”,“青矾”则是绿矾,强热时发生如下反应:
2FeSO4·7H2O→Fe2O3+SO3+SO2+7H2O
回答下列问题:
(1)基态硫原子的价层电子排布式___________ ,其最高能级上电子云形状是___________ ,上述四种元素电负性由大到小的顺序是___________ ,从结构的角度解释Fe3+稳定性强于Fe2+的原因是__________ 。
(2)氧、硫能形成许多化合物,如:H2O、SO2、SO3、SO42-,这些物质的中心原子杂化轨道类型为SP2的是___________ ,空间构型是V形的分子是___________ ,属于非极性分子的是___________ 。
(3)已知Fe2O3熔点为1565℃,在熔化状态下液体中存在两种粒子,则其晶体类型最可能是___________ ,若FeO与Fe2O3晶体类型相同,则二者熔点较高的物质是___________ 。
(4)铁的某种氧化物晶胞如图所示(实心球为铁原子);

①该氧化物的化学式为___________ 。
②氧、铁的原子半径分别为rO pm、rFe pm,晶体密度为ρg·cm-3,阿伏伽德罗常数的值为NA,该晶胞的空间利用率为___________ (用含π的式子表示)
2FeSO4·7H2O→Fe2O3+SO3+SO2+7H2O
回答下列问题:
(1)基态硫原子的价层电子排布式
(2)氧、硫能形成许多化合物,如:H2O、SO2、SO3、SO42-,这些物质的中心原子杂化轨道类型为SP2的是
(3)已知Fe2O3熔点为1565℃,在熔化状态下液体中存在两种粒子,则其晶体类型最可能是
(4)铁的某种氧化物晶胞如图所示(实心球为铁原子);

①该氧化物的化学式为
②氧、铁的原子半径分别为rO pm、rFe pm,晶体密度为ρg·cm-3,阿伏伽德罗常数的值为NA,该晶胞的空间利用率为
您最近一年使用:0次



