卤族元素是重要的非金属元素,用途广泛。回答下列问题:
(1)卤族元素位于元素周期表___________ 区,其中电负性最大的是___________ (填元素符号)。
(2)基态氟原子核外有___________ 种运动状态不同的电子,其中含有单电子的轨道形状为___________ 。
(3)溴元素对应的含氧酸 HBrO4酸性比 HBrO3酸性___________ (填“强”或“弱”),原因是___________ 。
(4)化合物 I3 AsF6为离子化合物,其中阳离子(I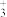 )中心原子的杂化方式为
)中心原子的杂化方式为___________ 。该晶体中不含有的化学键类型为___________ (填选项字母)。
a.配位键 b.金属键 c.极性键 d.非极性键
(5)由钾、氧、碘三种元素构成的晶体晶胞结构如图1所示。则该晶体的化学式为___________ ,晶胞中位置与 K+紧邻的 O 的个数为___________ 。
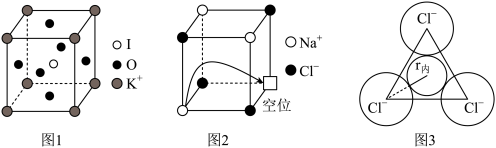
(6)有“点缺陷”的 NaCl 晶体可导电,其结构如图 2 所示。有人认为:高温下有“点缺陷”的 NaCl 晶体能导电,是因为 Na+经过一个由 3 个 Cl-组成的最小三角形窗孔(如图 3 所示),迁移到另一空位而造成的。已知立方体边长 a=282pm,粒子半径 r(Na+)=115pm,r(Cl-)=167pm,计算内切圆半径 r内的值并判断该观点是否正确___________ 。(已知: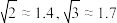 )
)
(1)卤族元素位于元素周期表
(2)基态氟原子核外有
(3)溴元素对应的含氧酸 HBrO4酸性比 HBrO3酸性
(4)化合物 I3 AsF6为离子化合物,其中阳离子(I
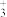 )中心原子的杂化方式为
)中心原子的杂化方式为a.配位键 b.金属键 c.极性键 d.非极性键
(5)由钾、氧、碘三种元素构成的晶体晶胞结构如图1所示。则该晶体的化学式为

(6)有“点缺陷”的 NaCl 晶体可导电,其结构如图 2 所示。有人认为:高温下有“点缺陷”的 NaCl 晶体能导电,是因为 Na+经过一个由 3 个 Cl-组成的最小三角形窗孔(如图 3 所示),迁移到另一空位而造成的。已知立方体边长 a=282pm,粒子半径 r(Na+)=115pm,r(Cl-)=167pm,计算内切圆半径 r内的值并判断该观点是否正确
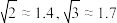 )
)
更新时间:2021-05-14 13:26:50
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】在庆祝中华人民共和国成立70周年的阅兵仪式上,最后亮相的DF—31A洲际战略导弹是我国大国地位、国防实力的显著标志。其制作材料中包含了 Fe、Cr、Ni、C等多种元素。回答下列问题:
(1)基态铁原子的价电子排布式为______________ 。
(2)与Cr同周期且基态原子最外层电子数相同的元素,可能位于周期表中的______ 区。
(3)实验室常用KSCN溶液、苯酚( )检验Fe3+。其中N、O、S的第一电离能由大到小的顺序为
)检验Fe3+。其中N、O、S的第一电离能由大到小的顺序为_______________ (用元素符号表示),苯酚中碳原子的杂化轨道类型为______________ 。
(4)铁元素能与CO形成Fe(CO)5。羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1 mol Fe(CO)5分子中含___________ mol σ 键,与CO互为等电子体的一种离子的化学式为______________ 。
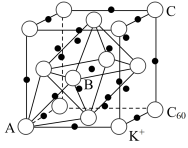
(5)碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,C60分子占据顶点和面心处,K+占据的是C60分子围成的_______________ 空隙和_____________ 空隙(填几何空间构型);若C60分子的坐标参数分别为A(0,0, 0),B( ,0,
,0, ),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为
),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为__________ 。
(6)Ni可以形成多种氧化物,其中一种NiaO晶体晶胞结构为NaCl型,由于晶体缺陷,a的值为0. 88,且晶体中的Ni分别为Ni2+、Ni3+,则晶体中Ni2+与Ni3+的最简整数比为________ ,晶胞参数为428 pm,则晶体密度为______ g/cm3(NA表示阿伏加 德罗常数的值,列出表达式)。
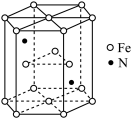
(7)某种磁性氮化铁的结构如图所示,N随机排列在Fe构成的正四面体空隙中。正六棱柱底边长为a nm,高为c nm,阿伏加 德罗常数的值为NA,则该磁性氮化铁的晶体密度为____________ g/cm3(列出计算式)。
(1)基态铁原子的价电子排布式为
(2)与Cr同周期且基态原子最外层电子数相同的元素,可能位于周期表中的
(3)实验室常用KSCN溶液、苯酚(
 )检验Fe3+。其中N、O、S的第一电离能由大到小的顺序为
)检验Fe3+。其中N、O、S的第一电离能由大到小的顺序为(4)铁元素能与CO形成Fe(CO)5。羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1 mol Fe(CO)5分子中含
(5)碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,C60分子占据顶点和面心处,K+占据的是C60分子围成的
 ,0,
,0, ),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为
),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为
(6)Ni可以形成多种氧化物,其中一种NiaO晶体晶胞结构为NaCl型,由于晶体缺陷,a的值为0. 88,且晶体中的Ni分别为Ni2+、Ni3+,则晶体中Ni2+与Ni3+的最简整数比为
(7)某种磁性氮化铁的结构如图所示,N随机排列在Fe构成的正四面体空隙中。正六棱柱底边长为a nm,高为c nm,阿伏加 德罗常数的值为NA,则该磁性氮化铁的晶体密度为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】(I)某原料经测定主要含有A、B、C、D四种原子序数依次增大的短周期元素,其相关信息如下:
请回答下列问题(用A、B、C、D、所对应的元素符号作答):
(1) B、C、D第一电离能由大到小的顺序为__________________________________
(2)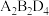 常用作除锈剂,该分子中B的杂化方式为
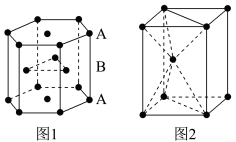
常用作除锈剂,该分子中B的杂化方式为_____ ;1 mol 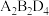 分子中含有σ键与π键的数目之比为
分子中含有σ键与π键的数目之比为_____ 。
(3)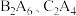 分子中均含有18个电子,它们的沸点相差较大,主要原因是
分子中均含有18个电子,它们的沸点相差较大,主要原因是_____________________
(Ⅱ)化学与生活密切相关。K2Cr2O7曾用于检测司机是否酒后驾驶:Cr2O (橙色)+CH3CH2OH
(橙色)+CH3CH2OH Cr3+(绿色)+CH3COOH (未配平)
Cr3+(绿色)+CH3COOH (未配平)
(4)基态Cr 原子的价电子排布图为__________________________________
(5)已知Cr3+等过渡元素水合离子的颜色如下表所示:
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因为________________ 。
(6)ZnCl2浓溶液常用于除去金属表面的氧化物,例如与FeO反应可得Fe[Zn(OH)Cl2]2溶液。Fe[Zn(OH)Cl2]2的水溶液中不存在的粒子间作用力有____________ (填选项字母);
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力 F.氢键
(7)锌是人体必需的微量元素之一,其堆积方式如图1,晶胞结构如图2。锌的堆积方式为_____________________ ,配位数为_______ 。
元素 | 元素性质或原子结构 |
A | 周期表中原子半径最小的元素 |
B | 原子核外有三种不同的能级且各个能级所填充的电子数相同 |
C | 最外层p轨道半充满 |
D | 位于短周期,其原子的核外成对电子数是未成对电子数的3倍 |
请回答下列问题(用A、B、C、D、所对应的元素符号作答):
(1) B、C、D第一电离能由大到小的顺序为
(2)
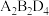 常用作除锈剂,该分子中B的杂化方式为
常用作除锈剂,该分子中B的杂化方式为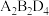 分子中含有σ键与π键的数目之比为
分子中含有σ键与π键的数目之比为(3)
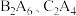 分子中均含有18个电子,它们的沸点相差较大,主要原因是
分子中均含有18个电子,它们的沸点相差较大,主要原因是(Ⅱ)化学与生活密切相关。K2Cr2O7曾用于检测司机是否酒后驾驶:Cr2O
 (橙色)+CH3CH2OH
(橙色)+CH3CH2OH Cr3+(绿色)+CH3COOH (未配平)
Cr3+(绿色)+CH3COOH (未配平)(4)基态Cr 原子的价电子排布图为
(5)已知Cr3+等过渡元素水合离子的颜色如下表所示:
离子 | Sc3+ | Cr3+ | Fe2+ | Zn2+ |
水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因为
(6)ZnCl2浓溶液常用于除去金属表面的氧化物,例如与FeO反应可得Fe[Zn(OH)Cl2]2溶液。Fe[Zn(OH)Cl2]2的水溶液中不存在的粒子间作用力有
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力 F.氢键
(7)锌是人体必需的微量元素之一,其堆积方式如图1,晶胞结构如图2。锌的堆积方式为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐3】前四周期的A、B、C、D四种元素在周期表中均与元素X紧密相邻.已知元素X最高价氧化物的化学式为X2O5,B、D同主族且B元素的原子半径是同族元素中最小的,C的最高价氧化物对应的水化物是强酸.
(1)D元素基态原子的价电子排布式为______ .
(2)B、X、D氢化物的沸点由高到低的顺序为______ (用相应的化学式作答).
(3)E元素是A元素所在周期中电负性最大的,则EO3-的立体构型为______ .
(4)F元素基态原子M层上有5对成对电子,F元素的名称为______ .F形成的单质有δ、γ、α三种同素异形体,三种晶胞(如图所示)中F原子的配位数之比为______ ,δ、γ、α三种晶胞的密度之比为______ .
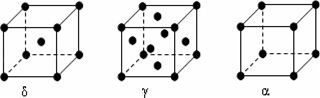
(1)D元素基态原子的价电子排布式为
(2)B、X、D氢化物的沸点由高到低的顺序为
(3)E元素是A元素所在周期中电负性最大的,则EO3-的立体构型为
(4)F元素基态原子M层上有5对成对电子,F元素的名称为

您最近一年使用:0次
解答题-有机推断题
|
较难
(0.4)
名校
解题方法
【推荐1】有机物K合成路线如下图 (部分条件已省略)。

已知:
①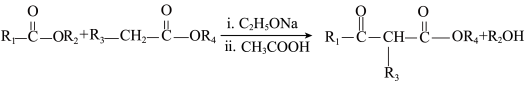
②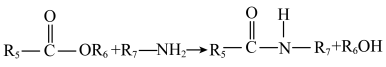 (
( 表示烃基)。
表示烃基)。
请回答下列问题。
(1)K的分子式为_______ 。
(2)A中官能团的名称是_______ ,G→H的反应类型是_______ 。
(3)B→D的化学方程式为_______ 。
(4)F→G中NaOH的作用是_______ 。
(5)D+H→J中形成酰胺键。在有机合成中常用酯基和 生成酰胺基,而不是用羧基和
生成酰胺基,而不是用羧基和 直接反应生成酰胺基,请结合元素电负性和键的极性解释原因:
直接反应生成酰胺基,请结合元素电负性和键的极性解释原因:_______ 。(元素电负性:H-2.1 C-2.5 O-3.5)
(6)由J生成K可以看作三步反应,如下图所示。

①P中有两个六元环结构。P的结构简式为_______ 。
②Q和K是互变异构关系,K比Q稳定的原因是_______ 。
(7)X是D的同分异构体,符合下列条件的X的结构简式是_______ 。
a.1molX能与足量银氨溶液反应生成4molAg
b.X中核磁共振氢谱中出现3组吸收峰,峰面积比为1:1:3

已知:
①
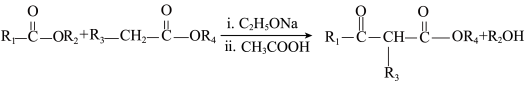
②
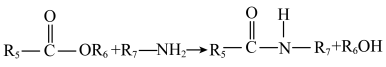 (
( 表示烃基)。
表示烃基)。请回答下列问题。
(1)K的分子式为
(2)A中官能团的名称是
(3)B→D的化学方程式为
(4)F→G中NaOH的作用是
(5)D+H→J中形成酰胺键。在有机合成中常用酯基和
 生成酰胺基,而不是用羧基和
生成酰胺基,而不是用羧基和 直接反应生成酰胺基,请结合元素电负性和键的极性解释原因:
直接反应生成酰胺基,请结合元素电负性和键的极性解释原因:(6)由J生成K可以看作三步反应,如下图所示。

①P中有两个六元环结构。P的结构简式为
②Q和K是互变异构关系,K比Q稳定的原因是
(7)X是D的同分异构体,符合下列条件的X的结构简式是
a.1molX能与足量银氨溶液反应生成4molAg
b.X中核磁共振氢谱中出现3组吸收峰,峰面积比为1:1:3
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】过渡元素参与组成的新型材料有着广泛的用途,回答下列问题。
(1)基态铁原子核外共有________ 种不同空间运动状态的电子。铁、钴、镍基态原子中,核外未成对电子数最少的原子价层电子轨道表示式(电子排布图)为________ 。
(2)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和74pm,则熔点NiO________ FeO(填“>”“<”或“=”),原因是________ 。
(3)Cr的一种配合物结构如图所示:
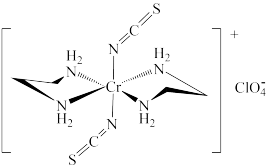
①阴离子 的空间构型为
的空间构型为________ 形。
②配离子中,中心离子的配位数为_______ ,N与中心原子形成的化学键称为_______ 键。
③配体H2NCH2CH2NH2(乙二胺)中碳原子的杂化方式是________ ,分子中三种元素电负性从大到小的顺序为________ 。
(4)一种新型材料的晶胞结构如图1所示,图2是晶胞中Sm和As原子的投影位置。
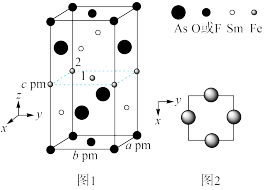
图1中F和O共同占据晶胞的上下底面位置,若两者的比例依次用x和1−x代表,则该化合物的化学式表示为________ ,晶体密度ρ=________ g·cm−3(用含x的表达式表示,设阿伏加 德罗常数的值为NA)。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标( ),则原子2的坐标为
),则原子2的坐标为________ 。
(1)基态铁原子核外共有
(2)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和74pm,则熔点NiO
(3)Cr的一种配合物结构如图所示:

①阴离子
 的空间构型为
的空间构型为②配离子中,中心离子的配位数为
③配体H2NCH2CH2NH2(乙二胺)中碳原子的杂化方式是
(4)一种新型材料的晶胞结构如图1所示,图2是晶胞中Sm和As原子的投影位置。

图1中F和O共同占据晶胞的上下底面位置,若两者的比例依次用x和1−x代表,则该化合物的化学式表示为
 ),则原子2的坐标为
),则原子2的坐标为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】利用铁矿石(Fe2O3),可以制得Fe3[Fe(CN)6]2和Fe(SCN)3,请回答下列问题:
(1)基态Fe3+的价电子排布式为___________ 。
(2)O、S、C三种元素的电负性由大到小的顺序为___________ ,Fe(CO)5是一种浅黄色液体,熔点-20℃,沸点103℃。Fe(CO)5晶体类型是___________ 。
(3)KSCN是检验Fe3+的试剂之一,与SCN-互为等电子体的分子为___________ (任写一种),SCN-中碳原子的杂化类型为___________ 。第一电离能I1(N)___________ I1(O)(填“大于”、“小于”或“等于”),理由是___________ 。
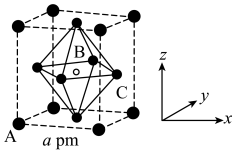
(4)钾晶体(其晶胞结构如图所示)的晶胞参数为apm。假定金属钾原子为等径的刚性小球且处于体对角线上的三个球相切,则钾原子的半径为___________ pm,晶体钾的密度计算式是___________ g/m3(设NA为阿伏伽德罗常数的值)

(1)基态Fe3+的价电子排布式为
(2)O、S、C三种元素的电负性由大到小的顺序为
(3)KSCN是检验Fe3+的试剂之一,与SCN-互为等电子体的分子为
(4)钾晶体(其晶胞结构如图所示)的晶胞参数为apm。假定金属钾原子为等径的刚性小球且处于体对角线上的三个球相切,则钾原子的半径为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
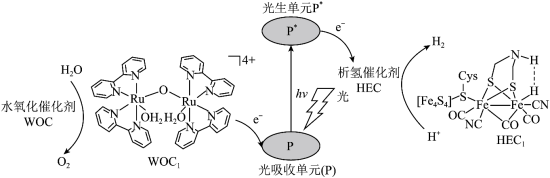
【推荐1】分子人工光合作用的光捕获原理如图所示,WOC1是水氧化催化剂WOC在水氧化过程中产生的中间体,HEC1是析氢催化剂HEC在析氢过程中产生的中间体。
回答下列问题:
(1)与Fe元素同周期,基态原子有2个未成对电子的金属元素有_______ 种,下列状态的铁中,电离最外层一个电子所需能量最大的是_______ (填标号)。
a. b.
b.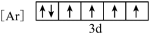
c.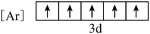 d.
d.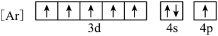
(2)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。1molWOC1中通过螯合作用形成的配位键有_______ mol。
(3)HEC1中的C、N、O三种元素都能与H元素形成含A-A(A表示C、N、O元素)键的氢化物。氢化物中A-A键的键能(kJ•moL-1)表:
A-A键的键能依次降低的原因是________ 。
(4)在多原子分子中有相互平行的p轨道,它们连贯、重叠在一起,构成一个整体,p电子在多个原子间运动,像这样不局限在两个原子之间的π键称为离域π键,如苯分子中的离域π键可表示为π 。N元素形成的两种微粒NO
。N元素形成的两种微粒NO 、NO
、NO 中,NO
中,NO 中的离域π键可表示为
中的离域π键可表示为______ ,NO 、NO
、NO 、NO
、NO 的键角由大到小的顺序是
的键角由大到小的顺序是_______ 。

回答下列问题:
(1)与Fe元素同周期,基态原子有2个未成对电子的金属元素有
a.
 b.
b.
c.
 d.
d.
(2)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。1molWOC1中通过螯合作用形成的配位键有
(3)HEC1中的C、N、O三种元素都能与H元素形成含A-A(A表示C、N、O元素)键的氢化物。氢化物中A-A键的键能(kJ•moL-1)表:
| H3C-CH3 | H3N-NH3 | HO-OH |
| 346 | 247 | 207 |
(4)在多原子分子中有相互平行的p轨道,它们连贯、重叠在一起,构成一个整体,p电子在多个原子间运动,像这样不局限在两个原子之间的π键称为离域π键,如苯分子中的离域π键可表示为π
 。N元素形成的两种微粒NO
。N元素形成的两种微粒NO 、NO
、NO 中,NO
中,NO 中的离域π键可表示为
中的离域π键可表示为 、NO
、NO 、NO
、NO 的键角由大到小的顺序是
的键角由大到小的顺序是
您最近一年使用:0次
解答题-有机推断题
|
较难
(0.4)
名校
【推荐2】某芳香烃A是一种重要的有机化工原料。以它为初始原料经过如下转化可以合成扁桃酸、医药中间体G等多种物质。

已知:①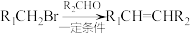
② 为间位定位基团
为间位定位基团
(1)扁桃酸分子中碳原子的杂化类型___________ 。
(2)C→D的化学方程式是___________ 。
(3) 的化学名称是
的化学名称是___________ 。
(4)写出由单体G通过加聚反应所得产物的结构简式___________ 。
(5)G有多种同分异构体,同时满足下列条件的同分异构体有___________ 种(不考虑立体异构)。
①属于芳香族化合物,且分子中含有的环只有苯环
②能发生银镜反应和水解反应
(6)已知 ,某兴趣小组用A为原料合成阿司匹林的前体水杨酸
,某兴趣小组用A为原料合成阿司匹林的前体水杨酸 ,请设计合成路线:
,请设计合成路线:___________ 。

已知:①
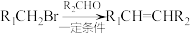
②
 为间位定位基团
为间位定位基团(1)扁桃酸分子中碳原子的杂化类型
(2)C→D的化学方程式是
(3)
 的化学名称是
的化学名称是(4)写出由单体G通过加聚反应所得产物的结构简式
(5)G有多种同分异构体,同时满足下列条件的同分异构体有
①属于芳香族化合物,且分子中含有的环只有苯环
②能发生银镜反应和水解反应
(6)已知
 ,某兴趣小组用A为原料合成阿司匹林的前体水杨酸
,某兴趣小组用A为原料合成阿司匹林的前体水杨酸 ,请设计合成路线:
,请设计合成路线:
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】硼、铝属元素周期表IIIA短周期元素。回答下列问题:
(1)基态B原子的价电子轨道表达式为__________ ,其第一电离能比Be ________ (填“大”或“小”)。
(2)氨硼烷(NH3BH3)是最具潜力的储氢材料之一,分子中存在配位键,能体现配位键的结构式为__________ ,与氨硼烷互为等电子体的烃的分子式为__________ 。
(3)常温常压下硼酸晶体为结构层状,其二维平面结构如图所示:
硼酸的化学式为__________ ,B原子的杂化类型为_______ 。从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大:_____________________________________ 。
(4)8-羟基喹啉铝是一种黄色粉末,它是OLED中的重要发光材料及电子传输材料,其微观结构如图所示,8-羟基喹啉铝中存在的化学键为______________ 。
A.金属键 B.极性键 C.非极性键 D.配位键 E.π键
(5)金属铝晶体中原子呈面心立方紧密堆积(如上图)。该晶胞空间利用率为_________________ (用含π的代数式表示);铝的密度是2.7g•cm-3,阿伏伽德罗常数为NA,依此可计算出Al原子半径r(Al)=__________ cm.
(1)基态B原子的价电子轨道表达式为
(2)氨硼烷(NH3BH3)是最具潜力的储氢材料之一,分子中存在配位键,能体现配位键的结构式为
(3)插图 | (4)插图 | (5)插图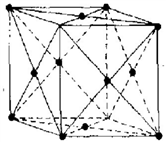 |
硼酸的化学式为
(4)8-羟基喹啉铝是一种黄色粉末,它是OLED中的重要发光材料及电子传输材料,其微观结构如图所示,8-羟基喹啉铝中存在的化学键为
A.金属键 B.极性键 C.非极性键 D.配位键 E.π键
(5)金属铝晶体中原子呈面心立方紧密堆积(如上图)。该晶胞空间利用率为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】过渡元素中,Ti 被誉为“未来金属”,其具有稳定的化学性质。回答下列问题:
(1)基态 Ti 原子的价电子轨道表达式为_______ 。
(2)基态 Ti 原子中,最高能层电子的电子云轮廓图的形状为_______ ,与 Ti 同周期的所有过渡元素的基态原子中,最外层电子数与钛不同的元素有_______ 种。
(3)过渡元素可形成许多羰基配合物,即 CO 作为配体形成的配合物。
①CO的等电子体有 、
、 、
、_______  任写一个
任写一个 等
等
②CO作配体时,配位原子是 C 而不是 O,其原因是_______ 。
(4) 是氧化法制取钛的中间产物。
是氧化法制取钛的中间产物。 分子结构与
分子结构与  相同,二者在常温下都是液体。
相同,二者在常温下都是液体。 分子的空间构型是
分子的空间构型是_______ ; 的稳定性比
的稳定性比  差,极易水解,试从结构的角度分析其原因:
差,极易水解,试从结构的角度分析其原因:_______ 。
(5)金红石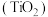 是含钛的主要矿物之一,具有典型的四方晶系结构,其晶胞结构
是含钛的主要矿物之一,具有典型的四方晶系结构,其晶胞结构 晶胞中相同位置的原子结构
晶胞中相同位置的原子结构 如图所示:
如图所示:
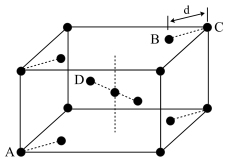
4个微粒A、B、C、D中,属于氧原子的是_______ 。
②若A、B、C 原子的坐标分别为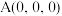 、
、 、
、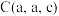 ,则D原子的坐标为
,则D原子的坐标为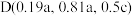 ;若晶胞底面边长为 x,则钛氧键的键长
;若晶胞底面边长为 x,则钛氧键的键长
_______ 。(用代数式表示)。
(1)基态 Ti 原子的价电子轨道表达式为
(2)基态 Ti 原子中,最高能层电子的电子云轮廓图的形状为
(3)过渡元素可形成许多羰基配合物,即 CO 作为配体形成的配合物。
①CO的等电子体有
 、
、 、
、 任写一个
任写一个 等
等②CO作配体时,配位原子是 C 而不是 O,其原因是
(4)
 是氧化法制取钛的中间产物。
是氧化法制取钛的中间产物。 分子结构与
分子结构与  相同,二者在常温下都是液体。
相同,二者在常温下都是液体。 分子的空间构型是
分子的空间构型是 的稳定性比
的稳定性比  差,极易水解,试从结构的角度分析其原因:
差,极易水解,试从结构的角度分析其原因:(5)金红石
 是含钛的主要矿物之一,具有典型的四方晶系结构,其晶胞结构
是含钛的主要矿物之一,具有典型的四方晶系结构,其晶胞结构 晶胞中相同位置的原子结构
晶胞中相同位置的原子结构 如图所示:
如图所示:
4个微粒A、B、C、D中,属于氧原子的是
②若A、B、C 原子的坐标分别为
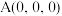 、
、 、
、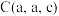 ,则D原子的坐标为
,则D原子的坐标为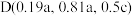 ;若晶胞底面边长为 x,则钛氧键的键长
;若晶胞底面边长为 x,则钛氧键的键长
您最近一年使用:0次
【推荐2】Ⅰ.
(1)在第二周期主族元素,第一电离能介于B和N之间的元素有______ 种。
Ⅱ.氮、磷、铁、铜、钇在现代工农业、科技及国防建设等领域中都有着广泛的应用。回答下列问题:
(2)基态磷原子核外电子共有______ 种空间运动状态。磷原子在成键时,能将一个3s电子激发进入3d能级而参与成键,写出该激发态磷原子的核外电子排布式______ 。
(3)已知偏二甲肼 、肼
、肼 均可做运载火箭的主体燃料,其熔、沸点见下表。
均可做运载火箭的主体燃料,其熔、沸点见下表。
二者熔、沸点存在差异的主要原因是____________
Ⅲ.钙钛矿类杂化材料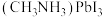 在太阳能电池领域具有重要的应用价值。
在太阳能电池领域具有重要的应用价值。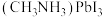 的晶胞结构如图所示,其中B代表
的晶胞结构如图所示,其中B代表 。
。
(4)代表 的为
的为______ 。(填写相应字母)
(5)原子分数坐标可用于表示晶胞内部各原子的相对位置。其中,原子分数坐标A为(0,0,0),B为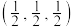 ,则C的原子分数坐标为
,则C的原子分数坐标为______ 。
(6)已知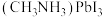 的摩尔质量为
的摩尔质量为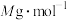 ,则该晶体的密度为
,则该晶体的密度为
______  (设
(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(1)在第二周期主族元素,第一电离能介于B和N之间的元素有
Ⅱ.氮、磷、铁、铜、钇在现代工农业、科技及国防建设等领域中都有着广泛的应用。回答下列问题:
(2)基态磷原子核外电子共有
(3)已知偏二甲肼
 、肼
、肼 均可做运载火箭的主体燃料,其熔、沸点见下表。
均可做运载火箭的主体燃料,其熔、沸点见下表。物质 | 熔点 | 沸点 |
偏二甲肼 | ﹣58℃ | 63.9℃ |
肼 | 1.4℃ | 113.5℃ |
Ⅲ.钙钛矿类杂化材料
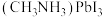 在太阳能电池领域具有重要的应用价值。
在太阳能电池领域具有重要的应用价值。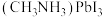 的晶胞结构如图所示,其中B代表
的晶胞结构如图所示,其中B代表 。
。
(4)代表
 的为
的为(5)原子分数坐标可用于表示晶胞内部各原子的相对位置。其中,原子分数坐标A为(0,0,0),B为
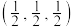 ,则C的原子分数坐标为
,则C的原子分数坐标为(6)已知
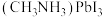 的摩尔质量为
的摩尔质量为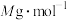 ,则该晶体的密度为
,则该晶体的密度为
 (设
(设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】硼与氮、氢能形成多种具有优良性能的化合物,受到人们的广泛关注。
Ⅰ.氨硼烷( )具有良好的储氢能力。
)具有良好的储氢能力。
(1) 分子中,与N原子相连的H呈正电性(
分子中,与N原子相连的H呈正电性(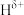 ),与B原子相连的H呈负电性(
),与B原子相连的H呈负电性(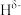 ),三种元素电负性大小顺序是
),三种元素电负性大小顺序是_______ 。
(2)其在催化剂作用下水解释放氢气: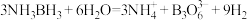 ,
,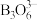 的结构为
的结构为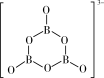 。在该反应中,B原子的杂化轨道类型的变化是
。在该反应中,B原子的杂化轨道类型的变化是_______ 。
(3)无机苯(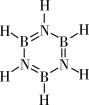 )不能形成像苯一样的离域π键,原因是
)不能形成像苯一样的离域π键,原因是_______ 。
Ⅱ.氮化硼(BN)是一种高硬度、耐高温、耐腐蚀、高绝缘性的材料。一种获得氮化硼的方法为:

(4) 被认为是有机化学上的“万能还原剂”,其中H的化合价为
被认为是有机化学上的“万能还原剂”,其中H的化合价为_______ 。
(5)硼酸的化学式为 ,硼酸产生
,硼酸产生 过程为:
过程为: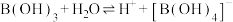 ,下列说法正确的是_______。
,下列说法正确的是_______。
(6)氮化硼(BN)晶体存在如图所示的两种结构,六方氮化硼的结构与石墨类似,立方氮化硼的结构与金刚石类似,可作研磨剂。
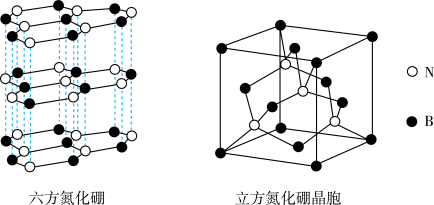
①立方氮化硼的熔点和硬度均高于SiC的原因是_______ ,已知该晶胞的密度为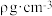 ,晶胞的边长为a cm,则阿伏加德罗常数的表达式为
,晶胞的边长为a cm,则阿伏加德罗常数的表达式为_______ 。
②六方氮化硼可做润滑剂,不导电。则六方氮化硼的晶体类型是_______ ,其中含有的微粒间作用力有_______ 。
Ⅰ.氨硼烷(
 )具有良好的储氢能力。
)具有良好的储氢能力。(1)
 分子中,与N原子相连的H呈正电性(
分子中,与N原子相连的H呈正电性(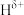 ),与B原子相连的H呈负电性(
),与B原子相连的H呈负电性(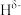 ),三种元素电负性大小顺序是
),三种元素电负性大小顺序是(2)其在催化剂作用下水解释放氢气:
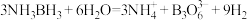 ,
,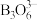 的结构为
的结构为 。在该反应中,B原子的杂化轨道类型的变化是
。在该反应中,B原子的杂化轨道类型的变化是(3)无机苯(
 )不能形成像苯一样的离域π键,原因是
)不能形成像苯一样的离域π键,原因是Ⅱ.氮化硼(BN)是一种高硬度、耐高温、耐腐蚀、高绝缘性的材料。一种获得氮化硼的方法为:

(4)
 被认为是有机化学上的“万能还原剂”,其中H的化合价为
被认为是有机化学上的“万能还原剂”,其中H的化合价为(5)硼酸的化学式为
 ,硼酸产生
,硼酸产生 过程为:
过程为: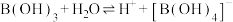 ,下列说法正确的是_______。
,下列说法正确的是_______。| A.是一元弱酸 | B.硼酸体现酸性与配位键有关 |
| C.B位于三个O构成的三角形的中心 | D.与 的反应是氧化还原反应 的反应是氧化还原反应 |

①立方氮化硼的熔点和硬度均高于SiC的原因是
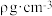 ,晶胞的边长为a cm,则阿伏加德罗常数的表达式为
,晶胞的边长为a cm,则阿伏加德罗常数的表达式为②六方氮化硼可做润滑剂,不导电。则六方氮化硼的晶体类型是
您最近一年使用:0次



