名校
1 .  、
、 、
、 、
、 、
、 是周期表前36号元素中的四种常见元素,其原子序数依次增大。
是周期表前36号元素中的四种常见元素,其原子序数依次增大。 的一种核素在考古时常用来鉴定一些文物的年代:
的一种核素在考古时常用来鉴定一些文物的年代: 的氧化物是导致酸雨的主要物质之一、
的氧化物是导致酸雨的主要物质之一、 的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭;
的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭; 的基态原子核外有6个原子轨道处于半充满状态;
的基态原子核外有6个原子轨道处于半充满状态; 能形成红色的
能形成红色的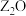 和黑色的
和黑色的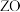 两种氧化物。
两种氧化物。
(1)基态 原子的核外电子有
原子的核外电子有___________ 种不同的运动状态,___________ 种不同能级的电子。
(2) 的空间构型是
的空间构型是___________ 。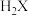 分子的价层电子对互斥模型名称为
分子的价层电子对互斥模型名称为___________ 。
(3)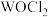 俗称光气,分子中
俗称光气,分子中 原子采取
原子采取 杂化成键,光气分子的结构式为
杂化成键,光气分子的结构式为___________ 。其分子中 键和
键和 键的个数比为
键的个数比为___________ 。
(4) 与
与 是同族元素,
是同族元素, 原子之间可以形成双键、三键,但
原子之间可以形成双键、三键,但 原子之间难以形成双键或三键。从原子结构角度分析,原因是
原子之间难以形成双键或三键。从原子结构角度分析,原因是___________ 。
(5)向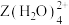 的溶液通入
的溶液通入 ,会生成
,会生成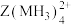 的原因是
的原因是___________ 。(从电负性的角度解释)
 、
、 、
、 、
、 、
、 是周期表前36号元素中的四种常见元素,其原子序数依次增大。
是周期表前36号元素中的四种常见元素,其原子序数依次增大。 的一种核素在考古时常用来鉴定一些文物的年代:
的一种核素在考古时常用来鉴定一些文物的年代: 的氧化物是导致酸雨的主要物质之一、
的氧化物是导致酸雨的主要物质之一、 的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭;
的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭; 的基态原子核外有6个原子轨道处于半充满状态;
的基态原子核外有6个原子轨道处于半充满状态; 能形成红色的
能形成红色的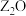 和黑色的
和黑色的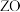 两种氧化物。
两种氧化物。(1)基态
 原子的核外电子有
原子的核外电子有(2)
 的空间构型是
的空间构型是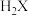 分子的价层电子对互斥模型名称为
分子的价层电子对互斥模型名称为(3)
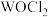 俗称光气,分子中
俗称光气,分子中 原子采取
原子采取 杂化成键,光气分子的结构式为
杂化成键,光气分子的结构式为 键和
键和 键的个数比为
键的个数比为(4)
 与
与 是同族元素,
是同族元素, 原子之间可以形成双键、三键,但
原子之间可以形成双键、三键,但 原子之间难以形成双键或三键。从原子结构角度分析,原因是
原子之间难以形成双键或三键。从原子结构角度分析,原因是(5)向
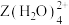 的溶液通入
的溶液通入 ,会生成
,会生成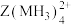 的原因是
的原因是
您最近一年使用:0次
名校
2 . 过渡元素镍(Ni)、铬(Cr)都是重要的合金元素,他们的配合物在科技生活中都有很重要的应用,例如我国科学家合成铬的化合物通过烷基铝和[ph3C]+[B(C6F5)4]-活化后,对乙烯聚合表现出较好的催化活性。合成铬的化合物过程中的一步反应为:

回答下列问题:
(1)Cr3+价电子核外电子排布式为______ ,分子甲中除铬外其他元素的电负性由大到小依次为______ (填元素符号)。
(2)一定条件下环戊二烯 可转化为
可转化为 ,在这个过程中C原子的杂化方式变化为由sp3变为
,在这个过程中C原子的杂化方式变化为由sp3变为_____ , 中大π键可表示为
中大π键可表示为_____ 。
(3)化合物丙中1、2、3、4处的化学键是配位键的是_______ 。
a.只有2 b.2、3、4 c.全部都是
(4)AsCl3也可以与铬离子形成配合物,当氯原子被烷基取代后,配位能力增强,其原因是__________ 。
(5)水在合成铬的化合物的过程中作溶剂。研究表明水能凝结成13种类型的结晶体。重冰(密度比水大)属于立方晶系,其立方晶胞沿x、y或z轴的投影图如图所示,晶体中H2O的配位数为_________ 。
(6)一种由镍、氟、钾三种元素组成的化合物晶胞结构如图所示,原子A、B之间的距离是_________ (用字母a、b、c表示),晶胞中镍的分数坐标有____ 种。


回答下列问题:
(1)Cr3+价电子核外电子排布式为
(2)一定条件下环戊二烯
 可转化为
可转化为 ,在这个过程中C原子的杂化方式变化为由sp3变为
,在这个过程中C原子的杂化方式变化为由sp3变为 中大π键可表示为
中大π键可表示为(3)化合物丙中1、2、3、4处的化学键是配位键的是
a.只有2 b.2、3、4 c.全部都是
(4)AsCl3也可以与铬离子形成配合物,当氯原子被烷基取代后,配位能力增强,其原因是
(5)水在合成铬的化合物的过程中作溶剂。研究表明水能凝结成13种类型的结晶体。重冰(密度比水大)属于立方晶系,其立方晶胞沿x、y或z轴的投影图如图所示,晶体中H2O的配位数为

(6)一种由镍、氟、钾三种元素组成的化合物晶胞结构如图所示,原子A、B之间的距离是

您最近一年使用:0次
名校
3 . Ⅰ.魔酸(Magic acid)是最早发现的超强酸,由五氟化锑( )和氟磺酸(
)和氟磺酸(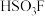 )按体积比
)按体积比 混合制成的混酸,酸性为纯硫酸的1000万倍。
混合制成的混酸,酸性为纯硫酸的1000万倍。
(1)氟磺酸(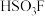 )中元素电负性由大到小的顺序为
)中元素电负性由大到小的顺序为___________ (写汉字名称)。
(2)魔酸根离子中与中心 原子配位的氟磺酸中的原子为
原子配位的氟磺酸中的原子为___________ (填元素符号)。
(3)五氟化锑( )分子中
)分子中 的杂化类型是下列中的
的杂化类型是下列中的___________ (填字母序号)。
a. b.
b. c.
c. d.
d.
Ⅱ.使用超酸可以活化碳氢化合物,如六氟合锑酸( 和
和 的物质的量比
的物质的量比 混合,酸性估计可达无水硫酸的
混合,酸性估计可达无水硫酸的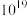 倍)溶液中对甲基环戊烷的羰基化反应。对
倍)溶液中对甲基环戊烷的羰基化反应。对 键的质子化导致失去一个氢气而生成一个碳正离子(其可能发生的重排-碳正离子可能的正电位置并未给出),加入的
键的质子化导致失去一个氢气而生成一个碳正离子(其可能发生的重排-碳正离子可能的正电位置并未给出),加入的 捕获这些碳正离子即生成稳定的酰基碳正离子,它与后处理过程中加入的乙醇发生反应生成相应的乙酯化合物如图所示(超酸中的氢离子用“
捕获这些碳正离子即生成稳定的酰基碳正离子,它与后处理过程中加入的乙醇发生反应生成相应的乙酯化合物如图所示(超酸中的氢离子用“ ”表示)。
”表示)。
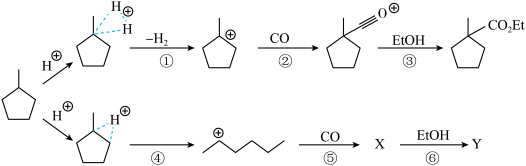
(4)“步骤①”生成的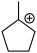 可能发生的碳正离子转移重排,写出“重排”后所得产物“乙酯化合物”的结构简式
可能发生的碳正离子转移重排,写出“重排”后所得产物“乙酯化合物”的结构简式___________ (除题给产物外任写1种)。
(5)步骤③的反应方程式为___________ 。
(6)满足下列条件的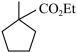 的同分异构体种类有
的同分异构体种类有___________ 种(不考虑立体异构)。
a.存在六元环状结构、且环上只有1~2个侧链
b.能发生银镜反应
c.热氢氧化钠溶液中能水解
(7)Y的系统名称为___________ 。
 )和氟磺酸(
)和氟磺酸(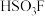 )按体积比
)按体积比 混合制成的混酸,酸性为纯硫酸的1000万倍。
混合制成的混酸,酸性为纯硫酸的1000万倍。(1)氟磺酸(
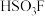 )中元素电负性由大到小的顺序为
)中元素电负性由大到小的顺序为(2)魔酸根离子中与中心
 原子配位的氟磺酸中的原子为
原子配位的氟磺酸中的原子为(3)五氟化锑(
 )分子中
)分子中 的杂化类型是下列中的
的杂化类型是下列中的a.
 b.
b. c.
c. d.
d.
Ⅱ.使用超酸可以活化碳氢化合物,如六氟合锑酸(
 和
和 的物质的量比
的物质的量比 混合,酸性估计可达无水硫酸的
混合,酸性估计可达无水硫酸的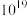 倍)溶液中对甲基环戊烷的羰基化反应。对
倍)溶液中对甲基环戊烷的羰基化反应。对 键的质子化导致失去一个氢气而生成一个碳正离子(其可能发生的重排-碳正离子可能的正电位置并未给出),加入的
键的质子化导致失去一个氢气而生成一个碳正离子(其可能发生的重排-碳正离子可能的正电位置并未给出),加入的 捕获这些碳正离子即生成稳定的酰基碳正离子,它与后处理过程中加入的乙醇发生反应生成相应的乙酯化合物如图所示(超酸中的氢离子用“
捕获这些碳正离子即生成稳定的酰基碳正离子,它与后处理过程中加入的乙醇发生反应生成相应的乙酯化合物如图所示(超酸中的氢离子用“ ”表示)。
”表示)。
(4)“步骤①”生成的
 可能发生的碳正离子转移重排,写出“重排”后所得产物“乙酯化合物”的结构简式
可能发生的碳正离子转移重排,写出“重排”后所得产物“乙酯化合物”的结构简式(5)步骤③的反应方程式为
(6)满足下列条件的
 的同分异构体种类有
的同分异构体种类有a.存在六元环状结构、且环上只有1~2个侧链
b.能发生银镜反应
c.热氢氧化钠溶液中能水解
(7)Y的系统名称为
您最近一年使用:0次
解题方法
4 . 我国化学家研究发现,十八胺在较高温度下具有一定的还原性,由于不同的金属盐从十八胺中获得电子的能力不同,在十八胺体系中反应可以得到不同的产物:当以两种非贵金属盐为原料时得到混合金属氧化物(如 等),以
等),以 和一种非贵金属盐为原料时得到金属与金属氧化物异质结构(如
和一种非贵金属盐为原料时得到金属与金属氧化物异质结构(如 等),除
等),除 之外的其他贵金属盐和一种非贵金属盐为原料时得到合金或金属间化合物(如
之外的其他贵金属盐和一种非贵金属盐为原料时得到合金或金属间化合物(如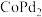 等)。
等)。
回答下列问题:
(1)十八胺中含有氮元素,含氮元素的三种离子 的键角由大到小的顺序是
的键角由大到小的顺序是___________ 。
(2) 与
与 相比,第二电离能与第一电离能差值更大的是
相比,第二电离能与第一电离能差值更大的是___________ 。
(3)以 和钴盐为原料时得到的产物
和钴盐为原料时得到的产物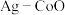 而非
而非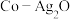 的原因是
的原因是___________ 。
(4)推测 盐和一种非贵金属盐混合后在十八胺体系中发生反应所得产物类别为
盐和一种非贵金属盐混合后在十八胺体系中发生反应所得产物类别为___________ 。
(5)一种含钴的离子结构如图所示: 的价电子轨道表示式是
的价电子轨道表示式是___________ 。已知磁矩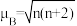 (n表示未成对电子数),则
(n表示未成对电子数),则 的磁矩
的磁矩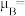
___________ 。
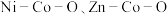 等),以
等),以 和一种非贵金属盐为原料时得到金属与金属氧化物异质结构(如
和一种非贵金属盐为原料时得到金属与金属氧化物异质结构(如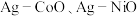 等),除
等),除 之外的其他贵金属盐和一种非贵金属盐为原料时得到合金或金属间化合物(如
之外的其他贵金属盐和一种非贵金属盐为原料时得到合金或金属间化合物(如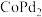 等)。
等)。
| 元素 |  |  |  |  |  |  |  |
| 电负性(鲍林标度) | 1.6 | 1.8 | 1.8 | 1.9 | 2.2 | 2.2 | 2.4 |
(1)十八胺中含有氮元素,含氮元素的三种离子
 的键角由大到小的顺序是
的键角由大到小的顺序是(2)
 与
与 相比,第二电离能与第一电离能差值更大的是
相比,第二电离能与第一电离能差值更大的是(3)以
 和钴盐为原料时得到的产物
和钴盐为原料时得到的产物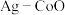 而非
而非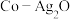 的原因是
的原因是(4)推测
 盐和一种非贵金属盐混合后在十八胺体系中发生反应所得产物类别为
盐和一种非贵金属盐混合后在十八胺体系中发生反应所得产物类别为(5)一种含钴的离子结构如图所示:
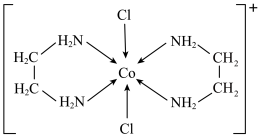
 的价电子轨道表示式是
的价电子轨道表示式是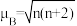 (n表示未成对电子数),则
(n表示未成对电子数),则 的磁矩
的磁矩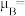
您最近一年使用:0次
真题
解题方法
5 . 三氯甲硅烷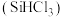 是制取高纯硅的重要原料,常温下为无色液体,沸点为
是制取高纯硅的重要原料,常温下为无色液体,沸点为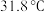 ,熔点为
,熔点为 ,易水解。实验室根据反应
,易水解。实验室根据反应 ,利用如下装置制备
,利用如下装置制备 粗品(加热及夹持装置略)。回答下列问题:
粗品(加热及夹持装置略)。回答下列问题:
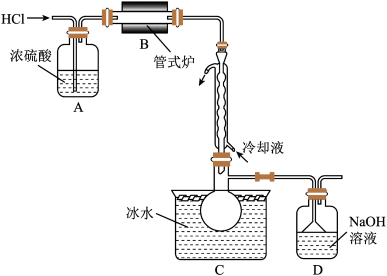
(1)制备 时进行操作:(ⅰ)……;(ⅱ)将盛有硅粉的瓷舟置于管式炉中;(ⅲ)通入
时进行操作:(ⅰ)……;(ⅱ)将盛有硅粉的瓷舟置于管式炉中;(ⅲ)通入 ,一段时间后接通冷凝装置,加热开始反应。操作(ⅰ)为
,一段时间后接通冷凝装置,加热开始反应。操作(ⅰ)为_____ ;判断制备反应结束的实验现象是_____ 。图示装置存在的两处缺陷是_____ 。
(2)已知电负性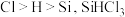 在浓
在浓 溶液中发生反应的化学方程式为
溶液中发生反应的化学方程式为_____ 。
(3)采用如下方法测定溶有少量 的
的 纯度。
纯度。
 样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:①
样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:①_____ ,②_____ (填操作名称),③称量等操作,测得所得固体氧化物质量为 ,从下列仪器中选出①、②中需使用的仪器,依次为
,从下列仪器中选出①、②中需使用的仪器,依次为_____ (填标号)。测得样品纯度为_____ (用含 、
、 的代数式表示)。
的代数式表示)。

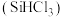 是制取高纯硅的重要原料,常温下为无色液体,沸点为
是制取高纯硅的重要原料,常温下为无色液体,沸点为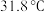 ,熔点为
,熔点为 ,易水解。实验室根据反应
,易水解。实验室根据反应 ,利用如下装置制备
,利用如下装置制备 粗品(加热及夹持装置略)。回答下列问题:
粗品(加热及夹持装置略)。回答下列问题:
(1)制备
 时进行操作:(ⅰ)……;(ⅱ)将盛有硅粉的瓷舟置于管式炉中;(ⅲ)通入
时进行操作:(ⅰ)……;(ⅱ)将盛有硅粉的瓷舟置于管式炉中;(ⅲ)通入 ,一段时间后接通冷凝装置,加热开始反应。操作(ⅰ)为
,一段时间后接通冷凝装置,加热开始反应。操作(ⅰ)为(2)已知电负性
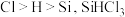 在浓
在浓 溶液中发生反应的化学方程式为
溶液中发生反应的化学方程式为(3)采用如下方法测定溶有少量
 的
的 纯度。
纯度。 样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:①
样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:① ,从下列仪器中选出①、②中需使用的仪器,依次为
,从下列仪器中选出①、②中需使用的仪器,依次为 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2023-06-19更新
|
10814次组卷
|
16卷引用:2023年高考山东卷化学真题
2023年高考山东卷化学真题(已下线)2023年高考山东卷化学真题变式题(实验综合题)(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)考点12 硅及其无机非金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第10讲 硅及其化合物(已下线)T26-工业流程题(已下线)专题15 化学实验综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点13 硅及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点46 定量分析实验(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)题型17 化学实验综合-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)2024届河北省实验中学高三年级上学期第一次月考化学试题
解题方法
6 .  是高温超导或非常规超导物理中的重要角色,同时还是很好的催化材料。回答下列问题:
是高温超导或非常规超导物理中的重要角色,同时还是很好的催化材料。回答下列问题:
(1) 与铁在元素周期表中是同列相邻元素且最外层有一个未成对电子,其价电子排布式为
与铁在元素周期表中是同列相邻元素且最外层有一个未成对电子,其价电子排布式为___________ 。
(2) 可形成
可形成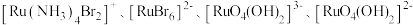 四种配离子且配离子中不存在非极性键,其中
四种配离子且配离子中不存在非极性键,其中 离子半径最小的配离子是
离子半径最小的配离子是___________ ,具有对称结构的 中
中 为
为___________ 。图1中通过螯合作用形成配位键的N原子的杂化方式为___________ , 离子配体中N原子与中心
离子配体中N原子与中心 离子配位的原因是
离子配位的原因是___________ 。

(3) 的晶体结构如图2所示。
的晶体结构如图2所示。
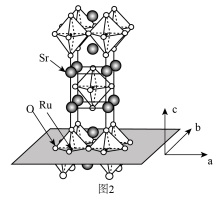
① 和
和 的电负性:
的电负性:
___________  (填“大于”“小于”或“等于”),基态O原子电子占据最高能级的电子云轮廓图为
(填“大于”“小于”或“等于”),基态O原子电子占据最高能级的电子云轮廓图为___________ 形。
②用 表示阿伏伽德罗常数的值,晶胞参数为
表示阿伏伽德罗常数的值,晶胞参数为 ,
, ,则其密度为
,则其密度为___________  (列出计算式即可)。
(列出计算式即可)。
 是高温超导或非常规超导物理中的重要角色,同时还是很好的催化材料。回答下列问题:
是高温超导或非常规超导物理中的重要角色,同时还是很好的催化材料。回答下列问题:(1)
 与铁在元素周期表中是同列相邻元素且最外层有一个未成对电子,其价电子排布式为
与铁在元素周期表中是同列相邻元素且最外层有一个未成对电子,其价电子排布式为(2)
 可形成
可形成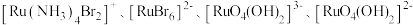 四种配离子且配离子中不存在非极性键,其中
四种配离子且配离子中不存在非极性键,其中 离子半径最小的配离子是
离子半径最小的配离子是 中
中 为
为 离子配体中N原子与中心
离子配体中N原子与中心 离子配位的原因是
离子配位的原因是
(3)
 的晶体结构如图2所示。
的晶体结构如图2所示。
①
 和
和 的电负性:
的电负性:
 (填“大于”“小于”或“等于”),基态O原子电子占据最高能级的电子云轮廓图为
(填“大于”“小于”或“等于”),基态O原子电子占据最高能级的电子云轮廓图为②用
 表示阿伏伽德罗常数的值,晶胞参数为
表示阿伏伽德罗常数的值,晶胞参数为 ,
, ,则其密度为
,则其密度为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
解题方法
7 . Fe为重要的元素,与C、N、O等组成的化合物有广泛的用途。回答下列问题:
(1)甘氨酸亚铁络合物[ ]是一种新型的铁营养强化剂。
]是一种新型的铁营养强化剂。
① 中含有的第二周期元素的第一电离能由大到小的顺序为
中含有的第二周期元素的第一电离能由大到小的顺序为___________ 。
②甘氨酸( )的沸点比相近相对分子质量的烷烃高很多,原因是
)的沸点比相近相对分子质量的烷烃高很多,原因是___________ 。
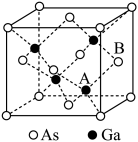
II.砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池等,回答下列问题:
(2)基态Ga原子的核外电子排布式为[Ar]___________ 。
(3)根据元素周期律,元素的电负性Ga___________ (填“大于”或“小于”)As。
(4)杀虫剂Na3AsO4中As原子采取___________ 杂化。
(5)共价晶体GaAs的晶胞参数a=xpm,它的晶胞结构如图所示,该晶体的密度为___________ (列出计算式,阿伏加德罗常数的值用NA表示) 。
。
(1)甘氨酸亚铁络合物[
 ]是一种新型的铁营养强化剂。
]是一种新型的铁营养强化剂。①
 中含有的第二周期元素的第一电离能由大到小的顺序为
中含有的第二周期元素的第一电离能由大到小的顺序为②甘氨酸(
 )的沸点比相近相对分子质量的烷烃高很多,原因是
)的沸点比相近相对分子质量的烷烃高很多,原因是II.砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池等,回答下列问题:
(2)基态Ga原子的核外电子排布式为[Ar]
(3)根据元素周期律,元素的电负性Ga
(4)杀虫剂Na3AsO4中As原子采取
(5)共价晶体GaAs的晶胞参数a=xpm,它的晶胞结构如图所示,该晶体的密度为
 。
。
您最近一年使用:0次
解题方法
8 . 金属锂溶于液氨可得到具有高反应活性的金属电子溶液, 与其作用可制得超导体
与其作用可制得超导体 ,进一步可制得超导材料
,进一步可制得超导材料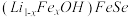 。
。
回答下列问题:
(1)与Fe元素同周期,基态原子有2个未成对电子的金属元素有______ 种,下列状态的铁中,电离最外层一个电子所需能量最大的是______ (填标号)
A. B.
B. C.
C.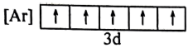 D.
D.
(2)液氨可以发生微弱的电离生成 和
和 ,下列说法错误的是
,下列说法错误的是________
(3)Fe2+可与邻二氮菲形成红色配合物,结构如图所示。元素的电负性从大到小的顺序为______ (填元素符号)。配合物中N原子的VSEPR模型为____________ ;下列对Fe杂化方式推断合理的是______ (填标号)。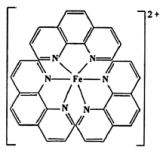
A. B.
B. C.
C. D.
D.
(4)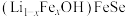 晶体属四方晶系,其结构由铁硒层和锂铁氢氧层交替堆垛而成,晶胞中铁硒层在bc、ac和ab平面投影如图所示。铁硒层中Fe原子的配位数是
晶体属四方晶系,其结构由铁硒层和锂铁氢氧层交替堆垛而成,晶胞中铁硒层在bc、ac和ab平面投影如图所示。铁硒层中Fe原子的配位数是______ ,铁硒层和锂铁氢氧层之间由极其微弱的氢键相连,该氢键可表示为______ 。已知锂铁氢氧层中锂铁个数之比为4∶1,阿伏加德罗常数的值为 ,则该晶体的密度为
,则该晶体的密度为______ g·cm 。
。

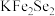 与其作用可制得超导体
与其作用可制得超导体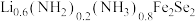 ,进一步可制得超导材料
,进一步可制得超导材料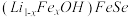 。
。回答下列问题:
(1)与Fe元素同周期,基态原子有2个未成对电子的金属元素有
A.
 B.
B. C.
C. D.
D.
(2)液氨可以发生微弱的电离生成
 和
和 ,下列说法错误的是
,下列说法错误的是A.键角: | B.结合质子能力: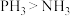 |
C.热稳定性: | D. 与 与 的分子构型及N的化合价均相同 的分子构型及N的化合价均相同 |

A.
 B.
B. C.
C. D.
D.
(4)
 晶体属四方晶系,其结构由铁硒层和锂铁氢氧层交替堆垛而成,晶胞中铁硒层在bc、ac和ab平面投影如图所示。铁硒层中Fe原子的配位数是
晶体属四方晶系,其结构由铁硒层和锂铁氢氧层交替堆垛而成,晶胞中铁硒层在bc、ac和ab平面投影如图所示。铁硒层中Fe原子的配位数是 ,则该晶体的密度为
,则该晶体的密度为 。
。
您最近一年使用:0次
名校
解题方法
9 . X、Y、Z、Q是原子序数依次增大的前四周期元素,其中X是宇宙中含量最多的元素;Y元素基态原子的价层电子排布是 ;Z、Q元素原子的最外层均只有1个电子,Z元素原子中只有两种形状的电子云,Q元素基态原子内层轨道均排满电子。下列说法正确的是
;Z、Q元素原子的最外层均只有1个电子,Z元素原子中只有两种形状的电子云,Q元素基态原子内层轨道均排满电子。下列说法正确的是
 ;Z、Q元素原子的最外层均只有1个电子,Z元素原子中只有两种形状的电子云,Q元素基态原子内层轨道均排满电子。下列说法正确的是
;Z、Q元素原子的最外层均只有1个电子,Z元素原子中只有两种形状的电子云,Q元素基态原子内层轨道均排满电子。下列说法正确的是A.电负性: | B.ZX属于共价化合物 |
C. 的阴阳离子数之比为1:1 的阴阳离子数之比为1:1 | D.Q元素位于元素周期表的ds区 |
您最近一年使用:0次
2023-05-05更新
|
590次组卷
|
3卷引用:山东省烟台市龙口某校2023-2024学年高二上学期12月月考化学试题
山东省烟台市龙口某校2023-2024学年高二上学期12月月考化学试题福建省三明市2022-2023学年普通高中高三下学期5月份质量检测化学试题(已下线)第06练 元素“位—构—性”的综合推断 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)
名校
解题方法
10 . 铁的配合物在生产、生活中有重要应用,某种铁的配合物结构如图所示,下列说法正确的是
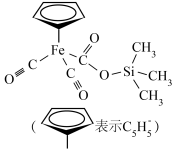

| A.基态硅原子最高能级轨道形状为球形 |
| B.该配合物中元素的电负性最大的是氧 |
| C.该配合物中碳原子的杂化方式有3种 |
| D.基态铁原子核外电子有26种空间运动状态 |
您最近一年使用:0次
2023-05-03更新
|
180次组卷
|
2卷引用:山东省青岛市西海岸新区2022-2023学年高一下学期期中考试化学试题



