解题方法
1 . 铂(Pt)及其化合物用途广泛。
(1)在元素周期表中,铂元素与铁元素同族,则铂元素位于______ 。
A.s区 B.p区 C.d区 D.ds区 E.f区
(2)二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,有顺式和反式两种同分异构体。科学研究表明,反式分子和顺式分子一样具有抗癌活性。
①Cl-的最外层电子排布式为______ 。
②吡啶分子是大体积平面配体,其结构简式如图所示,该配体的配位原子是___ 。吡啶分子中,碳、氮原子的轨道杂化方式分别是____ 、_____ ,各元素的电负性由大到小的顺序为____ 。
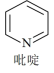
③二氯二吡啶合铂分子中存在的微粒间作用力有___  填序号
填序号 。
。
a.离子键 b.配位键 c.金属键 d.非极性键 e.氢键
④反式二氯二吡啶合铂分子结构如图所示,该分子是___ 分子 选填“极性”、“非极性”
选填“极性”、“非极性” 。
。

(3)已知金属铂的密度为d g/cm3,NA代表阿伏加德罗常数的值,金属铂的相对原子质量为 M。如图分别表示金属铂原子的堆积方式、晶胞特征,则金属铂的堆积方式为____ , 晶胞参数a =_____ nm (列出计算式即可)。

(1)在元素周期表中,铂元素与铁元素同族,则铂元素位于
A.s区 B.p区 C.d区 D.ds区 E.f区
(2)二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,有顺式和反式两种同分异构体。科学研究表明,反式分子和顺式分子一样具有抗癌活性。
①Cl-的最外层电子排布式为
②吡啶分子是大体积平面配体,其结构简式如图所示,该配体的配位原子是

③二氯二吡啶合铂分子中存在的微粒间作用力有
 填序号
填序号 。
。a.离子键 b.配位键 c.金属键 d.非极性键 e.氢键
④反式二氯二吡啶合铂分子结构如图所示,该分子是
 选填“极性”、“非极性”
选填“极性”、“非极性” 。
。
(3)已知金属铂的密度为d g/cm3,NA代表阿伏加德罗常数的值,金属铂的相对原子质量为 M。如图分别表示金属铂原子的堆积方式、晶胞特征,则金属铂的堆积方式为

您最近一年使用:0次
2020-11-15更新
|
330次组卷
|
2卷引用:陕西省宝鸡市金台区2021届高三11月检测理综化学试题
名校
解题方法
2 . 硼及其化合物广泛应用于高新材料领域,请回答下列有关问题:
(1)NaBH4是一种重要的储氢载体,其中涉及元素的电负性由大到小的顺序为______ 。
(2)硼氮苯被称为无机苯,其结构如图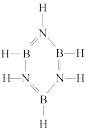 ,分子中氮原子的杂化方式是
,分子中氮原子的杂化方式是___________ 。已知硼氮苯分子在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“大π键”,该“大π键”可表示为__________ (用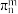 表示,其中n表示参与形成大π键的原子数,m表示形成大π键的电子数)。
表示,其中n表示参与形成大π键的原子数,m表示形成大π键的电子数)。
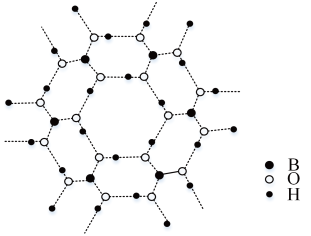
(3)硼酸(H3BO3)为白色片状晶体,有与石墨相似的层状结构,则硼酸晶体中存在的作用力有共价键、_______ 。
(4)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。
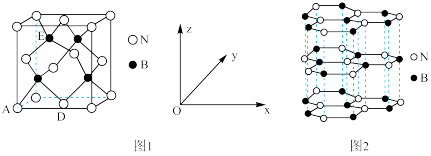
①晶胞中的原子坐标参数可表示晶胞内部各原子的相对位置。图1中原子坐标参数A为(0,0,0),D为( ,
, ,0),则E原子的坐标参数为
,0),则E原子的坐标参数为___________ 。X-射线衍射实验测得立方氮化硼晶胞边长为a pm,则立方氮化硼晶体中N与B的原子半径之和为________ pm(用含a的式子表示)。
②已知六方氮化硼同层中B-N距离为145 pm,层与层之间距离为333 pm,则晶体密度的计算式为_________ g·cm-3。(已知正六边形面积为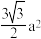 ,a为边长,NA表示阿伏加 德罗常数)
,a为边长,NA表示阿伏加 德罗常数)
(1)NaBH4是一种重要的储氢载体,其中涉及元素的电负性由大到小的顺序为
(2)硼氮苯被称为无机苯,其结构如图
 ,分子中氮原子的杂化方式是
,分子中氮原子的杂化方式是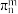 表示,其中n表示参与形成大π键的原子数,m表示形成大π键的电子数)。
表示,其中n表示参与形成大π键的原子数,m表示形成大π键的电子数)。(3)硼酸(H3BO3)为白色片状晶体,有与石墨相似的层状结构,则硼酸晶体中存在的作用力有共价键、
(4)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,主要结构有立方氮化硼(如图1)和六方氮化硼(如图2),前者类似于金刚石,后者与石墨相似。

①晶胞中的原子坐标参数可表示晶胞内部各原子的相对位置。图1中原子坐标参数A为(0,0,0),D为(
 ,
, ,0),则E原子的坐标参数为
,0),则E原子的坐标参数为②已知六方氮化硼同层中B-N距离为145 pm,层与层之间距离为333 pm,则晶体密度的计算式为
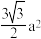 ,a为边长,NA表示阿伏加 德罗常数)
,a为边长,NA表示阿伏加 德罗常数)
您最近一年使用:0次
2020-08-03更新
|
288次组卷
|
3卷引用:山东省菏泽市2019-2020学年高二下学期期中考试化学试题(B)
名校
解题方法
3 . 铁氧体是一种磁性材料,具有广泛的应用。
(1)铁元素位于元素周期表的_________ 区,其基态原子有___________ 种能量不同的电子。
(2)工业制备铁氧体常使用水解法,制备时常加入尿素[CO(NH)2]2、醋酸钠等碱性物质,尿素分子中四种不同元素的电负性由大到小的顺序是________ ,醋酸钠中碳原子的杂化类型是_______ 。
(3)纳米氧化铁能催化火箭推进剂NH4ClO4的分解, 的结构式为
的结构式为___________ (标出配位键),与 互为等电子体的分子有
互为等电子体的分子有____________ (任写一种)。铵盐大多不稳定,NH4F、NH4I中,较易分解的是_______________ 。
(4)晶体Fe3O4的晶胞如图所示,该晶体是一种磁性材料,能导电。
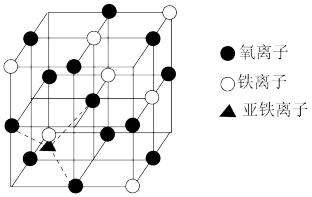
①晶胞中亚铁离子处于氧离子围成的_______________ (填空间结构)空隙。
②晶胞中氧离子的堆积方式与某金属晶体原子堆积方式相同,该堆积方式名称为______ 。
③解释Fe3O4晶体能导电的原因_________ ;若晶胞的体对角线长为a nm,则Fe3O4晶体的密度为_____________ g·cm-3(阿伏加 德罗常数用NA表示)。
(1)铁元素位于元素周期表的
(2)工业制备铁氧体常使用水解法,制备时常加入尿素[CO(NH)2]2、醋酸钠等碱性物质,尿素分子中四种不同元素的电负性由大到小的顺序是
(3)纳米氧化铁能催化火箭推进剂NH4ClO4的分解,
 的结构式为
的结构式为 互为等电子体的分子有
互为等电子体的分子有(4)晶体Fe3O4的晶胞如图所示,该晶体是一种磁性材料,能导电。

①晶胞中亚铁离子处于氧离子围成的
②晶胞中氧离子的堆积方式与某金属晶体原子堆积方式相同,该堆积方式名称为
③解释Fe3O4晶体能导电的原因
您最近一年使用:0次
2020-07-02更新
|
231次组卷
|
3卷引用:山东省实验中学2020届高三下学期打靶模拟考试化学试题
山东省实验中学2020届高三下学期打靶模拟考试化学试题(已下线)第18周 晚练题-备战2022年高考化学周测与晚练(新高考专用)广东省韶关市北江中等职业学校等九校 2021-2022学年高三上学期11月联考化学试题
名校
解题方法
4 . 非线性光学晶体在信息、激光技术、医疗、国防等领域具有重要应用价值。我国科学家利用Cs2CO3、XO2(X=Si、Ge)和H3BO3首次合成了组成为CsXB3O7的非线性光学晶体。回答下列问题:
(1)C、O、Si三种元素电负性由大到小的顺序为__ ;第一电离能I1(Si)__ I1(Ge)(填>或<)。
(2)基态Ge原子核外电子排布式为__ ;SiO2、GeO2具有类似的晶体结构,其中熔点较高的是__ 。
(3)如图为H3BO3晶体的片层结构,其中B的杂化方式为__ ;硼酸在热水中比在冷水中溶解度显著增大的主要原因是__ 。
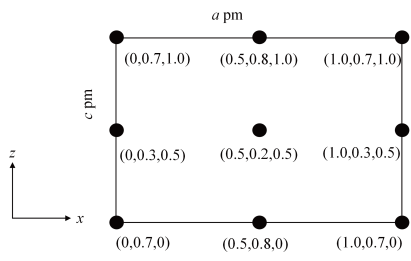
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。CsSiB3O7属正交晶系(长方体形),晶胞参数为apm、bpm和cpm。如图为沿y轴投影的晶胞中所有Cs原子的分布图和原子分数坐标。据此推断该晶胞中Cs原子的数目为__ ;CsSiB3O7的摩尔质量为Mg.mol-1,设NA为阿伏加 德罗常数的值,则CsSiB3O7晶体的密度为__ g·cm-3(用代数式表示)。
(1)C、O、Si三种元素电负性由大到小的顺序为
(2)基态Ge原子核外电子排布式为
(3)如图为H3BO3晶体的片层结构,其中B的杂化方式为

(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。CsSiB3O7属正交晶系(长方体形),晶胞参数为apm、bpm和cpm。如图为沿y轴投影的晶胞中所有Cs原子的分布图和原子分数坐标。据此推断该晶胞中Cs原子的数目为

您最近一年使用:0次
2020-03-12更新
|
380次组卷
|
12卷引用:山东省2020年普通高中学业水平等级考试模拟试题
山东省2020年普通高中学业水平等级考试模拟试题【省级联考】山东省2020届新高考模拟统考化学试题山东省菏泽市菏泽第一中学2020届高三下学期在线考试化学试题江苏省徐州一中2019-2020学年高二上学期期末调研测试化学试题河南省洛阳市2020届高三上学期期末模拟考试化学试题(已下线)考点14 物质结构与性质(选考)-2020年高考化学命题预测与模拟试题分类精编(已下线)专题讲座(十一) 晶胞参数、坐标参数的分析与应用(精讲)-2021年高考化学一轮复习讲练测广东省河源中学2021届高三上学期第二次质量检测化学试题(已下线)押山东卷第17题 物质结构与性质综合题-备战2021年高考化学临考题号押题(山东卷)(鲁科版2019)选择性必修2 第3章 不同聚集状态的物质与性质 章末综合检测卷广东省深圳市龙岗区2020-2021学年高三第一次调研考试化学试题(已下线)押新高考卷15题 物质结构与性质综合题-备战2022年高考化学临考题号押题(新高考通版)
名校
解题方法
5 . 镧系为元素周期表中第ⅢB族、原子序数为57〜71的元素。
(1)镝Dy)的基态原子电子排布式为[Xe] 4f106s2,画出镝(Dy)原子价层电子排布图:____________ .
(2)高温超导材料镧钡铜氧化物中含有Cu3+,基态时Cu3+的电子排布式为____________ 。
(3)观察下面四种镧系元素的电离能数据,判断最有可能显示+3价的元素是_____ 填元素名称)。
几种镧系元素的电离能(单位:kJ∙mol-1)
(4)元素铈(Ce)可以形成配合物(NH4)2[Ce(NO3)6]。
①组成配合物的四种元素,电负性由大到小的顺序为_______ (用元素符号表示)。
②画出氨的最简单气态氢化物水溶液中存在的氢键:________ (任写一种)。
③元素Al也有类似成键情况,气态氯化铝分子表示为((AlCl3)2,分子中A1原子杂化方式为_____ ,分子中所含化学键类型有 _______ (填字母)。
a.离子键 b.极性键 c.非极性键 d.配位键
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中错原子位于面心和顶点,则PrO2 (二氧化镨)的晶胞中有_____ 个氧原子;已知晶胞参数为apm,密度为ρg∙cm-3,NA=_______ (用含a、ρ的代数式表示)。
(1)镝Dy)的基态原子电子排布式为[Xe] 4f106s2,画出镝(Dy)原子价层电子排布图:
(2)高温超导材料镧钡铜氧化物中含有Cu3+,基态时Cu3+的电子排布式为
(3)观察下面四种镧系元素的电离能数据,判断最有可能显示+3价的元素是
几种镧系元素的电离能(单位:kJ∙mol-1)
| 元素 | Ⅰ1 | Ⅰ2 | Ⅰ3 | Ⅰ4 |
| Yb (镱) | 604 | 1217 | 4494 | 5014 |
| Lu (镥) | 532 | 1390 | 4111 | 4987 |
| La (镧) | 538 | 1067 | 1850 | 5419 |
| Ce (铈) | 527 | 1047 | 1949 | 3547 |
(4)元素铈(Ce)可以形成配合物(NH4)2[Ce(NO3)6]。
①组成配合物的四种元素,电负性由大到小的顺序为
②画出氨的最简单气态氢化物水溶液中存在的氢键:
③元素Al也有类似成键情况,气态氯化铝分子表示为((AlCl3)2,分子中A1原子杂化方式为
a.离子键 b.极性键 c.非极性键 d.配位键
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中错原子位于面心和顶点,则PrO2 (二氧化镨)的晶胞中有
您最近一年使用:0次
2019-12-01更新
|
308次组卷
|
8卷引用:山东省2020届普通高中学业水平等级考试 · 模拟卷(三)化学试题
解题方法
6 . 氧、硫形成的化合物种类繁多,日常生活中应用广泛。如硫代硫酸钠(Na2S2O3)可作为照相业的定影剂,反应的化学方程式如下:AgBr+2Na2S2O3=Na3[Ag(S2O3)2]+NaBr。回答下列问题:
(1)已知银(Ag)位于元素周期表第五周期,与Cu同族,则基态Ag的价电子排布式为____________ 。
(2)下列关于物质结构与性质的说法,正确的是_________
A.玻尔原子结构模型能够成功地解释各种原子光谱
B.Br、S、O三种元素的电负性顺序为 O>Br>S
C.Na 的第一电离能小于 Mg,但其第二电离能却远大于 Mg
D.水分子间存在氢键,故H2O的熔沸点及稳定性均大于H2S
(3)依据VSEPR理论推测S2O32-的空间构型为_______________________ ,中心原子S的杂化方式为_____ ,[Ag(S2O3)2]3-中存在的化学键有______________ (填字母序号)。
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键
(4)第一电子亲和能(E1)是指元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量(单位为kJ·mol-1),电子亲和能越大,该元素原子越易得电子。已知第三周期部分元素第一电子亲和能如下表:
表中元素的E1自左而右呈增大趋势,试分析P元素呈现异常的原因__________ 。
(5)某种离子型铁的氧化物晶胞如下图所示,它由A、B组成。则该氧化物的化学式为:________ ,已知该晶体的晶胞参数为anm,阿伏伽德罗常数的值为NA,则密度ρ为____________ g·cm-3(用含a和NA 的代数式表示)。

(1)已知银(Ag)位于元素周期表第五周期,与Cu同族,则基态Ag的价电子排布式为
(2)下列关于物质结构与性质的说法,正确的是
A.玻尔原子结构模型能够成功地解释各种原子光谱
B.Br、S、O三种元素的电负性顺序为 O>Br>S
C.Na 的第一电离能小于 Mg,但其第二电离能却远大于 Mg
D.水分子间存在氢键,故H2O的熔沸点及稳定性均大于H2S
(3)依据VSEPR理论推测S2O32-的空间构型为
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键
(4)第一电子亲和能(E1)是指元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量(单位为kJ·mol-1),电子亲和能越大,该元素原子越易得电子。已知第三周期部分元素第一电子亲和能如下表:
| 元素 | Al | Si | P | S | Cl |
| E1(kJ·mol-1) | 42.5 | 134 | 72.0 | 200 | 349 |
表中元素的E1自左而右呈增大趋势,试分析P元素呈现异常的原因
(5)某种离子型铁的氧化物晶胞如下图所示,它由A、B组成。则该氧化物的化学式为:

您最近一年使用:0次
名校
7 . 含氮、磷化合物在生活和生产中有许多重要用途,如:(CH3)3N、磷化硼(BP)、磷青铜(Cu3SnP)等。
回答下列问题:
(1)锡(Sn)是第五周期ⅣA元素。基态锡原子的价电子排布式为_________ ,据此推测,锡的最高正价是_________ 。
(2)与P同周期的主族元素中,电负性比P小的元素有____ 种 ,第一电离能比P大有____ 种。
(3)PH3分子的空间构型为___________ 。PH3的键角小于NH3的原因是__________ 。
(4)化合物(CH3)3N能溶于水,试解析其原因____________ 。
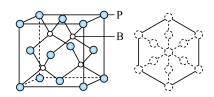
(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图所示:
①在一个晶胞中磷原子空间堆积方式为________ ,磷原子的配位数为________ 。
②已知晶胞边长a pm,阿伏伽德罗常数为NA。则磷化硼晶体的密度为______ g/cm3。
③磷化硼晶胞沿着体对角线方向的投影如图,请将表示B原子的圆圈涂黑________ 。
回答下列问题:
(1)锡(Sn)是第五周期ⅣA元素。基态锡原子的价电子排布式为
(2)与P同周期的主族元素中,电负性比P小的元素有
(3)PH3分子的空间构型为
(4)化合物(CH3)3N能溶于水,试解析其原因

(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图所示:
①在一个晶胞中磷原子空间堆积方式为
②已知晶胞边长a pm,阿伏伽德罗常数为NA。则磷化硼晶体的密度为
③磷化硼晶胞沿着体对角线方向的投影如图,请将表示B原子的圆圈涂黑
您最近一年使用:0次
2019-02-13更新
|
2516次组卷
|
8卷引用:【市级联考】山东省泰安市2019届高三下学期二轮模拟考试理科综合化学试题
【市级联考】山东省泰安市2019届高三下学期二轮模拟考试理科综合化学试题【市级联考】四川省攀枝花市2019届高三上学期第二次统考化学试题江西省上饶市2020届第一次高考模拟考试理科综合化学试题2020年全国卷Ⅰ理综化学高考真题变式题(已下线)2020年海南卷化学高考真题变式题15-19解题达人.化学选择题(2021全国卷)精编特训06(已下线)2021年高考全国甲卷化学试题变式题河南省驻马店市新蔡县第一高级中学2021-2022学年高二下学期7月份月考化学试题
10-11高三上·山东潍坊·阶段练习
解题方法
8 . 下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
试回答下列问题:
(1)元素p为26号元素,请写出其基态原子电子排布式_________________ 。
(2)d与a反应的产物的分子中中心原子的杂化形式为___________________ 。
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:__________________________________ 。
(4)o、p两元素的部分电离能数据列于表:
比较两元素的I2、I3可知,气态o2+再失去一个电子比气p2+再失去一个电子。对此,你的解释是______________________________ 。
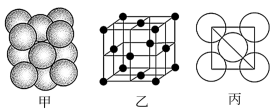
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示,则晶胞中i原子的配位数为_____________ 。
(6)元素a、c、e可形成一种相对分子质量为60的一元羧酸分子,其分子中共形成____ 个 键,
键,_____ 个 键。
键。
(7)第三周期8种元素按单质熔点高低的顺序如下图,其中电负性最大的是_____ (填下图中的序号)。
(8)短周期某主族元素M的电离能情况如下图所示,则M元素是述周期表的______ 元素(填元素符号)。
序号
试回答下列问题:

(1)元素p为26号元素,请写出其基态原子电子排布式
(2)d与a反应的产物的分子中中心原子的杂化形式为
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:
(4)o、p两元素的部分电离能数据列于表:
| 元素 | o | P | |
| 电离能/kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气p2+再失去一个电子。对此,你的解释是
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示,则晶胞中i原子的配位数为

(6)元素a、c、e可形成一种相对分子质量为60的一元羧酸分子,其分子中共形成
 键,
键, 键。
键。(7)第三周期8种元素按单质熔点高低的顺序如下图,其中电负性最大的是
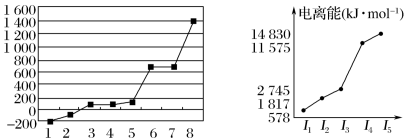
(8)短周期某主族元素M的电离能情况如下图所示,则M元素是述周期表的

序号
您最近一年使用:0次



