碘及其化合物在生产、生活中有着广泛的应用。回答下列问题:
电负性:H 2.20;C 2.55;F 3.98;P 2.19;I 2.66
(1)人工合成的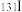 是医疗上常用的放射性同位素,碘在周期表中的位置是
是医疗上常用的放射性同位素,碘在周期表中的位置是_______ 。
(2)碘单质在 中的溶解度比在水中的大,解释原因
中的溶解度比在水中的大,解释原因_______ 。
(3)HI主要用于药物合成,通常用 和P反应生成
和P反应生成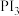 ,
,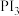 再水解制备HI.
再水解制备HI.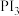 的空间结构是
的空间结构是_______ ,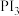 水解生成HI的化学方程式是
水解生成HI的化学方程式是_______ 。
(4)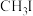 是一种甲基化试剂,
是一种甲基化试剂,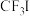 可用作制冷剂,
可用作制冷剂,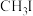 和
和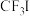 发生水解时的主要反应分别是:
发生水解时的主要反应分别是: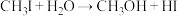 和
和 。
。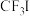 的水解产物是HIO,结合电负性解释原因
的水解产物是HIO,结合电负性解释原因_______ 。
(5) 晶体是一种性能良好的光学材料,其晶胞为立方体,边长为a nm,晶胞中K、I、O分别处于顶点、体心、面心位置,结构如下图。
晶体是一种性能良好的光学材料,其晶胞为立方体,边长为a nm,晶胞中K、I、O分别处于顶点、体心、面心位置,结构如下图。
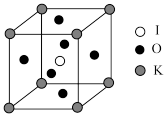
①与K原子紧邻的O原子有_______ 个。
② 的摩尔质量为214g/mol,阿伏加德罗常数为
的摩尔质量为214g/mol,阿伏加德罗常数为 。该晶体的密度是
。该晶体的密度是_______ 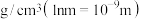 。
。
电负性:H 2.20;C 2.55;F 3.98;P 2.19;I 2.66
(1)人工合成的
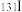 是医疗上常用的放射性同位素,碘在周期表中的位置是
是医疗上常用的放射性同位素,碘在周期表中的位置是(2)碘单质在
 中的溶解度比在水中的大,解释原因
中的溶解度比在水中的大,解释原因(3)HI主要用于药物合成,通常用
 和P反应生成
和P反应生成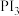 ,
,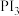 再水解制备HI.
再水解制备HI.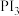 的空间结构是
的空间结构是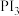 水解生成HI的化学方程式是
水解生成HI的化学方程式是(4)
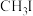 是一种甲基化试剂,
是一种甲基化试剂,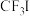 可用作制冷剂,
可用作制冷剂,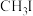 和
和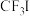 发生水解时的主要反应分别是:
发生水解时的主要反应分别是: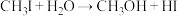 和
和 。
。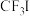 的水解产物是HIO,结合电负性解释原因
的水解产物是HIO,结合电负性解释原因(5)
 晶体是一种性能良好的光学材料,其晶胞为立方体,边长为a nm,晶胞中K、I、O分别处于顶点、体心、面心位置,结构如下图。
晶体是一种性能良好的光学材料,其晶胞为立方体,边长为a nm,晶胞中K、I、O分别处于顶点、体心、面心位置,结构如下图。
①与K原子紧邻的O原子有
②
 的摩尔质量为214g/mol,阿伏加德罗常数为
的摩尔质量为214g/mol,阿伏加德罗常数为 。该晶体的密度是
。该晶体的密度是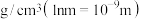 。
。
更新时间:2023-03-17 16:33:20
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】四种常见元素的性质或结构信息如F表所示,请问答下列问题。
(1)R的基态原子价层电子排布式为________ ,这四种元素的第一电离能由大到小的顺序为________________ (写元素符号)。
(2)A、B,D均可形成多种氢化物,在最常见的三种氢化物中,分子构型为三角锥的氢化物分子式为_______ ,任意写出一种中心原子存在sp2、sp3两种杂化类型的物质的结构简式________ ,与A的常见单质互为等电子体的上述元素的氧化物是________ 。
(3)B、D均可形成氧化物,等物质的量的B、D的最高价氧化物中σ键之比为________ ,已知有下列两种数据:
请解释键能大小与两种氧化物熔点、沸点高低差异过大的原因________ 。
(4)在一定条件下,Cl-与R2+可形成一种无限长链离子,研究表明该离子中每个氯原子最外层均达到8电子稳定结构,有些氧与R之间存在配位键,若该长链离子中含有n个R,则该离子的化学式为________ 。
( )
)
(5)A元素能形成组成为Pt(AH3)2Cl2的配合物,该配合物存在两种同分异构体:一种为淡黄色(Q),不具有抗癌作用,在水中的溶解度小;另一种为黄绿色(P),具有抗癌作用,在水中的溶解度较大。
①Q是________ (填“极性”或“非极性”)分子,
②P的结构简式为________ (AH3配体作为一个整体写)。
| 元素 | A | B | R | D |
| 相关信息 | 基态原子核外电子占据3个能级且最高能级上有3个电子 | B的单质是最常见半导体材料 | 位于第四周期IB族 | 是非金属元素,其形成的某种单质是电的良导体,有的分子形状似足球 |
(1)R的基态原子价层电子排布式为
(2)A、B,D均可形成多种氢化物,在最常见的三种氢化物中,分子构型为三角锥的氢化物分子式为
(3)B、D均可形成氧化物,等物质的量的B、D的最高价氧化物中σ键之比为
| 键能(kJ/mol) | 熔点(K) | 沸点(K)) | |
| BO2 | B-O:452 | 1923 | 2503 |
| DO2 | D=O:615,D-O:348 | 216 | 195 |
请解释键能大小与两种氧化物熔点、沸点高低差异过大的原因
(4)在一定条件下,Cl-与R2+可形成一种无限长链离子,研究表明该离子中每个氯原子最外层均达到8电子稳定结构,有些氧与R之间存在配位键,若该长链离子中含有n个R,则该离子的化学式为
(
 )
)(5)A元素能形成组成为Pt(AH3)2Cl2的配合物,该配合物存在两种同分异构体:一种为淡黄色(Q),不具有抗癌作用,在水中的溶解度小;另一种为黄绿色(P),具有抗癌作用,在水中的溶解度较大。
①Q是
②P的结构简式为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐2】已知X、Y、Z、W、Q是前四周期的核电荷数依次增大的元素,X的价电子层中有3个未成对电子,X与Z同主族;Y与W同主族,W元素原子M层有两对成对电子;Q的最外层只有1个电子,但次外层有18个电子。
(1)X、Y、W的第一电离能由大到小的顺序是__ (填字母对应的元素符号)。
(2)已知元素Z的某钾盐(KH2ZO4)是其酸(H3ZO2)的正盐,则酸H3ZO2的结构式为__ (元素Z用对应的元素符号书写)。
(3)已知元素X、Z相关键的键能(kJ•mol-1)如表:从能量角度看,X元素形成的单质以X2、而Z元素形成的单质Z4(结构式可表示为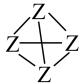 )形式存在的原因是
)形式存在的原因是__ 。
(4)元素W的含氧酸根离子(WO )的空间构型为
)的空间构型为__ ,与之互为等电子体的阴离子有__ (写出一种离子符号;等电子体指化学通式相同且价电子总数相等的分子或离子)。
(5)对于基态Q原子,下列叙述正确的是__ (填标号)。
(6)向盛有QSO4水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。分离出所得溶质化合物[Q(NH3)4(H2O)2]SO4,然后加热该化合物固体,首先失去的组分是__ ,理由是__ 。
(1)X、Y、W的第一电离能由大到小的顺序是
(2)已知元素Z的某钾盐(KH2ZO4)是其酸(H3ZO2)的正盐,则酸H3ZO2的结构式为
(3)已知元素X、Z相关键的键能(kJ•mol-1)如表:从能量角度看,X元素形成的单质以X2、而Z元素形成的单质Z4(结构式可表示为
 )形式存在的原因是
)形式存在的原因是| X—X | X≡X | Z—Z | Z≡Z |
| 193 | 946 | 197 | 489 |
 )的空间构型为
)的空间构型为(5)对于基态Q原子,下列叙述正确的是
| A.遵循能量最低原理,核外电子排布应为[Ar]3d94s2 |
| B.排布在外层的电子总是比排布在内层的电子离核更远 |
| C.电负性比钾高,原子对键合电子的吸引力比钾大 |
| D.电子先排入4s轨道,再排进3d轨道,故3d轨道的电子能量比4s高 |
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】点击化学的代表反应为铜催化的叠氮-炔基Husigen环加成反应,NaN3、SO2F2、FSO2N2等均是点击化学中常用无机试剂。回答下列问题:
(1)基态Cu原子价电子排布式为___________ ;基态N原子未成对电子有___________ 个。
(2)F、O、N的电负性从小到大的顺序是___________ 。
(3)SO2F2中硫原子价层电子对数目为___________ ;SO2F2的沸点比FSO2N3的低,其主要原因是___________ 。
(4)NaN3是HN3的钠盐,下列有关HN3说法正确的是___________ (填字母)。
a.HN3分子呈直线型 b.HN3分子间存在氢键
c.HN3中氮原子杂化方式只有sp d.HN3与HOCN互为等电子体
(5)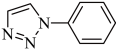 是一种叠氮-炔基Husigen环加成反应产物,每个该分子中含有
是一种叠氮-炔基Husigen环加成反应产物,每个该分子中含有___________ 个σ键。
(6)CuBr是点击化学常用的催化剂,其晶胞结构如图所示,晶胞参数为a pm。
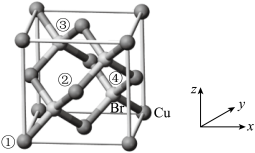
已知①、②号铜原子坐标依次为(0,0,0)、( ,0,
,0, ),则③号溴原子的坐标为
),则③号溴原子的坐标为___________ ;设NA为阿伏加德罗常数的值,CuBr的密度为___________ g·cm-3(列出计算式)。
(1)基态Cu原子价电子排布式为
(2)F、O、N的电负性从小到大的顺序是
(3)SO2F2中硫原子价层电子对数目为
(4)NaN3是HN3的钠盐,下列有关HN3说法正确的是
a.HN3分子呈直线型 b.HN3分子间存在氢键
c.HN3中氮原子杂化方式只有sp d.HN3与HOCN互为等电子体
(5)
 是一种叠氮-炔基Husigen环加成反应产物,每个该分子中含有
是一种叠氮-炔基Husigen环加成反应产物,每个该分子中含有(6)CuBr是点击化学常用的催化剂,其晶胞结构如图所示,晶胞参数为a pm。

已知①、②号铜原子坐标依次为(0,0,0)、(
 ,0,
,0, ),则③号溴原子的坐标为
),则③号溴原子的坐标为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】草酸铁铵{(NH4)3[Fe(C2O4)3]}常用于摄影和蓝色印刷等,其制备原理为:Fe(OH)3+3NH4HC2O4=(NH4)3[Fe(C2O4)3]+3H2O。
回答下列问题:
(1)基态C原子核外电子云有__ 种形状;基态铁原子最先失去__ 能级(填能级符号)上的电子。
(2)(NH4)3[Fe(C2O4)3]中C2O 作为配体时两个单键氧能同时作为配位原子与金属离子形成环状结构。
作为配体时两个单键氧能同时作为配位原子与金属离子形成环状结构。
①该配合物中所含非金属元素的电负性由大到小的顺序为__ (用元素符号表示)。
②上述配合物的中心离子配位数为___ 。
③1molC2O 中含有σ键的数目为
中含有σ键的数目为__ 在多原子分子中如有相互平行的p轨道,它们连贯重叠在一起构成一个整体,p电子在多个原子间运动形成π型化学键,这种不局限在两个原子之间的π键称为离域π键简称大π键。如苯的大π键可表示为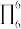 (π的右下角“6”表示6个原子,右上角“6”表示6个电子),C2O
(π的右下角“6”表示6个原子,右上角“6”表示6个电子),C2O 的大π键可表示为
的大π键可表示为__ 。
(3)写出一种与NH 所含价电子数和原子总数均相等微粒的化学式
所含价电子数和原子总数均相等微粒的化学式__ ;N元素的一种同素异形体N4中所有原子均满足8电子稳定结构,N4的结构式为__ ;CH4、NH3、H2O分子中键角由大到小的顺序为__ 。
(4)铁的某种晶胞沿面对角线的位置切下之后可以得到如图所示的藏面。假设铁原子半径为rpm,NA为阿伏加德罗常数的值,则铁晶体密度为__ g·cm-3。

回答下列问题:
(1)基态C原子核外电子云有
(2)(NH4)3[Fe(C2O4)3]中C2O
 作为配体时两个单键氧能同时作为配位原子与金属离子形成环状结构。
作为配体时两个单键氧能同时作为配位原子与金属离子形成环状结构。①该配合物中所含非金属元素的电负性由大到小的顺序为
②上述配合物的中心离子配位数为
③1molC2O
 中含有σ键的数目为
中含有σ键的数目为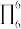 (π的右下角“6”表示6个原子,右上角“6”表示6个电子),C2O
(π的右下角“6”表示6个原子,右上角“6”表示6个电子),C2O 的大π键可表示为
的大π键可表示为(3)写出一种与NH
 所含价电子数和原子总数均相等微粒的化学式
所含价电子数和原子总数均相等微粒的化学式(4)铁的某种晶胞沿面对角线的位置切下之后可以得到如图所示的藏面。假设铁原子半径为rpm,NA为阿伏加德罗常数的值,则铁晶体密度为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】甲硅烷 可用于制备多种新型无机非金属材料。
可用于制备多种新型无机非金属材料。
(1) 原子与
原子与 原子结合时,
原子结合时, 表现为正价,则电负性:
表现为正价,则电负性:
___________ H(填“>”“<”或“=”), 分子的空间结构为
分子的空间结构为___________ 。
(2)利用 与
与 反应可制得碳化硅晶体,晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。
反应可制得碳化硅晶体,晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。

①碳化硅晶体中每个 原子周围距离最近的
原子周围距离最近的 原子数目为
原子数目为________ , 的晶体类型是
的晶体类型是_______ 。
②基态 原子的价层电子轨道表达式为
原子的价层电子轨道表达式为___________ 。
(3)利用 与
与 可制得氮化硅(
可制得氮化硅(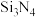 )材料。
)材料。
①热稳定性:
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
② 中
中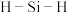 的键角
的键角___________  中
中 的键角(填“>”“<”或“=”),其键角差异的原因是
的键角(填“>”“<”或“=”),其键角差异的原因是___________ 。
 可用于制备多种新型无机非金属材料。
可用于制备多种新型无机非金属材料。(1)
 原子与
原子与 原子结合时,
原子结合时, 表现为正价,则电负性:
表现为正价,则电负性:
 分子的空间结构为
分子的空间结构为(2)利用
 与
与 反应可制得碳化硅晶体,晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。
反应可制得碳化硅晶体,晶胞结构如图,硅原子位于立方体的顶点和面心,碳原子位于立方体的内部。
①碳化硅晶体中每个
 原子周围距离最近的
原子周围距离最近的 原子数目为
原子数目为 的晶体类型是
的晶体类型是②基态
 原子的价层电子轨道表达式为
原子的价层电子轨道表达式为(3)利用
 与
与 可制得氮化硅(
可制得氮化硅(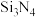 )材料。
)材料。①热稳定性:

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②
 中
中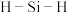 的键角
的键角 中
中 的键角(填“>”“<”或“=”),其键角差异的原因是
的键角(填“>”“<”或“=”),其键角差异的原因是
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐3】铁、钴、镍等金属及其化合物在科学研究和工业生产中应用非常广泛。回答下列问题:
(1)基态铁原子的核外电子排布式为___________ 。
(2)K3[Fe(CN)6 ]溶液可以检验Fe2+。K3[Fe(CN)6]中含有的σ键与π键的数目之比___________ , 与CN-互为等电子体的分子有___________ (举一例,填化学式)。
(3)酞菁钴的结构简式如图所示,其中三种非金属元素的电负性由大到小的顺序为___________ 。

(4)NiSO4是制备磁性材料和催化剂的重要中间体, 的空间构型为
的空间构型为___________ ,硫原子的杂化方式为___________ 。
(5)某氮化铁的晶胞结构如图所示:
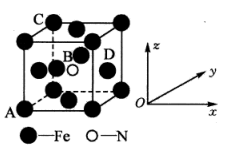
①原子坐标参数表示晶胞内部各原子的相对位置。如图晶胞中,原子坐标参数A(0,0,0);B为( ,
, ,
, );C为(0,1,1)。则D原子的坐标参数为
);C为(0,1,1)。则D原子的坐标参数为___________ 。
②若该晶体的密度是ρg·cm-3 ,则晶胞中两个最近的Fe的核间距为___________ cm(用含ρ的代数式表示,NA表示阿伏加德罗常数的值)。
(1)基态铁原子的核外电子排布式为
(2)K3[Fe(CN)6 ]溶液可以检验Fe2+。K3[Fe(CN)6]中含有的σ键与π键的数目之比
(3)酞菁钴的结构简式如图所示,其中三种非金属元素的电负性由大到小的顺序为

(4)NiSO4是制备磁性材料和催化剂的重要中间体,
 的空间构型为
的空间构型为(5)某氮化铁的晶胞结构如图所示:

①原子坐标参数表示晶胞内部各原子的相对位置。如图晶胞中,原子坐标参数A(0,0,0);B为(
 ,
, ,
, );C为(0,1,1)。则D原子的坐标参数为
);C为(0,1,1)。则D原子的坐标参数为②若该晶体的密度是ρg·cm-3 ,则晶胞中两个最近的Fe的核间距为
您最近一年使用:0次
【推荐1】Fe、Co、Ni均为第Ⅷ族元素,它们的化合物在生产生活中有着广泛的应用。
(1)基态Co原子的价电子排布式为____________
(2)已知HN3是一种弱酸,其在水溶液中的电离方程式为 ,与
,与 互为等电子体的一种分子为:
互为等电子体的一种分子为:_______ , 离子杂化类型为
离子杂化类型为___________ 。
(3)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+的配位数是___________ ,配位体NH3的空间构型为:___________ 。
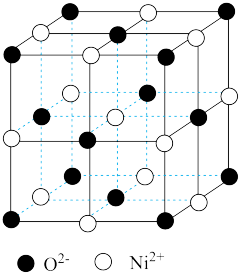
(4)某蓝色晶体中,Fe2+、Fe3+分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个CN-,K+位于立方体的某恰当位置上。据此可知该晶体的化学式为____________ ,立方体中Fe2+间连接起来形成的空间构型是_____________ 。
(5)氧化镍和氯化钠的晶体结构相同,可看成镍离子替换钠离子,氧离子替换氯离子。则:
①镍离子的配位数为__________ 。
②若阿伏加 德罗常数的值为NA,晶体密度为ρg·cm-3,则该晶胞中最近的O2-之间的距离为__________ pm(列出表达式)。
(1)基态Co原子的价电子排布式为
(2)已知HN3是一种弱酸,其在水溶液中的电离方程式为
 ,与
,与 互为等电子体的一种分子为:
互为等电子体的一种分子为: 离子杂化类型为
离子杂化类型为(3)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+的配位数是
(4)某蓝色晶体中,Fe2+、Fe3+分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个CN-,K+位于立方体的某恰当位置上。据此可知该晶体的化学式为
(5)氧化镍和氯化钠的晶体结构相同,可看成镍离子替换钠离子,氧离子替换氯离子。则:
①镍离子的配位数为
②若阿伏加 德罗常数的值为NA,晶体密度为ρg·cm-3,则该晶胞中最近的O2-之间的距离为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐2】中科院首创的KBBF晶体在激光技术领域具有重要应用价值,KBBF的化学组成为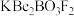
(1)氟原子激发态的电子排布式中能量从高到底的顺序是___________ 。(填标号)
a、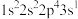 b、
b、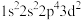 c、
c、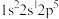 d、
d、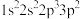
(2)KBBF晶体可将入射激光直接倍频产生深紫外激光,源于___________ (填选项符号)
A.分子热效应 B.晶体内化学反应焓变 C.原子核外电子在能级间的跃迁
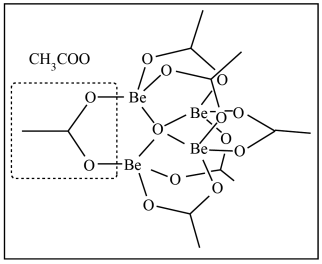
(3)KBBF晶体生产原料纯化过程重要物质乙酸氧铍 分子为四面体对称结构,氧原子位于四面体中心,四个铍原子位于四面体的顶点,六个醋酸根离子则连接在四面体的六条棱边上:
分子为四面体对称结构,氧原子位于四面体中心,四个铍原子位于四面体的顶点,六个醋酸根离子则连接在四面体的六条棱边上:
①分子中碳原子杂化类型为___________ 。
②六个甲基中的碳原子形成的空间构型为___________ 。
③1mol乙酸氧铍晶体中含有的配位键为___________ mol。
(4)超氧化钾(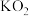 )晶体结构中阴阳离子的配位数均为6,则晶胞的俯视图可能是___________(填选项字母)。
)晶体结构中阴阳离子的配位数均为6,则晶胞的俯视图可能是___________(填选项字母)。
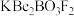
(1)氟原子激发态的电子排布式中能量从高到底的顺序是
a、
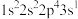 b、
b、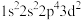 c、
c、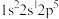 d、
d、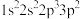
(2)KBBF晶体可将入射激光直接倍频产生深紫外激光,源于
A.分子热效应 B.晶体内化学反应焓变 C.原子核外电子在能级间的跃迁
(3)KBBF晶体生产原料纯化过程重要物质乙酸氧铍
 分子为四面体对称结构,氧原子位于四面体中心,四个铍原子位于四面体的顶点,六个醋酸根离子则连接在四面体的六条棱边上:
分子为四面体对称结构,氧原子位于四面体中心,四个铍原子位于四面体的顶点,六个醋酸根离子则连接在四面体的六条棱边上:
①分子中碳原子杂化类型为
②六个甲基中的碳原子形成的空间构型为
③1mol乙酸氧铍晶体中含有的配位键为
(4)超氧化钾(
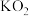 )晶体结构中阴阳离子的配位数均为6,则晶胞的俯视图可能是___________(填选项字母)。
)晶体结构中阴阳离子的配位数均为6,则晶胞的俯视图可能是___________(填选项字母)。A. | B. | C. | D. |
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
真题
名校
【推荐3】三磷酸腺苷(ATP) 和活性氧类(如 H2O2和O )可在细胞代谢过程中产生。
)可在细胞代谢过程中产生。
(1)ATP 的分子式为C10H16N5O13P3,其中电负性最大的元素是_______ ,基态 N原子的电子排布图为_______ 。
(2)H2O2 分子的氧原子的杂化轨道类型为:_______ ;H2O2和H2O能以任意比例互溶的原因是_______ 。
(3)O3分子的立体构型为_______ 。根据表中数据判断氧原子之间的共价键最稳定的粒子是_______ 。
(4)研究发现纳米CeO2可催化O 分解,CeO2晶体属立方CaF2型晶体结构如图所示。
分解,CeO2晶体属立方CaF2型晶体结构如图所示。_______ nm。
②以晶胞参数为单位长度建立的中标系可以表示晶胞中的原子位置,称作原子分数坐标。A离子的坐标为(0, ,
, ),则B离子的坐标为
),则B离子的坐标为_______ 。
③纳米CeO2中位于晶粒表面的Ce4+能发挥催化作用,在边长为2 a nm的立方体晶粒中位于表面的Ce4+最多有_______ 个。
 )可在细胞代谢过程中产生。
)可在细胞代谢过程中产生。(1)ATP 的分子式为C10H16N5O13P3,其中电负性最大的元素是
(2)H2O2 分子的氧原子的杂化轨道类型为:
(3)O3分子的立体构型为
| 粒子 | O2 | O | O3 |
| 键长/pm | 121 | 126 | 128 |
(4)研究发现纳米CeO2可催化O
 分解,CeO2晶体属立方CaF2型晶体结构如图所示。
分解,CeO2晶体属立方CaF2型晶体结构如图所示。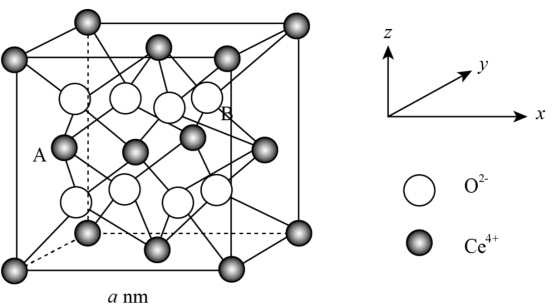
②以晶胞参数为单位长度建立的中标系可以表示晶胞中的原子位置,称作原子分数坐标。A离子的坐标为(0,
 ,
, ),则B离子的坐标为
),则B离子的坐标为③纳米CeO2中位于晶粒表面的Ce4+能发挥催化作用,在边长为2 a nm的立方体晶粒中位于表面的Ce4+最多有
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】碳族元素与氮族元素的单质及其化合物在生产、生活中应用广泛。回答下列问题:
(1)基态Ge原子价电子排布式为___________ 。
(2)C、N、O、Si第一电离能由大到小的顺序为___________ ;
(3)已知N2O与CO2互为等电子体,则N2O的结构式为___________ ,N2O是___________ (填“极性”或“非极性”)分子。
(4)磷能形成多种含氧酸,其中亚磷酸的结构如为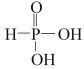 ,则Na2HPO3溶液中各离子浓度由大到小的顺序为
,则Na2HPO3溶液中各离子浓度由大到小的顺序为___________ 。
(5)C和Si与O原子结合形成CO2和SiO2时假设采用甲、乙两种构型:
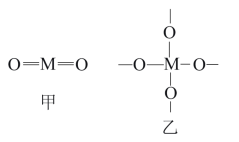
部分化学键的键能如表所示:
SiO2晶体中Si原子采取的构型是___________ (填“甲”或“乙”),从能量角度解释Si原子采取该构型的原因是___________ 。
(6)碳化硅(SiC)是人工合成的无机非金属材料,其晶体结构类似于金刚石,结构如图所示:
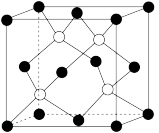
①该晶体中碳原子的杂化轨道类型为_______ 杂化,一个硅原子周围与其最近的硅原子的数目为________ 。
②在立方体体对角线的一维空间上碳、硅原子的分布规律(原子的比例大小和相对位置)正确的是___ 。
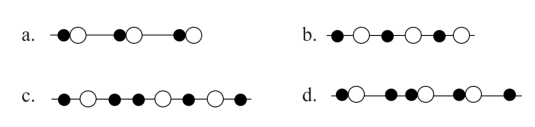
③如果SiC晶体中硅原子与最近碳原子间距离为dpm,则SiC晶体的密度为______ g·cm-3(写含有d的表达式)
(1)基态Ge原子价电子排布式为
(2)C、N、O、Si第一电离能由大到小的顺序为
(3)已知N2O与CO2互为等电子体,则N2O的结构式为
(4)磷能形成多种含氧酸,其中亚磷酸的结构如为
 ,则Na2HPO3溶液中各离子浓度由大到小的顺序为
,则Na2HPO3溶液中各离子浓度由大到小的顺序为(5)C和Si与O原子结合形成CO2和SiO2时假设采用甲、乙两种构型:

部分化学键的键能如表所示:
| 化学键 | 键能/(kJ·mol-1) | 化学键 | 键能/(kJ·mol-1) | |
| C—C | 331 | C—O | 343 | |
| Si—Si | 197 | Si—O | 466 | |
| C=C | 620 | CO | 805 | |
| Si=Si | 272 | Si=O | 640 |
(6)碳化硅(SiC)是人工合成的无机非金属材料,其晶体结构类似于金刚石,结构如图所示:

①该晶体中碳原子的杂化轨道类型为
②在立方体体对角线的一维空间上碳、硅原子的分布规律(原子的比例大小和相对位置)正确的是
③如果SiC晶体中硅原子与最近碳原子间距离为dpm,则SiC晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】硼砂是含结晶水的四硼酸钠。以硼砂为原料,可以得到BF3、BN和硼酸等重要化合物,请根据图中信息回答有关问题:


(1)硼砂中阴离子Xm-(含B、O、H三种元素)的球棍模型如图1所示,则在Xm-中,2号硼原子的杂化类型为_______ ;m=_______ (填数字)。
(2)BF3和过量NaF作用可生成NaBF4,BF 的价层电子对数为
的价层电子对数为_______ ;BF 的立体构型为
的立体构型为_______ 。
(3)硼酸[B(OH)3]结构如图2所示,分子中一个B原子与3个羟基相连,硼酸为一元弱酸,与过量NaOH反应生成[B(OH)4]-,请用化学键有关知识分析[B(OH)4]-的形成原因:_______ 。
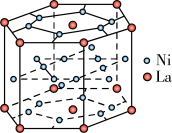
(4)镧系合金是稀土系储氢合金的典型代表,由荷兰菲利浦实验室首先研制出来。它的最大优点是容易活化。其晶胞结构如图所示,则它的化学式为_______ ,镍的价电子排布式_______ 。
(5)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为( ,0,
,0, );C为(
);C为( ,
, ,0)。
,0)。

②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为_______ g·cm-3(列出计算式即可)。


(1)硼砂中阴离子Xm-(含B、O、H三种元素)的球棍模型如图1所示,则在Xm-中,2号硼原子的杂化类型为
(2)BF3和过量NaF作用可生成NaBF4,BF
 的价层电子对数为
的价层电子对数为 的立体构型为
的立体构型为(3)硼酸[B(OH)3]结构如图2所示,分子中一个B原子与3个羟基相连,硼酸为一元弱酸,与过量NaOH反应生成[B(OH)4]-,请用化学键有关知识分析[B(OH)4]-的形成原因:
(4)镧系合金是稀土系储氢合金的典型代表,由荷兰菲利浦实验室首先研制出来。它的最大优点是容易活化。其晶胞结构如图所示,则它的化学式为

(5)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(
 ,0,
,0, );C为(
);C为( ,
, ,0)。
,0)。
②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】 作为主要的温室气体,对人类的生产生活有着重要影响,
作为主要的温室气体,对人类的生产生活有着重要影响, 还原
还原 是实现“碳达峰、碳中和”的有效途径之一,相关的反应如下:
是实现“碳达峰、碳中和”的有效途径之一,相关的反应如下:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
反应Ⅰ、Ⅱ、Ⅲ的平衡常数与温度变化关系如图所示. 合成
合成 选择性的条件是__________。(填字母)
选择性的条件是__________。(填字母)
(2) 的取值范围是__________。(填字母)
的取值范围是__________。(填字母)
(3)一定条件下,向体积为 的恒温密闭容器中加入
的恒温密闭容器中加入 和
和 发生上述反应,平衡时,容器中
发生上述反应,平衡时,容器中 的浓度为
的浓度为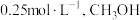 的浓度为
的浓度为 ,此时
,此时 的浓度为
的浓度为__________  ,反应Ⅰ的平衡常数为
,反应Ⅰ的平衡常数为__________ (保留一位小数)。
(4) 还原能力
还原能力 可衡量
可衡量 转化率,已知
转化率,已知 ,即相同时间段内
,即相同时间段内 与
与 物质的量变化量之比,常压下
物质的量变化量之比,常压下 和
和 按物质的量之比
按物质的量之比 投料,反应相同时间,
投料,反应相同时间, 和
和 转化率如图所示:
转化率如图所示: 范围内,S值的变化趋势是
范围内,S值的变化趋势是__________ ;(填字母)
A.一直增大 B.一直减小 C.先增大后减小 D.先减小后增大
②由图像可知, 转化率在
转化率在 时大于
时大于 ,其原因是
,其原因是__________ ;
(5)一种由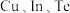 组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为
组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为 ,晶体由原子填充,该晶体的化学式为
,晶体由原子填充,该晶体的化学式为__________ ;以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标分别为 ,则B点原子的分数坐标为
,则B点原子的分数坐标为__________ 。
 作为主要的温室气体,对人类的生产生活有着重要影响,
作为主要的温室气体,对人类的生产生活有着重要影响, 还原
还原 是实现“碳达峰、碳中和”的有效途径之一,相关的反应如下:
是实现“碳达峰、碳中和”的有效途径之一,相关的反应如下:反应Ⅰ:

反应Ⅱ:

反应Ⅲ:

反应Ⅰ、Ⅱ、Ⅲ的平衡常数与温度变化关系如图所示.
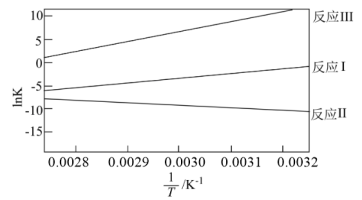
 合成
合成 选择性的条件是__________。(填字母)
选择性的条件是__________。(填字母)| A.高温高压 | B.高温低压 | C.低温高压 | D.低温低压 |
(2)
 的取值范围是__________。(填字母)
的取值范围是__________。(填字母)A. | B.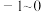 | C.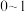 | D.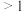 |
(3)一定条件下,向体积为
 的恒温密闭容器中加入
的恒温密闭容器中加入 和
和 发生上述反应,平衡时,容器中
发生上述反应,平衡时,容器中 的浓度为
的浓度为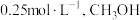 的浓度为
的浓度为 ,此时
,此时 的浓度为
的浓度为 ,反应Ⅰ的平衡常数为
,反应Ⅰ的平衡常数为(4)
 还原能力
还原能力 可衡量
可衡量 转化率,已知
转化率,已知 ,即相同时间段内
,即相同时间段内 与
与 物质的量变化量之比,常压下
物质的量变化量之比,常压下 和
和 按物质的量之比
按物质的量之比 投料,反应相同时间,
投料,反应相同时间, 和
和 转化率如图所示:
转化率如图所示: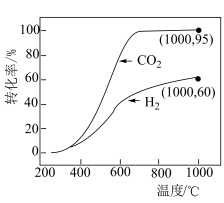
 范围内,S值的变化趋势是
范围内,S值的变化趋势是A.一直增大 B.一直减小 C.先增大后减小 D.先减小后增大
②由图像可知,
 转化率在
转化率在 时大于
时大于 ,其原因是
,其原因是(5)一种由
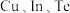 组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为
组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为 ,晶体由原子填充,该晶体的化学式为
,晶体由原子填充,该晶体的化学式为 ,则B点原子的分数坐标为
,则B点原子的分数坐标为
您最近一年使用:0次



