2024·陕西西安·二模
1 . Fe、Co、Ni、Cu均为第四周期元素,它们的化合物在生产、生活中有着广泛的应用。
(1)基态Fe原子的核外电子中,两种自旋状态的电子数之比为___________ 。在空气中FeO稳定性小于 ,从电子排布的角度分析,其主要原因是
,从电子排布的角度分析,其主要原因是___________ 。
(2) 可形成
可形成 ,其中en代表
,其中en代表 。该化合物分子中,VSEPR模型为四面体的非金属原子共有
。该化合物分子中,VSEPR模型为四面体的非金属原子共有___________ 个;C、N、B的电负性由小到大的顺序为___________ 。
(3)基态 的核外电子排布式为
的核外电子排布式为___________ ; 常温下为无色液体,写出两种与CO互为等电子体离子的化学式
常温下为无色液体,写出两种与CO互为等电子体离子的化学式___________ 、___________ 。
(4)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为___________ ;该晶体的化学式为___________ 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点、B点原子的分数坐标分别为 、
、 ,则c点原子的分数坐标为
,则c点原子的分数坐标为___________ ;晶胞中C、D间距离d=___________ pm。
(1)基态Fe原子的核外电子中,两种自旋状态的电子数之比为
 ,从电子排布的角度分析,其主要原因是
,从电子排布的角度分析,其主要原因是(2)
 可形成
可形成 ,其中en代表
,其中en代表 。该化合物分子中,VSEPR模型为四面体的非金属原子共有
。该化合物分子中,VSEPR模型为四面体的非金属原子共有(3)基态
 的核外电子排布式为
的核外电子排布式为 常温下为无色液体,写出两种与CO互为等电子体离子的化学式
常温下为无色液体,写出两种与CO互为等电子体离子的化学式(4)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为
 、
、 ,则c点原子的分数坐标为
,则c点原子的分数坐标为
您最近一年使用:0次
名校
解题方法
2 . Zn、Fe、Cu、Cr等过渡金属的原子或离子易通过配位键形成配合物或配离子。回答下列问题:
I.一种比率光声探针M与 配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如下所示:
配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如下所示:

(1)H、C、N、F四种元素电负性由小到大的顺序为_______ , 中键角F-B-F
中键角F-B-F_______ M中键角F-B-F(填“>”、“<”或“=”)。
(2)As与N为同一主族元素,有机酸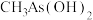 的沸点比
的沸点比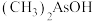 高的原因是
高的原因是_______ 。
(3)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质,下列物质中,属于顺磁性物质的是_______。
Ⅱ. 的结构如下图所示。
的结构如下图所示。
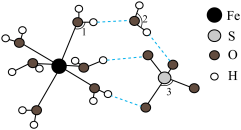
(4)与Fe最外层电子数相同且同周期的元素有_______ 种。
(5)图示 结构中键角1、2、3由大到小的顺序是
结构中键角1、2、3由大到小的顺序是_______ (填序号)。
Ⅲ.一种立方钙钛矿型晶体 有两种晶胞结构,其俯视图如下(重叠处仅画出大的微粒),La的配位数均是12。
有两种晶胞结构,其俯视图如下(重叠处仅画出大的微粒),La的配位数均是12。
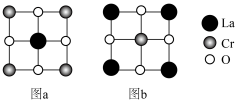
(6)图a的晶胞参数为xpm,则O与O的最小核间距为_______ pm;图b晶胞中O的位置为_______ (填“体心”“顶点”“面心”“棱心”)。
(7)晶胞经掺杂后能提高红外辐射效率。由图a晶胞堆叠形成的2×2×2超晶胞中一个La原子被Sr代替,则掺杂后晶体化学式为_______ 。
I.一种比率光声探针M与
 配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如下所示:
配位,可用于小鼠脑内铜(Ⅱ)的高时空分辨率动态成像,反应如下所示:
(1)H、C、N、F四种元素电负性由小到大的顺序为
 中键角F-B-F
中键角F-B-F(2)As与N为同一主族元素,有机酸
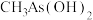 的沸点比
的沸点比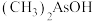 高的原因是
高的原因是(3)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质,下列物质中,属于顺磁性物质的是_______。
A. | B. |
C. | D.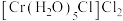 |
Ⅱ.
 的结构如下图所示。
的结构如下图所示。
(4)与Fe最外层电子数相同且同周期的元素有
(5)图示
 结构中键角1、2、3由大到小的顺序是
结构中键角1、2、3由大到小的顺序是Ⅲ.一种立方钙钛矿型晶体
 有两种晶胞结构,其俯视图如下(重叠处仅画出大的微粒),La的配位数均是12。
有两种晶胞结构,其俯视图如下(重叠处仅画出大的微粒),La的配位数均是12。
(6)图a的晶胞参数为xpm,则O与O的最小核间距为
(7)晶胞经掺杂后能提高红外辐射效率。由图a晶胞堆叠形成的2×2×2超晶胞中一个La原子被Sr代替,则掺杂后晶体化学式为
您最近一年使用:0次
解题方法
3 .  是高温超导或非常规超导物理中的重要角色,同时还是很好的催化材料。回答下列问题:
是高温超导或非常规超导物理中的重要角色,同时还是很好的催化材料。回答下列问题:
(1) 与铁在元素周期表中是同列相邻元素且最外层有一个未成对电子,其价电子排布式为
与铁在元素周期表中是同列相邻元素且最外层有一个未成对电子,其价电子排布式为___________ 。
(2) 可形成
可形成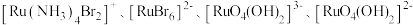 四种配离子且配离子中不存在非极性键,其中
四种配离子且配离子中不存在非极性键,其中 离子半径最小的配离子是
离子半径最小的配离子是___________ ,具有对称结构的 中
中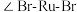 为
为___________ 。图1中通过螯合作用形成配位键的N原子的杂化方式为___________ , 离子配体中N原子与中心
离子配体中N原子与中心 离子配位的原因是
离子配位的原因是___________ 。

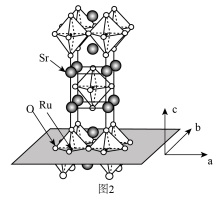
(3) 的晶体结构如图2所示。
的晶体结构如图2所示。
① 和
和 的电负性:
的电负性:
___________  (填“大于”“小于”或“等于”),基态O原子电子占据最高能级的电子云轮廓图为
(填“大于”“小于”或“等于”),基态O原子电子占据最高能级的电子云轮廓图为___________ 形。
②用 表示阿伏伽德罗常数的值,晶胞参数为
表示阿伏伽德罗常数的值,晶胞参数为 ,
, ,则其密度为
,则其密度为___________  (列出计算式即可)。
(列出计算式即可)。
 是高温超导或非常规超导物理中的重要角色,同时还是很好的催化材料。回答下列问题:
是高温超导或非常规超导物理中的重要角色,同时还是很好的催化材料。回答下列问题:(1)
 与铁在元素周期表中是同列相邻元素且最外层有一个未成对电子,其价电子排布式为
与铁在元素周期表中是同列相邻元素且最外层有一个未成对电子,其价电子排布式为(2)
 可形成
可形成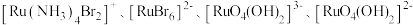 四种配离子且配离子中不存在非极性键,其中
四种配离子且配离子中不存在非极性键,其中 离子半径最小的配离子是
离子半径最小的配离子是 中
中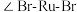 为
为 离子配体中N原子与中心
离子配体中N原子与中心 离子配位的原因是
离子配位的原因是
(3)
 的晶体结构如图2所示。
的晶体结构如图2所示。
①
 和
和 的电负性:
的电负性:
 (填“大于”“小于”或“等于”),基态O原子电子占据最高能级的电子云轮廓图为
(填“大于”“小于”或“等于”),基态O原子电子占据最高能级的电子云轮廓图为②用
 表示阿伏伽德罗常数的值,晶胞参数为
表示阿伏伽德罗常数的值,晶胞参数为 ,
, ,则其密度为
,则其密度为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
名校
解题方法
4 . 铁的配合物在生产、生活中有重要应用,某种铁的配合物结构如图所示,下列说法正确的是
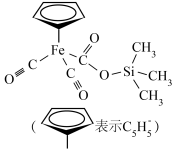

| A.基态硅原子最高能级轨道形状为球形 |
| B.该配合物中元素的电负性最大的是氧 |
| C.该配合物中碳原子的杂化方式有3种 |
| D.基态铁原子核外电子有26种空间运动状态 |
您最近一年使用:0次
2023-05-03更新
|
180次组卷
|
2卷引用:山东省青岛市西海岸新区2022-2023学年高一下学期期中考试化学试题
2023·山东东营·二模
5 . 前四周期元素W、X、Y、Z的原子序数依次增大。基态W原子中有7个运动状态不同的电子,基态X原子最高能级中自旋状态不同的电子数之比为 ,基态Y原子的价层电子排布式为
,基态Y原子的价层电子排布式为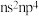 ,基态Z原子次外层全充满,最外层电子数为1,下列说法错误的是
,基态Z原子次外层全充满,最外层电子数为1,下列说法错误的是
 ,基态Y原子的价层电子排布式为
,基态Y原子的价层电子排布式为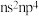 ,基态Z原子次外层全充满,最外层电子数为1,下列说法错误的是
,基态Z原子次外层全充满,最外层电子数为1,下列说法错误的是| A.电负性:X>W>Y | B.熔点:化合物ZX>化合物ZY |
| C.简单氢化物的稳定性:W<X | D.X、Y形成的化合物一定为极性分子 |
您最近一年使用:0次
2023-04-28更新
|
545次组卷
|
3卷引用:单项选择题1-5
名校
解题方法
6 . 碘及其化合物在生产、生活中有着广泛的应用。回答下列问题:
电负性:H 2.20;C 2.55;F 3.98;P 2.19;I 2.66
(1)人工合成的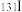 是医疗上常用的放射性同位素,碘在周期表中的位置是
是医疗上常用的放射性同位素,碘在周期表中的位置是_______ 。
(2)碘单质在 中的溶解度比在水中的大,解释原因
中的溶解度比在水中的大,解释原因_______ 。
(3)HI主要用于药物合成,通常用 和P反应生成
和P反应生成 ,
, 再水解制备HI.
再水解制备HI. 的空间结构是
的空间结构是_______ , 水解生成HI的化学方程式是
水解生成HI的化学方程式是_______ 。
(4) 是一种甲基化试剂,
是一种甲基化试剂, 可用作制冷剂,
可用作制冷剂, 和
和 发生水解时的主要反应分别是:
发生水解时的主要反应分别是: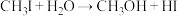 和
和 。
。 的水解产物是HIO,结合电负性解释原因
的水解产物是HIO,结合电负性解释原因_______ 。
(5) 晶体是一种性能良好的光学材料,其晶胞为立方体,边长为a nm,晶胞中K、I、O分别处于顶点、体心、面心位置,结构如下图。
晶体是一种性能良好的光学材料,其晶胞为立方体,边长为a nm,晶胞中K、I、O分别处于顶点、体心、面心位置,结构如下图。
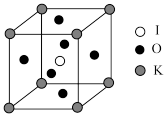
①与K原子紧邻的O原子有_______ 个。
② 的摩尔质量为214g/mol,阿伏加德罗常数为
的摩尔质量为214g/mol,阿伏加德罗常数为 。该晶体的密度是
。该晶体的密度是_______ 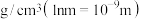 。
。
电负性:H 2.20;C 2.55;F 3.98;P 2.19;I 2.66
(1)人工合成的
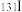 是医疗上常用的放射性同位素,碘在周期表中的位置是
是医疗上常用的放射性同位素,碘在周期表中的位置是(2)碘单质在
 中的溶解度比在水中的大,解释原因
中的溶解度比在水中的大,解释原因(3)HI主要用于药物合成,通常用
 和P反应生成
和P反应生成 ,
, 再水解制备HI.
再水解制备HI. 的空间结构是
的空间结构是 水解生成HI的化学方程式是
水解生成HI的化学方程式是(4)
 是一种甲基化试剂,
是一种甲基化试剂, 可用作制冷剂,
可用作制冷剂, 和
和 发生水解时的主要反应分别是:
发生水解时的主要反应分别是: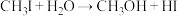 和
和 。
。 的水解产物是HIO,结合电负性解释原因
的水解产物是HIO,结合电负性解释原因(5)
 晶体是一种性能良好的光学材料,其晶胞为立方体,边长为a nm,晶胞中K、I、O分别处于顶点、体心、面心位置,结构如下图。
晶体是一种性能良好的光学材料,其晶胞为立方体,边长为a nm,晶胞中K、I、O分别处于顶点、体心、面心位置,结构如下图。
①与K原子紧邻的O原子有
②
 的摩尔质量为214g/mol,阿伏加德罗常数为
的摩尔质量为214g/mol,阿伏加德罗常数为 。该晶体的密度是
。该晶体的密度是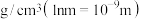 。
。
您最近一年使用:0次
2023-03-17更新
|
628次组卷
|
6卷引用:山东省青岛第二中学2023-2024学年高三上学期期中考试化学试卷
解题方法
7 . 氧、硫形成的化合物种类繁多,日常生活中应用广泛。如硫代硫酸钠(Na2S2O3)可作为照相业的定影剂,反应的化学方程式如下:AgBr+2Na2S2O3=Na3[Ag(S2O3)2]+NaBr。回答下列问题:
(1)已知银(Ag)位于元素周期表第五周期,与Cu同族,则基态Ag的价电子排布式为____________ 。
(2)下列关于物质结构与性质的说法,正确的是_________
A.玻尔原子结构模型能够成功地解释各种原子光谱
B.Br、S、O三种元素的电负性顺序为 O>Br>S
C.Na 的第一电离能小于 Mg,但其第二电离能却远大于 Mg
D.水分子间存在氢键,故H2O的熔沸点及稳定性均大于H2S
(3)依据VSEPR理论推测S2O32-的空间构型为_______________________ ,中心原子S的杂化方式为_____ ,[Ag(S2O3)2]3-中存在的化学键有______________ (填字母序号)。
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键
(4)第一电子亲和能(E1)是指元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量(单位为kJ·mol-1),电子亲和能越大,该元素原子越易得电子。已知第三周期部分元素第一电子亲和能如下表:
表中元素的E1自左而右呈增大趋势,试分析P元素呈现异常的原因__________ 。
(5)某种离子型铁的氧化物晶胞如下图所示,它由A、B组成。则该氧化物的化学式为:________ ,已知该晶体的晶胞参数为anm,阿伏伽德罗常数的值为NA,则密度ρ为____________ g·cm-3(用含a和NA 的代数式表示)。

(1)已知银(Ag)位于元素周期表第五周期,与Cu同族,则基态Ag的价电子排布式为
(2)下列关于物质结构与性质的说法,正确的是
A.玻尔原子结构模型能够成功地解释各种原子光谱
B.Br、S、O三种元素的电负性顺序为 O>Br>S
C.Na 的第一电离能小于 Mg,但其第二电离能却远大于 Mg
D.水分子间存在氢键,故H2O的熔沸点及稳定性均大于H2S
(3)依据VSEPR理论推测S2O32-的空间构型为
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位键
(4)第一电子亲和能(E1)是指元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量(单位为kJ·mol-1),电子亲和能越大,该元素原子越易得电子。已知第三周期部分元素第一电子亲和能如下表:
| 元素 | Al | Si | P | S | Cl |
| E1(kJ·mol-1) | 42.5 | 134 | 72.0 | 200 | 349 |
表中元素的E1自左而右呈增大趋势,试分析P元素呈现异常的原因
(5)某种离子型铁的氧化物晶胞如下图所示,它由A、B组成。则该氧化物的化学式为:

您最近一年使用:0次



