名校
解题方法
1 . 已知X、Y、Z、W是原子序数依次增大的短周期主族元素,位于三个不同的周期。由X、Y、Z组成的某有机物常用于合成高分子化合物,其结构如下图所示。W原子的最外层电子数比Z多。相关说法正确的是
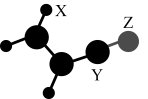

| A.该有机物不能使酸性高锰酸钾溶液褪色 |
| B.电负性:W一定比Z强 |
| C.Z的氢化物熔点一定高于Y的氢化物 |
| D.Y、Z、W可以组成各原子均满足8电子稳定结构的某种微粒 |
您最近半年使用:0次
解题方法
2 . 2022年央视春晚的舞蹈剧《只此青绿》灵感来自北宋卷轴画《千里江山图》,该卷长11.91米,颜色绚丽,由石绿、雌黄、赭石、砗磲、朱砂等颜料绘制而成。颜料中经常含有铜、锌、钛、铁等元素。
(1)写出Zn所在元素周期表中的分区是_______ 区;基态Ti原子的价电子排布式_______ ;基态 核外电子的空间运动状态有
核外电子的空间运动状态有_______ 种,基态铁原子处在最高能层的电子的电子云形状为_______ 。
(2) 、
、 、
、 的键角由大到小的顺序为
的键角由大到小的顺序为_______ 。
(3)一种新研发出的铁磁性材料M的分子结构如图所示。
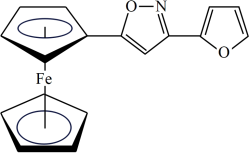
①M分子中C、N、O三种元素的电负性由大到小的顺序为_______ 。
②M分子中 共提供6个杂化轨道,则铁原子可能的杂化方式为
共提供6个杂化轨道,则铁原子可能的杂化方式为_______ (填序号)。
A. B.
B. C.
C.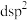 D.
D.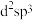
(1)写出Zn所在元素周期表中的分区是
 核外电子的空间运动状态有
核外电子的空间运动状态有(2)
 、
、 、
、 的键角由大到小的顺序为
的键角由大到小的顺序为(3)一种新研发出的铁磁性材料M的分子结构如图所示。

①M分子中C、N、O三种元素的电负性由大到小的顺序为
②M分子中
 共提供6个杂化轨道,则铁原子可能的杂化方式为
共提供6个杂化轨道,则铁原子可能的杂化方式为A.
 B.
B. C.
C.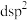 D.
D.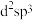
您最近半年使用:0次
解题方法
3 . 立方氮化硼硬度高,耐磨性好,在机械加工行业有广泛应用。制备立方氮化硼的一种方法为BCl3(g)+NH3(g)=BN(s)+3HCl(g),下列说法错误的是
| A.反应混合物中所有化学键均为共价键 |
| B.元素电负性大小为N>B |
| C.BCl3和BN均为共价晶体 |
D.形成BCl3时B原子先激发后杂化,其激发态价电子轨道表示式为: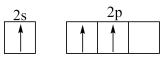 |
您最近半年使用:0次
4 . 依据原子结构知识回答下列问题。
(1)下列说法错误的是_______ 。
A.电负性:Si<H<C<N
B.离子半径: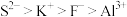
C.原子的未成对电子数: Cr>Mn>Si>Br
D.第二周期中元素原子的第一电离能介于B和N之间的元素有2种
E.前四周期元素中,基态原子中价电子数与其所在周期数相同的元素有4种
(2)基态S原子的价电子轨道表示式为_______ ,其电子占据的最高能层符号为_______ ,其价电子中两种自旋状态的电子数之比为_______ 。
(3)基态F原子核外电子的空间运动状态有_______ 种。下列属于F原子激发态的电子排布式是_______ (填标号,下同),其中能量较高的是_______ 。
A.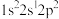 b.
b.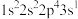 c.
c.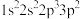 d.
d.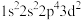
(4)Cr元素位于元素周期表_______ 区。Cr与Mn相比,第二电离能与第一电离能差值更大的是_______ ,原因是_______ 。
(1)下列说法错误的是
A.电负性:Si<H<C<N
B.离子半径:
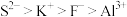
C.原子的未成对电子数: Cr>Mn>Si>Br
D.第二周期中元素原子的第一电离能介于B和N之间的元素有2种
E.前四周期元素中,基态原子中价电子数与其所在周期数相同的元素有4种
(2)基态S原子的价电子轨道表示式为
(3)基态F原子核外电子的空间运动状态有
A.
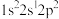 b.
b.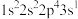 c.
c.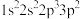 d.
d.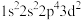
(4)Cr元素位于元素周期表
您最近半年使用:0次
2023-02-11更新
|
409次组卷
|
2卷引用:山东省淄博市2022-2023学年高二上学期期末考试化学试题
22-23高三上·贵州贵阳·期末
解题方法
5 . 铜及其化合物在日常生产、生活中有着广泛的应用。回答下列问题:
(1)基态Cu原子价电子排布式为_______ 。
(2)K与Cu同周期,最外层电子数相同,但Cu的熔点远高于K,因为_______ 。
(3)含铜废液可以利用铜萃取剂M,通过如下反应实现铜离子的富集,进行回收。
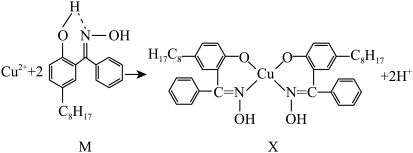
①M所含元素的电负性由大到小顺序是_______ (用元素符号表示)。
②X化合物中中心原子铜的配位数是_______ ,上述反应中断裂和生成的化学键有_______ (填字母序号)。
a.离子键 b.共价键 c.金属键 d.氢键 e.配位键
(4)高温下, 比CuO稳定的原因是
比CuO稳定的原因是_______ 。
(5)离子型配合物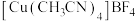 中,阴离子的空间构型为
中,阴离子的空间构型为_______ ,配体中碳原子的杂化方式是_______ 。
(6)由Cu,Sb,Se组成的热电材料,其晶胞结构如图所示, ,
,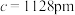 ,该晶体的密度是
,该晶体的密度是_______  (列式即可)
(列式即可)
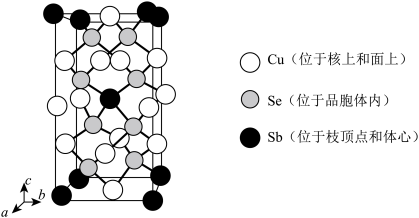
(1)基态Cu原子价电子排布式为
(2)K与Cu同周期,最外层电子数相同,但Cu的熔点远高于K,因为
(3)含铜废液可以利用铜萃取剂M,通过如下反应实现铜离子的富集,进行回收。

①M所含元素的电负性由大到小顺序是
②X化合物中中心原子铜的配位数是
a.离子键 b.共价键 c.金属键 d.氢键 e.配位键
(4)高温下,
 比CuO稳定的原因是
比CuO稳定的原因是(5)离子型配合物
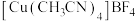 中,阴离子的空间构型为
中,阴离子的空间构型为(6)由Cu,Sb,Se组成的热电材料,其晶胞结构如图所示,
 ,
,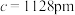 ,该晶体的密度是
,该晶体的密度是 (列式即可)
(列式即可)
您最近半年使用:0次
22-23高三上·山东临沂·期末
名校
6 . 铁、铜及其化合物在生产生活中有着广泛应用。回答下列问题:
(1)基态Fe原子核外电子的空间运动状态有_______ 种;试从结构角度解释 易被氧化为
易被氧化为 的原因
的原因_______ ; 是检验
是检验 的特征试剂,
的特征试剂,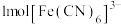 中含有
中含有_______ molσ键。
(2) 可形成
可形成 ,其中en代表
,其中en代表 。该化合物分子中VSEPR模型为四面体的非金属原子共有
。该化合物分子中VSEPR模型为四面体的非金属原子共有_______ 个;en中各元素的电负性由小到大的顺序为_______ 。
(3)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数和晶胞中各原子的投影位置如图所示,晶胞棱边夹角均为90°。
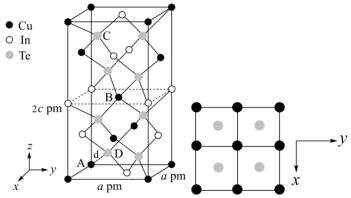
该晶体的化学式为_______ ;A点、B点原子的分数坐标分别为(0,0,0)、( ,
, ,
, ),则C点原子的分数坐标为
),则C点原子的分数坐标为_______ ;晶胞中A、D原子间距离d=_______ cm。
(1)基态Fe原子核外电子的空间运动状态有
 易被氧化为
易被氧化为 的原因
的原因 是检验
是检验 的特征试剂,
的特征试剂,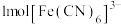 中含有
中含有(2)
 可形成
可形成 ,其中en代表
,其中en代表 。该化合物分子中VSEPR模型为四面体的非金属原子共有
。该化合物分子中VSEPR模型为四面体的非金属原子共有(3)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数和晶胞中各原子的投影位置如图所示,晶胞棱边夹角均为90°。

该晶体的化学式为
 ,
, ,
, ),则C点原子的分数坐标为
),则C点原子的分数坐标为
您最近半年使用:0次
22-23高三上·河北邢台·期末
名校
7 . 短周期主族元素W、X、Y、Z的原子序数依次增大,W的最高正价与最低负价绝对值之差为0,W、X、Y形成的化合物甲的结构如图所示,Z原子M层上有2个未成对电子且此能级无空轨道。下列说法正确的是
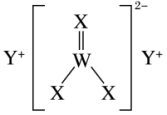

| A.电负性大小:X>W>Z |
| B.简单氢化物的沸点:X>Z |
| C.X、Y形成的化合物只含离子键 |
| D.W和Z最高价氧化物中心原子的杂化方式相同 |
您最近半年使用:0次
8 . 锂离子电池能够成为产业发展方向,主要基于其拥有较高的能量重量比和能量体积比等多项特性,正极材料为钴酸锂、锰酸锂和磷酸亚铁锂材料等。
(1)工业上用 、
、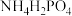 、LiCl及苯胺(
、LiCl及苯胺(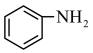 )为原料制备磷酸亚铁锂。基态Cl原子价电子的轨道表示式为
)为原料制备磷酸亚铁锂。基态Cl原子价电子的轨道表示式为_______ ,其在元素周期表中的位置为_______ ,O、N、P的电负性由大到小的顺序为_______ 。
(2)锂离子电池可采用离子液体作为电解质,以下为2种离子液体的结构。
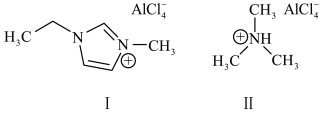
化合物Ⅰ中碳原子的杂化轨道类型为_______ ,1mol化合物Ⅰ中含有_______ 个σ键;化合物Ⅱ中阳离子的空间构型为_______ 。传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是_______ 。
(3)实验室可利用硝酸锰受热分解的方式制备锰的一种氧化物(晶胞结构如图所示)。
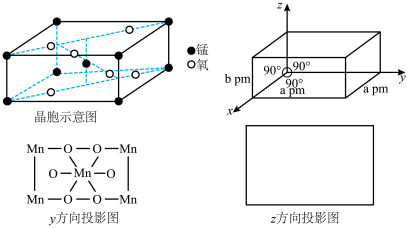
该锰的氧化物中Mn的化合价为_______ ,请画出z方向投影图_______ 。
(1)工业上用
 、
、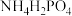 、LiCl及苯胺(
、LiCl及苯胺( )为原料制备磷酸亚铁锂。基态Cl原子价电子的轨道表示式为
)为原料制备磷酸亚铁锂。基态Cl原子价电子的轨道表示式为(2)锂离子电池可采用离子液体作为电解质,以下为2种离子液体的结构。

化合物Ⅰ中碳原子的杂化轨道类型为
(3)实验室可利用硝酸锰受热分解的方式制备锰的一种氧化物(晶胞结构如图所示)。

该锰的氧化物中Mn的化合价为
您最近半年使用:0次
9 . 现有四种元素的基态原子的核外电子排布式如下:① ;②
;② ;③
;③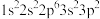 ;④
;④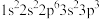 。下列说法错误的是
。下列说法错误的是
 ;②
;② ;③
;③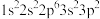 ;④
;④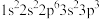 。下列说法错误的是
。下列说法错误的是| A.电负性:②>①>④>③ |
| B.原子半径:③>④>①>② |
| C.简单气态氢化物的稳定性:①>②>③>④ |
| D.第一电离能:①>②>④>③ |
您最近半年使用:0次
2023-01-13更新
|
318次组卷
|
3卷引用:山东省临沂第一中学2021-2022学年高二上学期期末检测化学试题
名校
10 . Y、Z、M、N是同一短周期元素,其中Y的一种同位素常用作推算生物体的死亡年代,X的原子半径是元素周期表中最小的,它们形成的某化合物可作离子液体,结构如图所示,下列说法错误的是
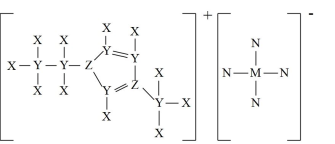

| A.电负性:N>Z>Y>M>X |
| B.原子半径:M>Y>Z>N |
| C.简单氢化物沸点:N>Z>Y |
| D.M最高价氧化物的水化物为一元弱酸 |
您最近半年使用:0次



