名校
1 . 如图为一种饲料添加剂的结构。X、Y、Z三种元素占据相邻的两个周期,Z是宇宙中含量最多的元素,下列说法错误的是


| A.电负性:Y>X>Z |
| B.X、Y元素的简单气态氢化物沸点:Y>X |
| C.Y与Z形成的化合物都只含极性共价键 |
| D.X、Y、Z三种元素既可形成离子化合物,又可形成共价化合物 |
您最近一年使用:0次
2023-01-11更新
|
297次组卷
|
5卷引用:山东省日照市2022-2023学年高三上学期期末校际考试化学试题
山东省日照市2022-2023学年高三上学期期末校际考试化学试题(已下线)山东省济南市2022届高三3月高考模拟考试(一模)(选择题1-5)山东省日照市2022-2023学年高三上学期期末校际联合考试化学试题(已下线)山东省青岛市2023届高三下学期一模化学试题变式题(选择题1-5)福建省福州高级中学2023-2024学年高三第二次阶段考试化学试题
名校
2 . 硒化物(如KCu4Se8)可用于太阳能电池、光传感器、热电发电与制冷等。回答下列问题:
(1)K与Cu位于同周期,金属钾的熔点比铜的低,这是因为___________ 。
(2)O、S、Se均位于元素周期表第ⅥA族,它们的氢化物H2O、H2S及H2Se分子的键角从大到小顺序为___________ 。
(3)配合物[Cu(CH3CN)4]BF4中,阴离子的空间构型为___________ ,配合离子中与Cu(Ⅱ)形成配位键的原子是___________ ,配体中碳原子的杂化方式是___________ 。
(4)TMTSF( )中共价键的类型是
)中共价键的类型是___________ 。
(1)K与Cu位于同周期,金属钾的熔点比铜的低,这是因为
(2)O、S、Se均位于元素周期表第ⅥA族,它们的氢化物H2O、H2S及H2Se分子的键角从大到小顺序为
(3)配合物[Cu(CH3CN)4]BF4中,阴离子的空间构型为
(4)TMTSF(
 )中共价键的类型是
)中共价键的类型是
您最近一年使用:0次
名校
3 . 联合国将2019年定为“国际化学元素周期表年”。元素周期表前四周期的元素a、b、c、d、e、f的原子序数依次增大。a、b、d的价电子层中未成对电子均只有1个,a的基态原子核外有3种不同能量的电子,b、d的单质均能与水剧烈反应,b-和d+核外电子数相差8,c的最外层电子数为其电子层数的2倍,补充维生素D可促进人体对元素e的吸收,f的价电子层中的未成对电子数为4.回答下列问题:
(1)a、b、c的电负性由小到大的顺序为___________ (用元素符号表示)。基态f原子的核外电子排布式为___________ 。
(2)ab3分子中心原子的杂化方式为___________ ,其键角为___________ 。
(3)c的简单氢化物与同族相邻两种元素所形成的简单氢化物沸点由高到低的顺序为___________ (用化学式表示),理由:___________ 。
(4)CO与f形成的f(CO)5常温下是一种浅黄色液体,f(CO)5的空间构型为___________ ,提供孤电子对的原子是___________ (填元素符号),CO分子中σ键与π键数目之比为___________ 。
(1)a、b、c的电负性由小到大的顺序为
(2)ab3分子中心原子的杂化方式为
(3)c的简单氢化物与同族相邻两种元素所形成的简单氢化物沸点由高到低的顺序为
(4)CO与f形成的f(CO)5常温下是一种浅黄色液体,f(CO)5的空间构型为
您最近一年使用:0次
4 . 绿柱石(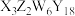 )是一种重要的矿物。X、Y、Z、W为短周期元素,原子序数依次增加,且价电子数和为15,X、Z、W处于相邻的主族,
)是一种重要的矿物。X、Y、Z、W为短周期元素,原子序数依次增加,且价电子数和为15,X、Z、W处于相邻的主族, 和
和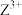 的电荷与半径之比相近,导致两元素性质相似。下列说法正确的是
的电荷与半径之比相近,导致两元素性质相似。下列说法正确的是
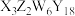 )是一种重要的矿物。X、Y、Z、W为短周期元素,原子序数依次增加,且价电子数和为15,X、Z、W处于相邻的主族,
)是一种重要的矿物。X、Y、Z、W为短周期元素,原子序数依次增加,且价电子数和为15,X、Z、W处于相邻的主族, 和
和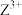 的电荷与半径之比相近,导致两元素性质相似。下列说法正确的是
的电荷与半径之比相近,导致两元素性质相似。下列说法正确的是| A.第一电离能:Z<W,第二电离能:Z>W |
| B.原子半径:Z>W>Y>X |
C.XY是碱性氧化物, 是酸性氧化物 是酸性氧化物 |
| D.已知W、Y都可与氢气生成氢化物,电负性Y>W>H |
您最近一年使用:0次
2022-12-27更新
|
593次组卷
|
4卷引用:山东省潍坊市2022年12月高三优生学习质量检测化学试题
21-22高三上·甘肃白银·阶段练习
名校
5 . 某离子化合物(如图所示)广泛应用于电镀工艺,Q、X、Y、W、Z为原子序数依次增大的短周期元素,Y原子核外电子数是Z原子核外电子数的一半。下列叙述正确的是
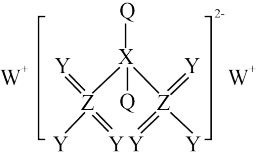

| A.Y元素单质的熔点高于W |
| B.元素电负性大小的顺序为Y>Z>Q>X |
| C.这五种元素分别位于4个不同主族 |
| D.化合物XZ2的空间构型为直线形 |
您最近一年使用:0次
2022-12-20更新
|
428次组卷
|
6卷引用:山东省济南市2022届高三3月高考模拟考试(一模)(选择题1-5)
(已下线)山东省济南市2022届高三3月高考模拟考试(一模)(选择题1-5)山东省济宁市第一中学2022-2023学年高二下学期期中考试化学试题甘肃省会宁县第三中学2021-2022学年高三上学期第三次月考化学试题江苏省扬州中学2022-2023学年高三下学期3月月考化学试题辽宁省锦州市渤海大学附属高级中学2023-2024学年高三上学期第三次考试化学试题(已下线)选择题11-14
6 . 某阴离子结构式如图所示。W、X、Y、Z为原子序数依次增大的同一短周期元素,X原子的最外层电子数等于其电子层数的2倍。下列说法错误的是
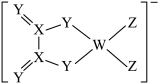

| A.电负性:Z>Y>X |
| B.简单氢化物沸点:Y<Z |
| C.最高价氧化物水化物的酸性:X>W |
| D.该阴离子中所有原子均满足最外层8电子稳定结构 |
您最近一年使用:0次
2022-12-16更新
|
185次组卷
|
3卷引用:山东省淄博市2022-2023学年高三上学期12月月考化学试题
山东省淄博市2022-2023学年高三上学期12月月考化学试题山东省淄博实验中学2022-2023学年高三上学期12月份摸底考试化学试题(已下线)山东省济南市2022届高三3月高考模拟考试(一模)(选择题1-5)
名校
解题方法
7 . 原子序数依次增大的X、Y、Z、Q、W五种短周期主族元素,X、W同族,Y、Z、Q同周期;离子化合物M由这五种元素组成,M的结构如图所示,下列叙述正确的是
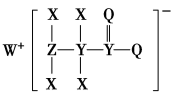
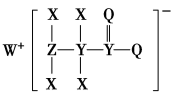
| A.最高价氧化物对应水化物的酸性:Y>Z |
| B.电负性:Z>Q>Y |
| C.常温下,M水溶液pH<7 |
| D.X分别与Y、Z、W形成的二元化合物均可在空气中燃烧 |
您最近一年使用:0次
解题方法
8 . A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是_____ (填元素符号),其中C原子的核外电子排布式为_____ 。
(2)单质A有两种同素异形体,其中沸点高的是_____ (填分子式);A和B的氢化物所属的晶体类型分别为_____ 和_____ 。
(3)C和D反应可生成组成比为1︰3的化合物E,E的立体构型为_____ ,中心原子的杂化轨道类型为_____ 。
(4)化合物D2A的中心原子的价层电子对数为_____ ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为_____ 。
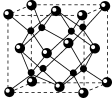
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为_____ ;晶胞中A原子的配位数为_____ 。
(1)四种元素中电负性最大的是
(2)单质A有两种同素异形体,其中沸点高的是
(3)C和D反应可生成组成比为1︰3的化合物E,E的立体构型为
(4)化合物D2A的中心原子的价层电子对数为
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为

您最近一年使用:0次
名校
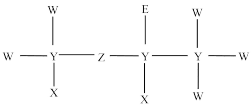
9 . 短周期元素原子组成的某种分子的结构式如图所示。X原子的核外电子只有一种运动状态;W、Y、Z位于同一周期,Z元素原子中p轨道所含电子数与s轨道相等。E与W有相同数目的价电子,下列说法正确的是

| A.电负性:X<Y<W |
| B.简单阴离子半径:W<Z<E |
| C.同周期中,第一电离能大于Z的元素有2种 |
| D.同主族元素中,E形成的气态氢化物最稳定 |
您最近一年使用:0次
2022-12-03更新
|
307次组卷
|
3卷引用:山东省临沂市临沭第一中学2022-2023学年高三上学期11月月考化学试题
山东省临沂市临沭第一中学2022-2023学年高三上学期11月月考化学试题(已下线)河北省部分学校2022-2023学年高三上学期期末考试变式汇编(10-13)山东省潍坊市昌乐第一中学2022-2023学年高二上学期期末拉练二化学试题
解题方法
10 . 大部分非金属元素分布在元素周期表的p区,非金属元素数量虽少,却构成了丰富的物质世界。回答下列问题:
(1)基态 原子的价电子排布式为
原子的价电子排布式为_______ , 、
、 、
、 的沸点由高到低的顺序依次为
的沸点由高到低的顺序依次为_______ 。
(2)超强酸“魔酸”是五氟化锑(SbF5))和氟磺酸(HSO3F)的混合物, 与
与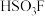 的结构如图:
的结构如图:

 中
中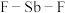 键的键角的度数分别为
键的键角的度数分别为_______ ,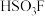 中所含元素电负性由大到小的顺序是
中所含元素电负性由大到小的顺序是_______ 。
(3)苯(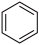 )和吡啶(
)和吡啶( )结构相似,均具有芳香性。分子中的离域
)结构相似,均具有芳香性。分子中的离域 键可用符号
键可用符号 表示,其中m代表参与形成离域
表示,其中m代表参与形成离域 键的原子数,n代表参与形成离域
键的原子数,n代表参与形成离域 键的电子数(如苯分子中的离域
键的电子数(如苯分子中的离域 键可表示为
键可表示为 ,则
,则 中的离域
中的离域 键可表示为
键可表示为_______ ,N原子采用杂化_______ 。
(4)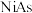 晶体有明显的金属性,是一种合金。
晶体有明显的金属性,是一种合金。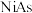 的晶体结构如图所示,六方晶胞底边长为
的晶体结构如图所示,六方晶胞底边长为 、高为
、高为 。晶胞中
。晶胞中 的分数坐标(
的分数坐标( ,
, ,
, )。
)。
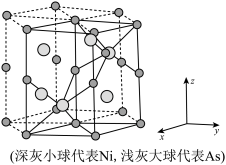
 原子的配位数
原子的配位数_______ ,晶胞中 的分数坐标
的分数坐标_______ ,晶胞密度为_______  。
。
(1)基态
 原子的价电子排布式为
原子的价电子排布式为 、
、 、
、 的沸点由高到低的顺序依次为
的沸点由高到低的顺序依次为(2)超强酸“魔酸”是五氟化锑(SbF5))和氟磺酸(HSO3F)的混合物,
 与
与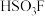 的结构如图:
的结构如图:
 中
中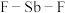 键的键角的度数分别为
键的键角的度数分别为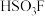 中所含元素电负性由大到小的顺序是
中所含元素电负性由大到小的顺序是(3)苯(
 )和吡啶(
)和吡啶( )结构相似,均具有芳香性。分子中的离域
)结构相似,均具有芳香性。分子中的离域 键可用符号
键可用符号 表示,其中m代表参与形成离域
表示,其中m代表参与形成离域 键的原子数,n代表参与形成离域
键的原子数,n代表参与形成离域 键的电子数(如苯分子中的离域
键的电子数(如苯分子中的离域 键可表示为
键可表示为 ,则
,则 中的离域
中的离域 键可表示为
键可表示为(4)
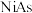 晶体有明显的金属性,是一种合金。
晶体有明显的金属性,是一种合金。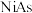 的晶体结构如图所示,六方晶胞底边长为
的晶体结构如图所示,六方晶胞底边长为 、高为
、高为 。晶胞中
。晶胞中 的分数坐标(
的分数坐标( ,
, ,
, )。
)。
 原子的配位数
原子的配位数 的分数坐标
的分数坐标 。
。
您最近一年使用:0次



