1 . 短周期元素X、Y、Z、W、E原子核外电子数依次增多。X的原子半径是短周期元素中最小的;Y、Z、W位于同一周期,Z元素基态原子中p轨道所含电子数与s轨道相等;E与W同主族。它们组成的某种分子的结构式如图所示,下列说法正确的是


| A.简单阴离子半径:Z<W<E |
| B.同主族元素中E的最高价氧化物对应水化物的酸性最强 |
| C.电负性:Y<Z<E |
D.离子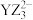 的中心原子的杂化方式是sp2杂化 的中心原子的杂化方式是sp2杂化 |
您最近一年使用:0次
2 . 铁、铜及其化合物在生产生活中有着广泛应用。回答下列问题:
(1)基态Fe原子核外电子的空间运动状态有_______ 种;试从结构角度解释 易被氧化为
易被氧化为 的原因
的原因_______ ; 是检验
是检验 的特征试剂,
的特征试剂,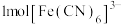 中含有
中含有_______ molσ键。
(2) 可形成
可形成 ,其中en代表
,其中en代表 。该化合物分子中,
。该化合物分子中, 的配位数为
的配位数为_______ ;VSEPR模型为四面体的非金属原子共有_______ 个;en中各元素的电负性由小到大的顺序为_______ 。
(3)一种由Cu、In,Te组成的晶体属四方晶系,晶胞参数和晶胞中各原子的投影位置如图所示,晶胞棱边夹角均为90°。
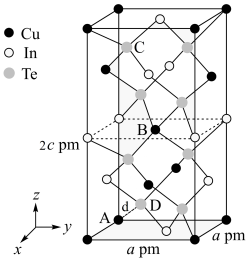
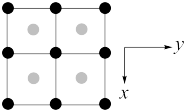
该晶体的化学式为_______ ;A点、B点原子的分数坐标分别为(0,0,0)、( ,
, ,
, ),则C点原子的分数坐标为
),则C点原子的分数坐标为_______ ;晶胞中A、D原子间距离d=_______ cm。
(1)基态Fe原子核外电子的空间运动状态有
 易被氧化为
易被氧化为 的原因
的原因 是检验
是检验 的特征试剂,
的特征试剂,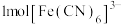 中含有
中含有(2)
 可形成
可形成 ,其中en代表
,其中en代表 。该化合物分子中,
。该化合物分子中, 的配位数为
的配位数为(3)一种由Cu、In,Te组成的晶体属四方晶系,晶胞参数和晶胞中各原子的投影位置如图所示,晶胞棱边夹角均为90°。


该晶体的化学式为
 ,
, ,
, ),则C点原子的分数坐标为
),则C点原子的分数坐标为
您最近一年使用:0次
2022-09-11更新
|
375次组卷
|
2卷引用:山东省临沂市2022-2023学年高三上学期开学摸底考试化学试题
名校
3 . 光气( )是一种重要的有机中间体。利用反应可
)是一种重要的有机中间体。利用反应可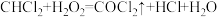 用于制备光气。下列有关叙述正确的是
用于制备光气。下列有关叙述正确的是
 )是一种重要的有机中间体。利用反应可
)是一种重要的有机中间体。利用反应可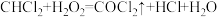 用于制备光气。下列有关叙述正确的是
用于制备光气。下列有关叙述正确的是A.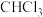 为非极性分子 为非极性分子 | B. 的电子式为 的电子式为 |
C. 、 、 分子间均能形成氢键 分子间均能形成氢键 | D.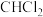 中电负性最小的元素是Cl 中电负性最小的元素是Cl |
您最近一年使用:0次
2022-08-17更新
|
105次组卷
|
3卷引用:山东省滨州市沾化区实验高级中学2022-2023学年高三上学期开学考试化学试题
名校
解题方法
4 . 最近合成的一种铁基超导材料CaxFeyAsz(相对分子质量为M),在低温高压下能显示出独特的电子性质,晶胞结构如图所示,回答下列问题:
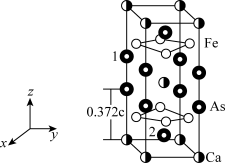
(1)基态As原子价电子排布式为_______ 。
(2)As、Fe、Ca电负性由大到小的顺序为_______ 。FeCl3的沸点(319°C)高于AsCl3的沸点(130.2°C),原因是_______ 。
(3)该材料的化学式为_______ ,已知:体心的Ca原子与顶点的Ca原子有着相同的化学环境(化学环境受周围粒子的数目与距离所影响),该晶胞的晶胞参数为apm、apm、cpm,晶胞中As原子1和As原子2的分数坐标分别为_______ 、_______ 。
(4)设阿伏加德罗常数为NA,则该晶体的密度为_______ g·cm-3(用含M的代数式表示)。

(1)基态As原子价电子排布式为
(2)As、Fe、Ca电负性由大到小的顺序为
(3)该材料的化学式为
(4)设阿伏加德罗常数为NA,则该晶体的密度为
您最近一年使用:0次
2022-05-21更新
|
451次组卷
|
3卷引用:山东省济南第一中学2023届高三上学期开学考试化学试题
名校
解题方法
5 . 某锂盐的结构如图所示,其阴离子是由原子序数依次增大的短周期主族元素X、Y,Z、W形成,X,Y与Z同一周期,Y与W同族。下列说法正确的是( )
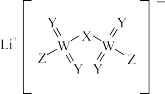
A.元素的电负性: | B.第一电离能: |
C.简单气态氢化物的热稳定性: | D.简单离子的半径: |
您最近一年使用:0次
2022-05-05更新
|
2596次组卷
|
17卷引用:山东省济南第一中学2023届高三上学期开学考试化学试题
山东省济南第一中学2023届高三上学期开学考试化学试题山东省济南市2022届高三第二次模拟化学试题安徽省怀宁中学2021-2022学年高二下学期5月阶段考试化学试题黑龙江省大兴安岭实验中学2023-2024学年高二下学期开学考试化学试卷山东省临沂市平邑县第一中学西校区2023-2024学年高二上学期1月份阶段性考试化学试题辽宁省沈阳市第十中学2022-2023学年高二上学期期末综合测评化学试题新疆乌鲁木齐市第八中学2022-2023学年高二上学期期末考试化学试题贵州省江口中学2022-2023学年高二下学期3月份月考化学试题第一章 原子结构与性质(B卷·能力提升练)-2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修2)云南省楚雄彝族自治州民族中学2022-2023学年高二下学期5月月考化学试题(已下线)2023年湖南卷高考真题变式题(选择题6-10)(已下线)选择题1-5湖南省邵阳市武冈市2023-2024学年高三上学期期中考试化学试题河南省驻马店市确山县第一高级中学2023~2024学年高二上学期第二次月考化学试题河北省沧州市泊头市第一中学2023-2024学年高二上学期12月月考化学试题宁夏石嘴山市第三中学2023-2024学年高二下学期3月月考化学试题2024届安徽省六安第一中学高三下学期质量检测(三 )化学试题
名校
6 . 钛硅分子筛是一种新型固体催化剂,可催化合成重要有机合成活性试剂甲乙酮肟(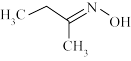 )。回答下列问题:
)。回答下列问题:
(1)基态硅原子的核外电子空间运动状态有____ 种。
(2)甲乙酮肟中同周期三种元素电负性由大到小的顺序为____ ,氮原子的杂化方式为____ ,C=N与C—C键夹角____ (填“<”“>”或“=”)C=N与N—O键夹角。
(3)TiO2和TiCl4均是制备钛硅分子筛的重要中间体。
①TiO2与光气COCl2反应可用于制取四氯化钛。COCl2中σ键和π键的数目比为____ ,其空间构型为____ 。
②TiCl4与金属Ti在高温条件下可反应生成TiCl3,TiCl3中Ti3+极易被氧化,还原性很强。试解释Ti3+还原性强的原因____ 。
(4)研究表明,在TiO2通过氮掺杂反应生成TiO2-mNn,能使TiO2对可见光具有活性,反应如图所示。

若TiO2晶体密度为ρg·cm-3,则阿伏加德罗常数的值NA=____ ,TiO2-mNn晶体中m=____ 。
 )。回答下列问题:
)。回答下列问题:(1)基态硅原子的核外电子空间运动状态有
(2)甲乙酮肟中同周期三种元素电负性由大到小的顺序为
(3)TiO2和TiCl4均是制备钛硅分子筛的重要中间体。
①TiO2与光气COCl2反应可用于制取四氯化钛。COCl2中σ键和π键的数目比为
②TiCl4与金属Ti在高温条件下可反应生成TiCl3,TiCl3中Ti3+极易被氧化,还原性很强。试解释Ti3+还原性强的原因
(4)研究表明,在TiO2通过氮掺杂反应生成TiO2-mNn,能使TiO2对可见光具有活性,反应如图所示。

若TiO2晶体密度为ρg·cm-3,则阿伏加德罗常数的值NA=
您最近一年使用:0次
2022-02-25更新
|
342次组卷
|
4卷引用:山东省烟台第二中学2021-2022学年高三下学期开年摸底联考化学试题
山东省烟台第二中学2021-2022学年高三下学期开年摸底联考化学试题湖南省百师联盟2021-2022学年高三下学期开年摸底联考化学试题山西省吕梁市2021-2022学年高三下学期开学考试理综化学试题(已下线)河北省石家庄市2022届高三毕业班教学质量检测二(一模)(结构与性质)
名校
7 . R、X、Y、Z、W为原子序数依次增大的短周期主族元素,且Y、Z位于同主族。由R、X、Y、Z组成的有机物M是日用化妆品冷烫精的主要原料,其结构如图所示。下列说法正确的是


| A.电负性:Y>Z>R>X |
| B.XZ2、XW4、XR4都是非极性分子 |
| C.简单离子结合质子能力:W>Z |
| D.1molM含7molσ键 |
您最近一年使用:0次
2022-02-20更新
|
516次组卷
|
3卷引用:山东省大教育联盟学校2021-2022高三下学期收心考试(开学考试)化学试题
解题方法
8 . 我国科学家借助自主研制的新型钨钴铁合金催化剂攻克了单壁碳纳米管结构的可控制备难题。海底金属软泥是在海底覆盖着的一层红棕色沉积物,蕴藏着大量的金属资源, 含有钨、铁、锰、锌、钴等金属元素。
(1)基态钴原子的价电子排布图为___________ 。单壁碳纳米管可看作石墨烯沿一定方向卷曲而成的空心圆柱体,其碳原子的杂化方式为___________ 。
(2)纳米结构氧化钴可在室温下将甲硫醛(CH2S)完全催化氧化,甲硫醛分子属___________ (填“极性”或“非极性”)分子,其中心原子的VSEPR模型名称为___________ 。
(3)六羰基钨[W(CO)6]的熔点为172 ℃,是一种重要的无机金属配合物,可溶于大多数有机溶剂。三种组成元素的电负性由大到小的顺序为___________ (用元素符号表示)。配体CO中与W形成配位键的原子是C而不是O,原因是___________ 。
(4)多原子分子中各原子若在同一平面内,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”。下列物质中存在“离域π键”的是___________(填字母)。
(1)基态钴原子的价电子排布图为
(2)纳米结构氧化钴可在室温下将甲硫醛(CH2S)完全催化氧化,甲硫醛分子属
(3)六羰基钨[W(CO)6]的熔点为172 ℃,是一种重要的无机金属配合物,可溶于大多数有机溶剂。三种组成元素的电负性由大到小的顺序为
(4)多原子分子中各原子若在同一平面内,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”。下列物质中存在“离域π键”的是___________(填字母)。
| A.苯 | B.二氧化硫 |
| C.四氯化碳 | D.环己烷 |
您最近一年使用:0次
名校
解题方法
9 . 在碱性溶液中,Cu2+可以与缩二脲形成紫色配离子,其结构如图所示。下列说法错误的是
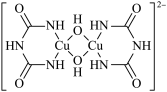

| A.该配离子与水分子形成氢键的原子只有N和O |
| B.该配离子中铜离子的配位数是4 |
| C.基态Cu原子的价电子排布式是 3d104s1 |
| D.该配离子中非金属元素的电负性大小顺序为O>N>C>H |
您最近一年使用:0次
2021-04-29更新
|
905次组卷
|
19卷引用:山东省菏泽市单县二中2021-2022学年高二下学期开学考试 化学试题
山东省菏泽市单县二中2021-2022学年高二下学期开学考试 化学试题(已下线)押山东卷第04题 物质结构与性质选择题-备战2021年高考化学临考题号押题(山东卷)山东省滨州市无棣县2020-2021学年高二下学期期中考试化学试题(已下线)卷14 物质结构与性质选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)浙江金华第一中学2021-2022学年高二下学期期中考试化学试题第三章 本章达标检测2北京市海淀实验中学2022-2023学年高三上学期10月学科展示化学试题(已下线)专题十 物质结构与性质(选择性必修2)能力提升检测卷(测)-2023年高考化学一轮复习讲练测(新教材新高考)江西省景德镇一中2022-2023学年高二上学期期中考试化学试题湖北省2021年普通高中学业水平选择考适应性测试化学试题(已下线)解密13 物质结构与性质(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练河北省石家庄市第二中学2021届高三3月学情考试化学试题湖北武汉市蔡甸区汉阳一中2020-2021学年高二下学期3月月考化学试题辽宁省实验中学东戴河分校两校2020-2021学年高二4月联考化学试题四川省成都市树德中学2020-2021学年高二下学期4月月考化学试题河北省石家庄市第二十四中学2020-2021学年高二第二学期期中考试化学试题福建省连城县第一中学2021-2022学年高三上学期10月月考化学试题(已下线)专题33 物质结构与性质基础-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)第7讲 配合物与超分子



