解题方法
1 . 立方氮化硼硬度高,耐磨性好,在机械加工行业有广泛应用。制备立方氮化硼的一种方法为BCl3(g)+NH3(g)=BN(s)+3HCl(g),下列说法错误的是
| A.反应混合物中所有化学键均为共价键 |
| B.元素电负性大小为N>B |
| C.BCl3和BN均为共价晶体 |
D.形成BCl3时B原子先激发后杂化,其激发态价电子轨道表示式为: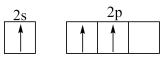 |
您最近一年使用:0次
2 . 现有四种元素的基态原子的核外电子排布式如下:① ;②
;② ;③
;③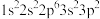 ;④
;④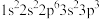 。下列说法错误的是
。下列说法错误的是
 ;②
;② ;③
;③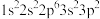 ;④
;④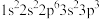 。下列说法错误的是
。下列说法错误的是| A.电负性:②>①>④>③ |
| B.原子半径:③>④>①>② |
| C.简单气态氢化物的稳定性:①>②>③>④ |
| D.第一电离能:①>②>④>③ |
您最近一年使用:0次
2023-01-13更新
|
320次组卷
|
3卷引用:山东省临沂第一中学2021-2022学年高二上学期期末检测化学试题
3 . 某阴离子结构式如图所示。W、X、Y、Z为原子序数依次增大的同一短周期元素,X原子的最外层电子数等于其电子层数的2倍。下列说法错误的是
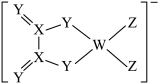

| A.电负性:Z>Y>X |
| B.简单氢化物沸点:Y<Z |
| C.最高价氧化物水化物的酸性:X>W |
| D.该阴离子中所有原子均满足最外层8电子稳定结构 |
您最近一年使用:0次
2022-12-16更新
|
185次组卷
|
3卷引用:山东省淄博市2022-2023学年高三上学期12月月考化学试题
山东省淄博市2022-2023学年高三上学期12月月考化学试题山东省淄博实验中学2022-2023学年高三上学期12月份摸底考试化学试题(已下线)山东省济南市2022届高三3月高考模拟考试(一模)(选择题1-5)
解题方法
4 . 硅电池、锂离子电池都是现代高性能电池的代表,高性能的电极材料与物质结构密切相关。
(1)LiFePO4因具有良好的结构稳定性而成为新一代正极材料,这与 的结构密切相关,
的结构密切相关, 的空间结构为
的空间结构为_______ 。P、O、S的电负性从大到小的顺序为_______ 。
(2)通常在电极材料表面进行“碳”包覆处理以增强其导电性。抗坏血酸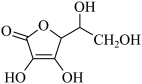 常被用作碳包覆的碳源,其易溶于水的原因是
常被用作碳包覆的碳源,其易溶于水的原因是_______ ,抗坏血酸中碳原子的杂化方式为_______ ,1 mol抗坏血酸中手性碳原子的数目为_______ 。
(3)目前最常用的电极材料有锂钴复合氧化物和石墨。
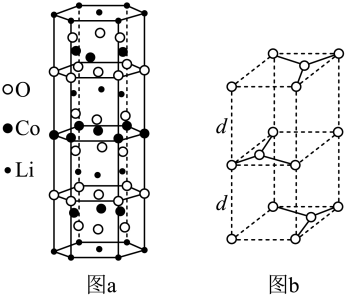
①锂钴复合氧化物中Li、Co、O分别形成了六边层状结构(图a),按照Li−O−Co−O−Li−O−Co−O−Li……顺序排列,则该化合物的化学式为_______ ,Co3+的价层电子排布式为_______ 。
②石墨晶胞(图b)层间距为d pm,C−C键长为a pm,石墨晶体的密度为ρ g·cm−3,列式表示阿伏加德罗常数为_______ mol−l。
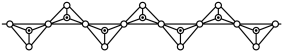
(4)硅酸盐中Si元素一般显+4价,如下图所示是一种无限长单键的多聚硅酸根离子的结构,其中“ ”表示Si原子,“o”表示氧原子,则该长链硅酸根离子的通式为
”表示Si原子,“o”表示氧原子,则该长链硅酸根离子的通式为_______ 。
(1)LiFePO4因具有良好的结构稳定性而成为新一代正极材料,这与
 的结构密切相关,
的结构密切相关, 的空间结构为
的空间结构为(2)通常在电极材料表面进行“碳”包覆处理以增强其导电性。抗坏血酸
 常被用作碳包覆的碳源,其易溶于水的原因是
常被用作碳包覆的碳源,其易溶于水的原因是(3)目前最常用的电极材料有锂钴复合氧化物和石墨。

①锂钴复合氧化物中Li、Co、O分别形成了六边层状结构(图a),按照Li−O−Co−O−Li−O−Co−O−Li……顺序排列,则该化合物的化学式为
②石墨晶胞(图b)层间距为d pm,C−C键长为a pm,石墨晶体的密度为ρ g·cm−3,列式表示阿伏加德罗常数为
(4)硅酸盐中Si元素一般显+4价,如下图所示是一种无限长单键的多聚硅酸根离子的结构,其中“
 ”表示Si原子,“o”表示氧原子,则该长链硅酸根离子的通式为
”表示Si原子,“o”表示氧原子,则该长链硅酸根离子的通式为
您最近一年使用:0次
名校
5 . 光气( )是一种重要的有机中间体。利用反应可
)是一种重要的有机中间体。利用反应可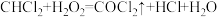 用于制备光气。下列有关叙述正确的是
用于制备光气。下列有关叙述正确的是
 )是一种重要的有机中间体。利用反应可
)是一种重要的有机中间体。利用反应可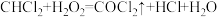 用于制备光气。下列有关叙述正确的是
用于制备光气。下列有关叙述正确的是A.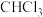 为非极性分子 为非极性分子 | B. 的电子式为 的电子式为 |
C. 、 、 分子间均能形成氢键 分子间均能形成氢键 | D. 中电负性最小的元素是Cl 中电负性最小的元素是Cl |
您最近一年使用:0次
2022-08-17更新
|
105次组卷
|
3卷引用:山东省滨州市沾化区实验高级中学2022-2023学年高三上学期开学考试化学试题
6 . 硒( )是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(
)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光( )效应以来,
)效应以来, 在发光材料、生物医学等领域引起广泛关注。一种含
在发光材料、生物医学等领域引起广泛关注。一种含 的新型
的新型 分子
分子 的合成路线如下:
的合成路线如下: 与S同族,基态硒原子价电子排布式为
与S同族,基态硒原子价电子排布式为_______ 。
(2) 的沸点低于
的沸点低于 ,其原因是
,其原因是_______ 。
(3)关于I~III三种反应物,下列说法正确的有_______ 。
A.I中仅有 键
键
B.I中的 键为非极性共价键
键为非极性共价键
C.II易溶于水
D.II中原子的杂化轨道类型只有 与
与
E.I~III含有的元素中,O电负性最大
(4)IV中具有孤对电子的原子有_______ 。
(5)硒的两种含氧酸的酸性强弱为
_______  (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠( )可减轻重金属铊引起的中毒。
)可减轻重金属铊引起的中毒。 的立体构型为
的立体构型为_______ 。
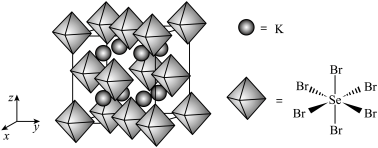
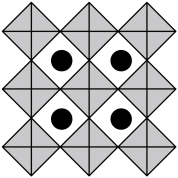
(6)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。_______ 。
②设X的最简式的式量为 ,晶体密度为
,晶体密度为 ,则X中相邻K之间的最短距离为
,则X中相邻K之间的最短距离为_______  (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 )是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(
)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光( )效应以来,
)效应以来, 在发光材料、生物医学等领域引起广泛关注。一种含
在发光材料、生物医学等领域引起广泛关注。一种含 的新型
的新型 分子
分子 的合成路线如下:
的合成路线如下: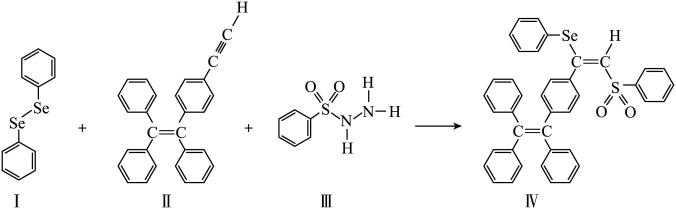
 与S同族,基态硒原子价电子排布式为
与S同族,基态硒原子价电子排布式为(2)
 的沸点低于
的沸点低于 ,其原因是
,其原因是(3)关于I~III三种反应物,下列说法正确的有
A.I中仅有
 键
键B.I中的
 键为非极性共价键
键为非极性共价键C.II易溶于水
D.II中原子的杂化轨道类型只有
 与
与
E.I~III含有的元素中,O电负性最大
(4)IV中具有孤对电子的原子有
(5)硒的两种含氧酸的酸性强弱为

 (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠( )可减轻重金属铊引起的中毒。
)可减轻重金属铊引起的中毒。 的立体构型为
的立体构型为(6)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。
②设X的最简式的式量为
 ,晶体密度为
,晶体密度为 ,则X中相邻K之间的最短距离为
,则X中相邻K之间的最短距离为 (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
2022-06-10更新
|
12460次组卷
|
28卷引用:山东省菏泽市单县二中2021-2022学年高二下学期期末测试化学试题
山东省菏泽市单县二中2021-2022学年高二下学期期末测试化学试题2022年新高考广东化学高考真题(已下线)2022年广东卷高考真题变式题(17-21)(已下线)专题17 物质结构与性质(综合题)-2022年高考真题模拟题分项汇编(已下线)专题18 物质结构与性质(综合题)-三年(2020-2022)高考真题分项汇编(已下线)第19练 物质结构与性质综合题难点突破-2022年【暑假分层作业】高二化学(2023届一轮复习通用)山西省晋城市第一中学2022-2023学年高三上学期第五次调研考试化学试题山东省日照神州天立高级中学高复部2023-2024学年高三上学期12月份阶段性测试化学试题(已下线)专题九 物质结构与性质-实战高考·二轮复习核心突破(已下线)第一部分 二轮专题突破 大题突破4 物质结构与性质大题研究(选考)(已下线)题型11 物质结构与性质的综合分析与推断(已下线)回归教材重难点12 原子、分子和晶体结构再归纳-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)广东省广州中学2022-2023学年高二下学期期中考试化学试题江西省景德镇一中2022-2023学年高二下学期期中考试(19班)化学试题河南省淮滨高级中学2022-2023学年高二下学期期中教学质量检测化学试题(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)第21练 物质结构与性质综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)T35-物质结构与性质(已下线)专题17 物质结构与性质综合题-2023年高考化学真题题源解密(新高考专用)河南省信阳市第十高级中学2022-2023学年高二下学期期中教学质量检测化学试卷广东省汕头市金禧中学2023-024学年高三上学期第一次阶段考试化学试题上海市实验学校2023-2024学年高三上学期第一次月考化学试题四川省眉山市仁寿第一中学校(北校区)2023-2024学年高三上学期11月期中考试理综化学试题北京市东直门中学2023-2024学年高三上学期12月阶段测试化学试题广东省四会中学、广信中学2023-2024学年高二下学期第一次联合考试化学试题2024届四川省眉山市仁寿县高三下学期三诊模拟联考理综试题-高中化学广东省广州市第六十五中学2023-2024学年高二下学期期中考试化学试题
名校
解题方法
7 . Fe2(SO4)3溶液可与黄芩素发生显色反应。下列有关说法正确的是
| A.电负性由强到弱的顺序为O>H>C |
| B.Fe3+的基态价电子排布式为3d6 |
| C.黄岑素晶体熔点高、硬度大 |
D.SO 的空间构型为正四面体 的空间构型为正四面体 |
您最近一年使用:0次
解题方法
8 . 二氧化钛、四氯化钛、钛酸钡等钛及其化合物在人们的生活中起着十分重要的作用,应用极广。回答下列问题:
(1)基态钛原子的价电子排布式为_______ ,基态 中的核外电子有
中的核外电子有_______ 个空间运动状态。
(2) 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得。
反应制得。
① 由
由 和
和 构成,
构成, 的空间构型是
的空间构型是_______ ,B原子的杂化轨道类型是_______ , 中各元素的电负性大小顺序为
中各元素的电负性大小顺序为_______ 。
②某储氢材料是第三周期金属元素M的氢化物,M逐级失去电子的部分电离能如下表所示,M是_______ 填元素符号。
(1)基态钛原子的价电子排布式为
 中的核外电子有
中的核外电子有(2)
 是一种储氢材料,可由
是一种储氢材料,可由 和
和 反应制得。
反应制得。①
 由
由 和
和 构成,
构成, 的空间构型是
的空间构型是 中各元素的电负性大小顺序为
中各元素的电负性大小顺序为②某储氢材料是第三周期金属元素M的氢化物,M逐级失去电子的部分电离能如下表所示,M是
| 元素 | M |
| 电离能(kJ/mol) | 738 |
| 1451 | |
| 7733 | |
| 10540 | |
| 13630 |
您最近一年使用:0次
名校
解题方法
9 . 二氯异氰尿酸钠是中国疾控中心研发的“-18℃低温消毒剂”主要成分之一,其合成方法如下图。下列说法错误的是
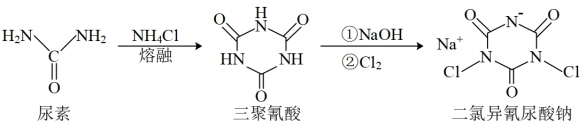

| A.尿素和氯化铵中N原子杂化方式相同 |
| B.二氯异氰尿酸钠所含元素中电负性最大的是氧 |
| C.二氯异氰尿酸钠晶体中存在离子键、共价键和配位键 |
D.三聚氰酸具有与苯环类似的结构,可推知三聚氰酸分子中存在大 键 键 |
您最近一年使用:0次
2022-04-08更新
|
673次组卷
|
5卷引用:山东省青岛市2022高考一模化学试题
名校
10 . 石墨烯具有优异的光学、电学、力学特性,在材料学、微纳加工、能源和生物医学等方面具有广阔的应用前景,石墨烯可采用化学方法制备,如以六氯苯、六溴苯为原料可制备石墨烯。下表是六氯苯、六溴苯、苯六酸的熔点和水溶性:
下列说法正确的是
| 物质 | 六氯苯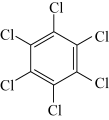 | 六溴苯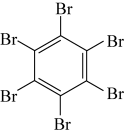 | 苯六酸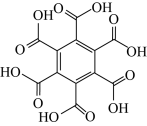 |
| 熔点/℃ | 231 | 325 | 287 |
| 水溶性 | 不溶 | 不溶 | 易溶 |
| A.苯六酸所含元素的电负性:C>O>H |
| B.从结构上看,六氯苯、六溴苯和苯六酸均为极性分子 |
| C.六氯苯、六溴苯和苯六酸分子中C的杂化方式均为sp2杂化 |
| D.苯六酸与六氯苯、六溴苯的水溶性存在明显的差异是因为其分子结构庞大 |
您最近一年使用:0次
2022-03-20更新
|
442次组卷
|
9卷引用:山东省名校联盟2021-2022学年高二下学期质量检测联合调考化学试题
山东省名校联盟2021-2022学年高二下学期质量检测联合调考化学试题山东省名校联盟2021-2022学年高二下学期质量检测联合调考化学(B2)试题湖南省2021-2022学年高二下学期3月大联考化学试题河北省邢台市四校联考2021-2022学年高二下学期第二次月考化学试题吉林省吉林市第一中学2021-2022学年高二下学期第一次质量检测化学试题广东省名校联盟2021-2022学年高二下学期4月大联考化学试题内蒙古额尔古纳市第一中学2021-2022学年高二下学期阶段性考试化学试题福建省名校联盟2021-2022学年高二下学期期中考试化学试题.辽宁省抚顺市第一中学2022届高三下学期5月模拟考试化学试题



