1 . 嫦娥5号月球探测器带回的月壤样品的元素分析结果如图,下列有关含量前六位元素的说法正确的是
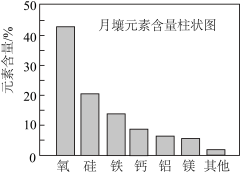
| A.原子半径:Al<Si | B.第一电离能:Mg<Ca |
| C.Fe位于元素周期表的p区 | D.这六种元素中,电负性最大的是O |
您最近一年使用:0次
2023-02-23更新
|
3994次组卷
|
17卷引用:2022年天津市普通高中学业水平等级性考试化学试题
2022年天津市普通高中学业水平等级性考试化学试题2022年天津高考化学真题(已下线)2022年天津市普通高中学业水平等级性考试化学试题变式题(选择题1-4)天津市南开区2022-2023学年高二上学期阶段性质量监测化学试题天津市第二南开学校2022--2023学年高二下学期期中质量调查化学试题天津市北辰区2023-2024学年高三上学期11月期中考试化学试题(已下线)专题07 突破原子结构和元素周期表(律)(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)(已下线)第19讲元素周期律与元素周期表黑龙江省齐齐哈尔市恒昌中学校2022-2023学年高二下学期7月期末考试化学试题(已下线)专题08 物质结构与性质 元素推断-2023年高考化学真题题源解密(全国通用)(已下线)考点18 元素周期律与元素周期表(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)选择题1-5(已下线)专题11 原子结构 原子结构与元素的性质-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)湖南省长沙市明德中学2023-2024学年高二上学期12月月考化学试题浙江省宁波市奉化区2023-2024学年高二上学期期末检测化学试题(已下线)热点02 原子结构与元素的性质广东省肇庆市加美学校2023-2024学年高二下学期竞赛化学试题
2 . 回答下列问题:
(1)氟原子激发态的电子排布式有______ ,其中能量较高的是______ 。(填标号)
a.1s22s22p43s1 b.1s22s22p43d2 c.1s22s12p5 d.1s22s22p33p2
(2)某元素原子的位于周期表的第四周期,元素原子的最外层只有一个电子,其次外层内的所以轨道电子均成对。该元素位于周期表的______ 区,写出该基态原子电子排布式为______ 。
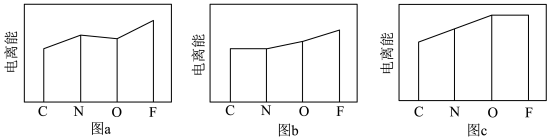
(3)图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是______ (填标号),判断的根据是______ ;第三电离能的变化图是______ (填标号)。
(4)短周期元素X、Y、Z、W的原子序数依次增大。根据表中信息完成下列空白。
①元素的电负性:Z______ W(填“大于”“小于”或“等于”)。
②简单离子半径:W______ Y(填“大于”“小于”或“等于”)。
③氢化物的稳定性:X______ Z(填“大于”“小于”或“等于”)。
(1)氟原子激发态的电子排布式有
a.1s22s22p43s1 b.1s22s22p43d2 c.1s22s12p5 d.1s22s22p33p2
(2)某元素原子的位于周期表的第四周期,元素原子的最外层只有一个电子,其次外层内的所以轨道电子均成对。该元素位于周期表的
(3)图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是

(4)短周期元素X、Y、Z、W的原子序数依次增大。根据表中信息完成下列空白。
| 元素 | X | Y | Z | W |
| 最高价氧化物的水化物 | H3ZO4 | |||
| 0.1 mol∙L−1溶液对应的pH(25℃) | 1.00 | 13.00 | 1.57 | 0.70 |
②简单离子半径:W
③氢化物的稳定性:X
您最近一年使用:0次
2023-01-03更新
|
421次组卷
|
2卷引用:天津市和平区2022-2023学年高二上学期期末质量调查化学试卷
解题方法
3 . 钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料,回答下列问题:
(1)基态Ti原子的核外电子排布式为____ 。Ti在元素周期表中的位置____ 。
(2)Ti的四卤化物熔点如表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是____ 。
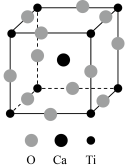
(3)CaTiO3的晶胞如图所示,其组成元素的电负性大小顺序是____ ;金属离子与氧离子间的作用力为____ ,Ca2+的配位数是____ 。
(1)基态Ti原子的核外电子排布式为
(2)Ti的四卤化物熔点如表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是
| 化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | ﹣24.12 | 38.3 | 155 |
(3)CaTiO3的晶胞如图所示,其组成元素的电负性大小顺序是

您最近一年使用:0次
名校
解题方法
4 . 下列说法正确的是
| A.S、Cl、K、Ca原子半径逐渐增大 |
B. 的电离方程式为: 的电离方程式为: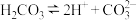 |
C. 和 和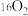 互为同素异形体 互为同素异形体 |
| D.Ge,As,Se、Br的电负性依次增大 |
您最近一年使用:0次
5 . 有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p4②1s22s22p63s23p3③1s22s22p3④1s22s22p5。下列说法正确的是
| A.原子半径:③>④>②>① | B.第一电离能:④>③>②>① |
| C.电负性:④>③>②>① | D.最高正化合价:④>①>②=③ |
您最近一年使用:0次
2022-04-21更新
|
269次组卷
|
4卷引用:天津北京师范大学静海附属学校2021-2022学年高二下学期期中考试化学试题
名校
6 . 某有机物的结构简式如图所示,其中X和Y是第二周期两种相邻的非金属元素,Z元素基态原子的M能层上有3对成对电子。下列说法正确的是
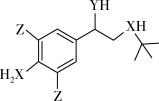

| A.原子半径:Z>Y>X |
| B.电负性:X<Y |
| C.Z的含氧酸酸性均强于碳酸 |
| D.Y氢化物的沸点低于X氢化物的沸点 |
您最近一年使用:0次
名校
7 . 下列各组元素中,电负性依次减小的是
| A.F、N、O | B.Cl、C、F | C.As、N、H | D.Cl、S、As |
您最近一年使用:0次
2022-01-21更新
|
369次组卷
|
6卷引用:天津市外国语大学附属外国语学校2021-2022学年高二上学期期末检测化学试题
名校
解题方法
8 . 下列说法不正确的是( )
| A.乙烯分子中的 σ键和π键比例为 5:1 |
| B.某元素气态基态原子的逐级电离能(kJ•mol﹣1)分别为 738、1451、7733、10540、13630、17995、21703, 当它与氯气反应时可能生成的阳离子是 X2+ |
| C.Na、P、Cl 的电负性依次增大 |
| D.向配合物[TiCl(H2O)5]Cl2•H2O 溶液中加入足量的 AgNO3 溶液,所有 Cl-均被完全沉淀 |
您最近一年使用:0次
2020-03-28更新
|
321次组卷
|
7卷引用:天津市武清区杨村第一中学2021-2022学年高二下学期第一次月考化学试题



