1 . 磷酸亚铁锂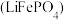 和锰酸锂
和锰酸锂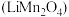 均可用作锂离子电池正极材料。回答下列问题:
均可用作锂离子电池正极材料。回答下列问题:
(1)基态O原子的价电子轨道表示式为___________ ;Mn的原子结构示意图为___________ 。
(2) 的熔、沸点
的熔、沸点___________ (填“高于”或“低于”) 。
。
(3) 分子中,与N原子相连的H呈正电性
分子中,与N原子相连的H呈正电性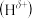 ,与B原子相连的H呈负电性
,与B原子相连的H呈负电性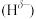 ,H、B、N电负性由小到大的顺序是
,H、B、N电负性由小到大的顺序是___________ 。
(4)已知: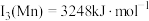 ,
,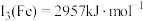 。Mn的第三电离能大于Fe的第三电离能,其主要原因是
。Mn的第三电离能大于Fe的第三电离能,其主要原因是___________ 。
(5)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种 配合物的结构如图所示,2mol该配合物中通过
配合物的结构如图所示,2mol该配合物中通过螯合作用 形成的配位键有___________ mol。
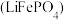 和锰酸锂
和锰酸锂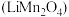 均可用作锂离子电池正极材料。回答下列问题:
均可用作锂离子电池正极材料。回答下列问题:(1)基态O原子的价电子轨道表示式为
(2)
 的熔、沸点
的熔、沸点 。
。(3)
 分子中,与N原子相连的H呈正电性
分子中,与N原子相连的H呈正电性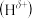 ,与B原子相连的H呈负电性
,与B原子相连的H呈负电性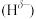 ,H、B、N电负性由小到大的顺序是
,H、B、N电负性由小到大的顺序是(4)已知:
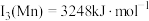 ,
,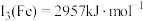 。Mn的第三电离能大于Fe的第三电离能,其主要原因是
。Mn的第三电离能大于Fe的第三电离能,其主要原因是(5)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种
 配合物的结构如图所示,2mol该配合物中通过
配合物的结构如图所示,2mol该配合物中通过
您最近半年使用:0次
名校
解题方法
2 .  可用作高压发电系统的绝缘气体,分子呈正八面体结构,如图所示。有关
可用作高压发电系统的绝缘气体,分子呈正八面体结构,如图所示。有关 的说法正确的是
的说法正确的是
 可用作高压发电系统的绝缘气体,分子呈正八面体结构,如图所示。有关
可用作高压发电系统的绝缘气体,分子呈正八面体结构,如图所示。有关 的说法正确的是
的说法正确的是
A. 是只含极性键的非极性分子 是只含极性键的非极性分子 | B.键角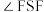 都等于 都等于 |
| C.S与F之间共用电子对偏向S | D.推测 在水中溶解度较大 在水中溶解度较大 |
您最近半年使用:0次
名校
3 . 嫦娥5号月球探测器带回的月壤样品的元素分析结果如图,下列有关含量前六位元素的说法正确的是
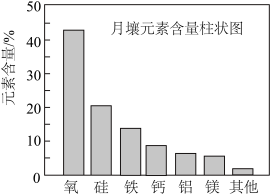
| A.基态Mg原子有6种能量不同的电子 | B.这六种元素中,电负性最大的是O |
| C.Ca原子核外有4种形状的原子轨道 | D.基态原子未成对电子数:Si<Al |
您最近半年使用:0次
4 . 下列有关说法正确的是
A.第一电离能: |
B.键角: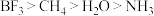 |
C.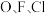 电负性由大到小的顺序为 电负性由大到小的顺序为 |
D. 溶于水和干冰升华都只有分子间作用力改变 溶于水和干冰升华都只有分子间作用力改变 |
您最近半年使用:0次
5 . 四种元素基态原子的电子排布式如下:① ;②
;② ;③
;③ ;④
;④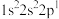 。下列有关比较中正确的是
。下列有关比较中正确的是
 ;②
;② ;③
;③ ;④
;④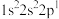 。下列有关比较中正确的是
。下列有关比较中正确的是| A.第一电离能:④>③>②>① | B.原子半径:④>③>①>② |
| C.电负性:③>④>①>② | D.最高正化合价:④=①>③=② |
您最近半年使用:0次
2024-01-24更新
|
138次组卷
|
7卷引用:第一章 本章达标检测2
名校
6 . 氢键对生命活动具有重要意义。DNA中四种碱基间的配对方式如下图。(~ 代表糖苷键)
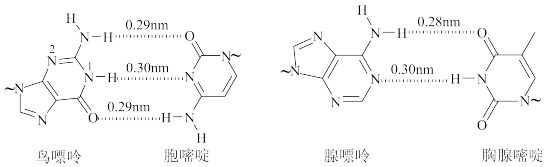
请回答下列问题:
(1)基态N的核外电子排布式为___________ ;N和O第一电离能较大的是___________ 。
(2)①碱基中的-NH2具有一定的碱性,可以结合H+形成-NH ,从结构角度解释可以结合的原因:
,从结构角度解释可以结合的原因:___________ 。
②写出甘氨酸(H2NCH2COOH)在pH=1和pH=13时的粒子存在形态:pH=1时___________ ,pH=13时___________ 。
(3)鸟嘌呤是一种常见的碱基。
①鸟嘌呤中2号N的杂化类型为___________ 。
②鸟嘌呤中N-H键的平均键长___________ (填“大于”“小于”或“等于”)0.29nm。
(4)氢键在DNA复制过程中起重要作用。
①碱基中,O、N能与H形成氢键而C不能,原因是___________ 。
②下列说法正确的是___________ (填序号)。
a.氢键的强度较小,在DNA解旋和复制时容易断裂和形成
b.鸟嘌呤与胞嘧啶之间的相互作用比鸟嘌呤与胸腺嘧啶之间的更强
c.碱基配对时,一个H可以同时与多个原子形成氢键
d.DNA在形成双螺旋结构时,碱基遵循互补配对原则,形成的氢键多,结构更稳定
(5)一定条件下鸟嘌呤会发生异构化,其1号N上的H会转移到O上形成-OH。
①鸟嘌呤异构化后的结构简式为___________ 。
②鸟嘌呤异构化后最有可能配对的嘧啶碱基是___________ 。

请回答下列问题:
(1)基态N的核外电子排布式为
(2)①碱基中的-NH2具有一定的碱性,可以结合H+形成-NH
 ,从结构角度解释可以结合的原因:
,从结构角度解释可以结合的原因:②写出甘氨酸(H2NCH2COOH)在pH=1和pH=13时的粒子存在形态:pH=1时
(3)鸟嘌呤是一种常见的碱基。
①鸟嘌呤中2号N的杂化类型为
②鸟嘌呤中N-H键的平均键长
(4)氢键在DNA复制过程中起重要作用。
①碱基中,O、N能与H形成氢键而C不能,原因是
②下列说法正确的是
a.氢键的强度较小,在DNA解旋和复制时容易断裂和形成
b.鸟嘌呤与胞嘧啶之间的相互作用比鸟嘌呤与胸腺嘧啶之间的更强
c.碱基配对时,一个H可以同时与多个原子形成氢键
d.DNA在形成双螺旋结构时,碱基遵循互补配对原则,形成的氢键多,结构更稳定
(5)一定条件下鸟嘌呤会发生异构化,其1号N上的H会转移到O上形成-OH。
①鸟嘌呤异构化后的结构简式为
②鸟嘌呤异构化后最有可能配对的嘧啶碱基是
您最近半年使用:0次
7 . 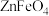 是一种性能优良的软磁材料,也是一种催化剂。工业上利用反应:
是一种性能优良的软磁材料,也是一种催化剂。工业上利用反应: 制备
制备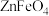 。下列说法错误的是
。下列说法错误的是
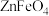 是一种性能优良的软磁材料,也是一种催化剂。工业上利用反应:
是一种性能优良的软磁材料,也是一种催化剂。工业上利用反应: 制备
制备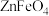 。下列说法错误的是
。下列说法错误的是A.电负性 |
B. 分子中有2个 分子中有2个 键,2个 键,2个 键 键 |
C.基态 的核外电子排布式为 的核外电子排布式为 |
D.基态氧原子中,电子占据的最高能级符号为 |
您最近半年使用:0次
17-18高一下·重庆·期中
名校
解题方法
8 . 已知:元素的电负性和元素的化合价一样,也是元素的一种基本性质;两成键元素间电负性差值大于1.7时,通常形成离子键,两成键元素间电负性差值小于1.7时,通常形成共价键。下表给出了14种元素的电负性,则下列说法错误的是
| 元素 | Al | B | Be | C | Cl | F | Li |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 |
| 元素 | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
| A.随着原子序数递增,元素的电负性呈周期性变化 |
| B.元素电负性越大,其非金属性越强 |
| C.根据电负性数据可知Mg3N2中含有离子键 |
| D.BeCl2含金属元素铍,故属于离子化合物 |
您最近半年使用:0次
2023-07-29更新
|
96次组卷
|
6卷引用:第38练 原子结构与元素的性质-2023年高考化学一轮复习小题多维练(全国通用)
(已下线)第38练 原子结构与元素的性质-2023年高考化学一轮复习小题多维练(全国通用)第一章 本章复习提升1【全国百强校】重庆市第一中学2017-2018学年高一下学期期中考试化学试题江西省赣州市石城县石城中学2020-2021学年高一下学期3月月考化学试题云南省龙陵县第一中学2022-2023学年高二下学期期末考试化学试题陕西省西安交通大学附属中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
9 . 元素X、Y、Z在周期表中的相对位置如下所示,已知Y元素原子的外围电子排布为ns(n-1)np(n+1),则下列说法不正确的是
| X | ||
| Y | ||
| Z |
| A.X元素所在周期中所含非金属元素最多 |
| B.Y元素在周期表的第3周期第ⅥA族 |
| C.Z的电负性比X和Y都弱 |
| D.Z元素原子的核外电子排布简式为:[Ar]4s24p3 |
您最近半年使用:0次
解题方法
10 . 硼的化合物在生产、生活和科研中应用广泛。回答下列问题:
(1)基态硼原子的价电子排布图为:___________ ;B、N、H的电负性由大到小的顺序为___________ 。
(2)科学家合成了一种含硼阴离子 ,其结构如图所示。其中硼原子的杂化方式为
,其结构如图所示。其中硼原子的杂化方式为___________ ,该结构中共有___________ 种不同化学环境的氧原子。
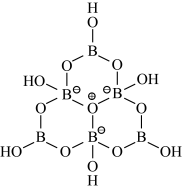
(3) 与
与 结合形成固态化合物
结合形成固态化合物 ,该物质在
,该物质在 时熔化电离出
时熔化电离出 和一含硼阴离子
和一含硼阴离子___________ (填离子符号); 空间构型为
空间构型为___________ 。
(1)基态硼原子的价电子排布图为:
(2)科学家合成了一种含硼阴离子
 ,其结构如图所示。其中硼原子的杂化方式为
,其结构如图所示。其中硼原子的杂化方式为
(3)
 与
与 结合形成固态化合物
结合形成固态化合物 ,该物质在
,该物质在 时熔化电离出
时熔化电离出 和一含硼阴离子
和一含硼阴离子 空间构型为
空间构型为
您最近半年使用:0次



