1 . A、B、C、D、E、F、G为周期表前四周期元素,原子序数依次增大。A元素的价电子构型为 ;C元素为最活泼的非金属元素;D元素核外有三个电子层,最外层电子数是核外电子总数的1/6;E元素正三价阳离子的
;C元素为最活泼的非金属元素;D元素核外有三个电子层,最外层电子数是核外电子总数的1/6;E元素正三价阳离子的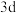 轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。回答下列问题:
轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。回答下列问题:
(1)第一电离能:A__________ B,电负性:C__________ B(填“>”“=”或“<”)
(2)基态D原子核外电子的运动状态有___________ 种。
(3)元素E在周期表中的位置是______________ 。F属于周期表的__________ 区。
(4)基态G原子的价电子排布式为_____________________ 。
 ;C元素为最活泼的非金属元素;D元素核外有三个电子层,最外层电子数是核外电子总数的1/6;E元素正三价阳离子的
;C元素为最活泼的非金属元素;D元素核外有三个电子层,最外层电子数是核外电子总数的1/6;E元素正三价阳离子的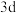 轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。回答下列问题:
轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。回答下列问题:(1)第一电离能:A
(2)基态D原子核外电子的运动状态有
(3)元素E在周期表中的位置是
(4)基态G原子的价电子排布式为
您最近一年使用:0次
名校
2 . 瑞德西韦是抗击新冠肺炎的主要药物之一,其结构如图所示,下列说法正确的是
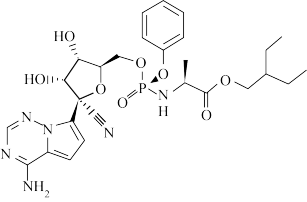

| A.瑞德西韦中N、O、P元素的电负性:O>N>P |
| B.瑞德西韦中的N-H键的键能大于O-H键的键能 |
C.瑞德西韦中所有N原子都采取 杂化 杂化 |
D.瑞德西韦中含有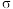 键和大 键和大 键 键 |
您最近一年使用:0次
2022-09-22更新
|
233次组卷
|
2卷引用:福建省莆田第二十四中学2021-2022学年高二下学期开学摸底考试化学(1卷)试题
3 . W、X、Y、Z为原子序数依次增大的短周期元素,四种元素的核外电子总数满足X+Y=W+Z;化合物XW3与WZ相遇会产生白烟。下列叙述正确的是
| A.元素的电负性:W>X>Y | B.原子半径:Z>Y>X>W |
| C.最高价氧化物的水化物的酸性:X>Z | D.Y和W、X、Z均可形成离子化合物 |
您最近一年使用:0次
名校
解题方法
4 . 下列“类比”结果正确的是
| A.根据同周期元素的电负性变化趋势,推出Ar的电负性比Cl大 |
| B.CO2与足量Na2O2反应生成碳酸钠,则SO2与足量Na2O2反应生成亚硫酸钠 |
| C.Cu(OH)2可以溶解在浓氨水中,则Fe(OH)3也可以溶解在浓氨水中 |
| D.CH4的空间构型为正四面体型,则C(CH3)4碳骨架的空间构型为正四面体型 |
您最近一年使用:0次
2022-08-18更新
|
183次组卷
|
2卷引用:浙江省温州市瑞安中学2021-2022学年高二下学期开学考试化学试题
名校
5 . 光气( )是一种重要的有机中间体。利用反应可
)是一种重要的有机中间体。利用反应可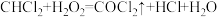 用于制备光气。下列有关叙述正确的是
用于制备光气。下列有关叙述正确的是
 )是一种重要的有机中间体。利用反应可
)是一种重要的有机中间体。利用反应可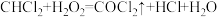 用于制备光气。下列有关叙述正确的是
用于制备光气。下列有关叙述正确的是A.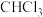 为非极性分子 为非极性分子 | B. 的电子式为 的电子式为 |
C. 、 、 分子间均能形成氢键 分子间均能形成氢键 | D.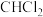 中电负性最小的元素是Cl 中电负性最小的元素是Cl |
您最近一年使用:0次
2022-08-17更新
|
105次组卷
|
3卷引用:云南省昭通市第一中学2021-2022学年高二下学期开学考试化学试题
6 . 现有位于元素周期表前四周期的A、B、C、D、E、F、G七种非零族元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
(1)由A、C形成的18电子分子的电子式为___________ 。
(2)D元素的基态原子核外共有________ 种不同空间运动状态的电子,B元素基态原子中能量最高的电子所占据的原子轨道呈________ 形。B、C、D三种元素电负性由大到小的顺序为________ (填元素符号)。
(3)某同学推断E元素基态原子的核外电子轨道表示式为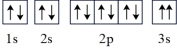 。该同学所画的电子轨道表示式违背了
。该同学所画的电子轨道表示式违背了______ ,该元素的第三电离能I3远远大于其第二电离能I2,其原因是_______ 。
(4)D、E、F三种元素的简单离子半径由大到小的顺序是________ (用离子符号表示)。
(5)检验G元素的方法是______ ,请用原子结构的知识解释其原理:_______ 。
| A | 在周期表的所有元素中原子半径最小 |
| B | 基态原子中有两个未成对电子 |
| C | 基态原子在同周期中未成对电子数最多 |
| D | 基态原子中有两个未成对电子 |
| E | 基态原子中没有未成对电子 |
| F | 同周期元素中电负性最大 |
| G | 同周期元素中第一电离能最小 |
(2)D元素的基态原子核外共有
(3)某同学推断E元素基态原子的核外电子轨道表示式为
 。该同学所画的电子轨道表示式违背了
。该同学所画的电子轨道表示式违背了(4)D、E、F三种元素的简单离子半径由大到小的顺序是
(5)检验G元素的方法是
您最近一年使用:0次
名校
解题方法
7 . 氮化锗(Ge3N4)具有耐腐蚀、硬度高等优点,应用广泛。下列说法正确的是
| A.基态锗原子的电子排布式可表示为[Ar]4s24p2 |
| B.氮化锗中氮显-3价,说明氮的电负性比锗大 |
| C.第4周期基态原子与锗未成对电子数相等的元素共有2种 |
| D.在基态多电子原子中,p能级电子能量一定高于s能级电子能量 |
您最近一年使用:0次
名校
8 . 近年来,光催化剂的研究是材料领域的热点方向。一种Ru配合物(如图所示)复合光催化剂可将CO2转化为HCOOH。下列说法错误的是
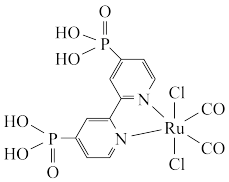

| A.Ru配合物中第二周期元素的电负性由大到小的顺序为O>N>C |
B.如图结构的吡啶环(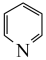 )中C、N原子的杂化方式均为sp2 )中C、N原子的杂化方式均为sp2 |
| C.该配合物中Ru的配位数是6 |
| D.HCOOH的沸点比HCHO高,主要因为HCOOH相对分子质量大于HCHO |
您最近一年使用:0次
2022-02-27更新
|
1087次组卷
|
7卷引用:辽宁省沈阳市第二中学2021-2022学年高三下学期学期初考试化学试题
辽宁省沈阳市第二中学2021-2022学年高三下学期学期初考试化学试题(已下线)押新高考卷08题 物质结构与性质-备战2022年高考化学临考题号押题(新高考通版)(已下线)化学-2022年高考考前押题密卷(山东卷)(已下线)第十二章 物质结构与性质(测)-2023年高考化学一轮复习讲练测(全国通用)(已下线)专题33 物质结构与性质基础-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)T9-物质结构江苏省锡东高级中学2023-2024学年高二上学期期中考试化学试卷
9 . 钛硅分子筛是一种新型固体催化剂,可催化合成重要有机合成活性试剂甲乙酮肟(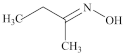 )。回答下列问题:
)。回答下列问题:
(1)基态硅原子的核外电子空间运动状态有___________ 种。
(2)甲乙酮肟中同周期三种元素电负性由大到小的顺序为___________ ,氮原子的杂化方式为___________ ,C=N与C-C键夹角___________ (填“<”“>”或“=”)C=N与N-O键夹角。
(3) 和
和 均是制备钛硅分子筛的重要中间体。
均是制备钛硅分子筛的重要中间体。
① 与光气
与光气 反应可用于制取四氯化钛。
反应可用于制取四氯化钛。 中σ键和π键的数目比为
中σ键和π键的数目比为___________ ,其空间构型为___________ 。
② 与金属
与金属 在高温条件下可反应生成
在高温条件下可反应生成 ,
, 中
中 极易被氧化,还原性很强。试解释
极易被氧化,还原性很强。试解释 还原性强的原因
还原性强的原因___________ 。
 )。回答下列问题:
)。回答下列问题:(1)基态硅原子的核外电子空间运动状态有
(2)甲乙酮肟中同周期三种元素电负性由大到小的顺序为
(3)
 和
和 均是制备钛硅分子筛的重要中间体。
均是制备钛硅分子筛的重要中间体。①
 与光气
与光气 反应可用于制取四氯化钛。
反应可用于制取四氯化钛。 中σ键和π键的数目比为
中σ键和π键的数目比为②
 与金属
与金属 在高温条件下可反应生成
在高温条件下可反应生成 ,
, 中
中 极易被氧化,还原性很强。试解释
极易被氧化,还原性很强。试解释 还原性强的原因
还原性强的原因
您最近一年使用:0次
10 . 硅是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态硅(Si)原子的核外电子排布式为[Ne]_______ ,有_______ 个未成对电子。
(2)碳(C)、硅(Si)、锗(Ge)是同族元素。
①基态Ge原子的核外电子占据_______ 个能层、_______ 个能级。
②上述三种元素的电负性由大到小的顺序为_______ (填元素符号)。
③固态CO2可用于人工降雨,SiO2常用于_______ (填一种即可)。
④请写出高温条件下碳和二氧化硅反应的化学方程式:_______ 。
(3)在元素周期表中,某些元素与其右下方的主族元素(如图所示)的一些性质是相似的。如Si与NaOH反应生成Na2SiO3和H2,则B与NaOH反应生成_______ (填化学式)和H2。
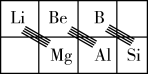
(1)基态硅(Si)原子的核外电子排布式为[Ne]
(2)碳(C)、硅(Si)、锗(Ge)是同族元素。
①基态Ge原子的核外电子占据
②上述三种元素的电负性由大到小的顺序为
③固态CO2可用于人工降雨,SiO2常用于
④请写出高温条件下碳和二氧化硅反应的化学方程式:
(3)在元素周期表中,某些元素与其右下方的主族元素(如图所示)的一些性质是相似的。如Si与NaOH反应生成Na2SiO3和H2,则B与NaOH反应生成

您最近一年使用:0次
2022-01-27更新
|
325次组卷
|
3卷引用:黑龙江省哈尔滨师范大学青冈实验中学校2021-2022学年高二下学期开学考试化学试题



