名校
1 . 碳、硫、氧、氮是中学常见元素,下列说法不正确的是
A. 、 、 、 、 都是直线形分子 都是直线形分子 |
B. 、 、 、 、 的键角依次减小 的键角依次减小 |
C. 、 、 分子的中心原子都是 分子的中心原子都是 化 化 |
| D.C、N、F元素的电负性依次增大 |
您最近一年使用:0次
2023-06-08更新
|
148次组卷
|
5卷引用:福建省三明市四地四校2021-2022学年高二下学期期中联考化学试题
22-23高三下·福建泉州·阶段练习
解题方法
2 . 点击化学(click chemistry)是一种能够让分子的构建模块快速、高效地结合在一起的化学反应。科学工作者可以利用基础模块搭建出变化无穷的造型,就如同玩乐高玩具一般。叠氨化物和块经合成抗真菌药物三唑是点击化学的重要应用,反应示例如下:
(1) 的核外电子排布式为
的核外电子排布式为_______ 。
(2)C、N、Cu的电负性由大到小的顺序为_______ 。
(3)分子乙中存在5中心6电子的大 键,其中,提供两个电子形成大
键,其中,提供两个电子形成大 键(
键(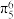 )的原子是
)的原子是_______ (填对应原子的序号)。
(4)分子中碳碳三键的活泼性:甲_______ 丙(填“>”“=”“<”),理由是_______ (从分子的结构角度分析)。
(5)丁形成的晶体中不存在的微粒间作用力有_______ 。
A.离子键 B.极性键 C.非极性键 D.氢键 E.范德华力
(6)CuCl的晶胞中, 的位置如图所示,
的位置如图所示, 填充于
填充于 构成的四面体空隙中。
构成的四面体空隙中。 的配位数为
的配位数为_______ 。
②由 构成的八面体空隙与有
构成的八面体空隙与有 填充的
填充的 构成的四面体空隙的数目之比为
构成的四面体空隙的数目之比为_______ 。
 +CH3CH2N3
+CH3CH2N3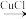

 +CH3CH2N3→
+CH3CH2N3→
(1)
 的核外电子排布式为
的核外电子排布式为(2)C、N、Cu的电负性由大到小的顺序为
(3)分子乙中存在5中心6电子的大
 键,其中,提供两个电子形成大
键,其中,提供两个电子形成大 键(
键(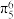 )的原子是
)的原子是(4)分子中碳碳三键的活泼性:甲
(5)丁形成的晶体中不存在的微粒间作用力有
A.离子键 B.极性键 C.非极性键 D.氢键 E.范德华力
(6)CuCl的晶胞中,
 的位置如图所示,
的位置如图所示, 填充于
填充于 构成的四面体空隙中。
构成的四面体空隙中。
 的配位数为
的配位数为②由
 构成的八面体空隙与有
构成的八面体空隙与有 填充的
填充的 构成的四面体空隙的数目之比为
构成的四面体空隙的数目之比为
您最近一年使用:0次
3 . 锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为_______ ,最高能级电子的电子云轮廓形状为_______ 。
(2)比较下列锗卤化物的熔点和沸点,分析其变化的原因_______ 。
(3)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是_______ 。
(4)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为_______ ,微粒之间存在的作用力是_______ 。
(5)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为( ,0,
,0, );C为(
);C为(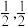 ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为_______ 。
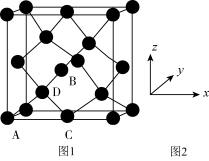
②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a=565.76pm,其密度为_______ g·cm-3(列出计算式即可)。
(1)基态Ge原子的核外电子排布式为
(2)比较下列锗卤化物的熔点和沸点,分析其变化的原因
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | −49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
(4)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为
(5)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(
 ,0,
,0, );C为(
);C为( ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为
②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a=565.76pm,其密度为
您最近一年使用:0次
解题方法
4 . 用“>”、“<”、“=”填空
(1)第一电离能:P_______ S;
(2)酸性:H3PO4_______ H2SO4;
(3)稳定性:H2O_______ H2S
(4)微粒半径:S_______ S2-
(5)碱性:KOH_______ NaOH
(6)元素的电负性:S_______ Cl。
(1)第一电离能:P
(2)酸性:H3PO4
(3)稳定性:H2O
(4)微粒半径:S
(5)碱性:KOH
(6)元素的电负性:S
您最近一年使用:0次
名校
5 . 瑞德西韦是抗击新冠肺炎的主要药物之一,其结构如图所示,下列说法正确的是
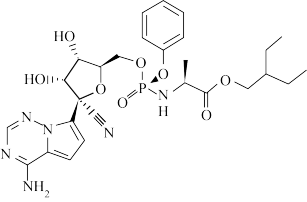

| A.瑞德西韦中N、O、P元素的电负性:O>N>P |
| B.瑞德西韦中的N-H键的键能大于O-H键的键能 |
C.瑞德西韦中所有N原子都采取 杂化 杂化 |
D.瑞德西韦中含有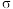 键和大 键和大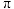 键 键 |
您最近一年使用:0次
2022-09-22更新
|
233次组卷
|
2卷引用:福建省莆田第二十四中学2021-2022学年高二下学期开学摸底考试化学(1卷)试题
名校
6 . 短周期元素X、Y、Z、W的原子序数依次增大。用表中信息判断下列说法正确的是
| 元素最高价氧化物的水化物 | X | Y | Z | W |
| 分子式 | H3ZO4 | |||
| 0.1 mol·L-1溶液对应的pH | 1.00 | 13.00 | 1.57 | 0.70 |
| A.元素电负性: Z<W |
| B.简单离子半径: W<Y |
| C.元素第一电离能: Z<W |
| D.简单氢化物的还原性: X>Z |
您最近一年使用:0次
7 . 三种元素基态原子的电子排布式如下:①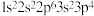 ②
② ③
③ 。下列有关比较中正确的是
。下列有关比较中正确的是
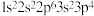 ②
② ③
③ 。下列有关比较中正确的是
。下列有关比较中正确的是| A.第一电离能:③>①>② | B.原子半径:①>②>③ |
| C.电负性:③>①>② | D.最高正化合价:③>①>② |
您最近一年使用:0次
名校
8 . 磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用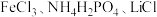 和苯胺等作为原料制备。回答下列问题:
和苯胺等作为原料制备。回答下列问题:
(1)在周期表中,与Li的化学性质最相似的邻族元素是_______ ,该元素基态原子核外M层电子的自旋状态_______ (填“相同”或“相反”)。
(2) 中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的
中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的 的结构式为
的结构式为_______ ,其中Fe的配位数为_______ 。
(3)苯胺(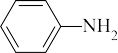 )的晶体类型是
)的晶体类型是_______ 。
(4)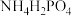 中,电负性最高的元素是
中,电负性最高的元素是_______ ;P的_______ 杂化轨道与O的2p轨道形成_______ 键。
(5)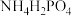 和
和 属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示:
属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示:

这类磷酸根离子的化学式可用通式表示为_______ (用n代表P原子数)。
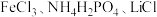 和苯胺等作为原料制备。回答下列问题:
和苯胺等作为原料制备。回答下列问题:(1)在周期表中,与Li的化学性质最相似的邻族元素是
(2)
 中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的
中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的 的结构式为
的结构式为(3)苯胺(
 )的晶体类型是
)的晶体类型是(4)
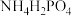 中,电负性最高的元素是
中,电负性最高的元素是(5)
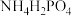 和
和 属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示:
属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示:
这类磷酸根离子的化学式可用通式表示为
您最近一年使用:0次
2022-04-22更新
|
135次组卷
|
2卷引用:福建省德化第一中学2021-2022学年高二下学期第一次质检化学试题
9 . 有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p4②1s22s22p63s23p3③1s22s22p3④1s22s22p5。下列说法正确的是
| A.原子半径:③>④>②>① | B.第一电离能:④>③>②>① |
| C.电负性:④>③>②>① | D.最高正化合价:④>①>②=③ |
您最近一年使用:0次
2022-04-21更新
|
269次组卷
|
4卷引用:福建省厦门英才学校中学部2021-2022学年高二下学期半期考化学试题
名校
10 . 石墨烯具有优异的光学、电学、力学特性,在材料学、微纳加工、能源和生物医学等方面具有广阔的应用前景,石墨烯可采用化学方法制备,如以六氯苯、六溴苯为原料可制备石墨烯。下表是六氯苯、六溴苯、苯六酸的熔点和水溶性:
下列说法正确的是
| 物质 | 六氯苯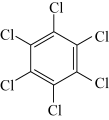 | 六溴苯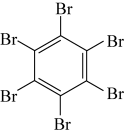 | 苯六酸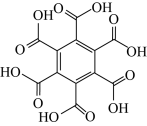 |
| 熔点/℃ | 231 | 325 | 287 |
| 水溶性 | 不溶 | 不溶 | 易溶 |
| A.苯六酸所含元素的电负性:C>O>H |
| B.从结构上看,六氯苯、六溴苯和苯六酸均为极性分子 |
| C.六氯苯、六溴苯和苯六酸分子中C的杂化方式均为sp2杂化 |
| D.苯六酸与六氯苯、六溴苯的水溶性存在明显的差异是因为其分子结构庞大 |
您最近一年使用:0次
2022-03-20更新
|
442次组卷
|
9卷引用:福建省名校联盟2021-2022学年高二下学期期中考试化学试题.
福建省名校联盟2021-2022学年高二下学期期中考试化学试题.湖南省2021-2022学年高二下学期3月大联考化学试题河北省邢台市四校联考2021-2022学年高二下学期第二次月考化学试题山东省名校联盟2021-2022学年高二下学期质量检测联合调考化学试题山东省名校联盟2021-2022学年高二下学期质量检测联合调考化学(B2)试题吉林省吉林市第一中学2021-2022学年高二下学期第一次质量检测化学试题广东省名校联盟2021-2022学年高二下学期4月大联考化学试题内蒙古额尔古纳市第一中学2021-2022学年高二下学期阶段性考试化学试题辽宁省抚顺市第一中学2022届高三下学期5月模拟考试化学试题



