解题方法
1 . 最近我国科研人员成功攻克了5G通信芯片制造中关键材料氮化镓(GaN)的研制难题。已知元素镓(Ga)与Al、N与As分别是同主族的元素,请回答下列问题:
(1)基态Ga原子的核外电子排布式为[Ar]______ 。
(2)根据元素周期律,元素的电负性Ga______ (填“大于”或“小于”,下同)As;
(3)超高导热绝缘耐高温纳米氮化铝在绝缘材料中应用广泛,氮化铝晶体与金刚石类似,每个铝原子与______ 个氮原子相连,氮化铝晶体属于______ 晶体。
(4)NH3是氮的氢化物,中心原子的杂化方式是______ ,NH3的沸点比AsH3高的原因是______ 。
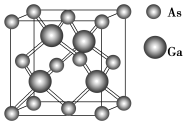
(5)共价晶体GaAs的晶胞参数y=xpm,它的晶胞结构如下图所示,该晶胞内部存在的共价键数为______ ;紧邻的As原子之间的距离为a,紧邻的As、Ga原子之间的距离为b,则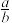 =
=______ 。该晶胞的密度为______ g·cm-3(阿伏伽德罗常数用NA表示)。
(1)基态Ga原子的核外电子排布式为[Ar]
(2)根据元素周期律,元素的电负性Ga
(3)超高导热绝缘耐高温纳米氮化铝在绝缘材料中应用广泛,氮化铝晶体与金刚石类似,每个铝原子与
(4)NH3是氮的氢化物,中心原子的杂化方式是
(5)共价晶体GaAs的晶胞参数y=xpm,它的晶胞结构如下图所示,该晶胞内部存在的共价键数为
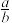 =
=
您最近一年使用:0次
名校
2 . 碳、硫、氧、氮是中学常见元素,下列说法不正确的是
A. 、 、 、 、 都是直线形分子 都是直线形分子 |
B. 、 、 、 、 的键角依次减小 的键角依次减小 |
C. 、 、 分子的中心原子都是 分子的中心原子都是 化 化 |
| D.C、N、F元素的电负性依次增大 |
您最近一年使用:0次
2023-06-08更新
|
147次组卷
|
5卷引用:福建省三明市四地四校2021-2022学年高二下学期期中联考化学试题
22-23高三下·福建泉州·阶段练习
解题方法
3 . 点击化学(click chemistry)是一种能够让分子的构建模块快速、高效地结合在一起的化学反应。科学工作者可以利用基础模块搭建出变化无穷的造型,就如同玩乐高玩具一般。叠氨化物和块经合成抗真菌药物三唑是点击化学的重要应用,反应示例如下:
(1) 的核外电子排布式为
的核外电子排布式为_______ 。
(2)C、N、Cu的电负性由大到小的顺序为_______ 。
(3)分子乙中存在5中心6电子的大 键,其中,提供两个电子形成大
键,其中,提供两个电子形成大 键(
键(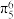 )的原子是
)的原子是_______ (填对应原子的序号)。
(4)分子中碳碳三键的活泼性:甲_______ 丙(填“>”“=”“<”),理由是_______ (从分子的结构角度分析)。
(5)丁形成的晶体中不存在的微粒间作用力有_______ 。
A.离子键 B.极性键 C.非极性键 D.氢键 E.范德华力
(6)CuCl的晶胞中, 的位置如图所示,
的位置如图所示, 填充于
填充于 构成的四面体空隙中。
构成的四面体空隙中。 的配位数为
的配位数为_______ 。
②由 构成的八面体空隙与有
构成的八面体空隙与有 填充的
填充的 构成的四面体空隙的数目之比为
构成的四面体空隙的数目之比为_______ 。
 +CH3CH2N3
+CH3CH2N3

 +CH3CH2N3→
+CH3CH2N3→
(1)
 的核外电子排布式为
的核外电子排布式为(2)C、N、Cu的电负性由大到小的顺序为
(3)分子乙中存在5中心6电子的大
 键,其中,提供两个电子形成大
键,其中,提供两个电子形成大 键(
键( )的原子是
)的原子是(4)分子中碳碳三键的活泼性:甲
(5)丁形成的晶体中不存在的微粒间作用力有
A.离子键 B.极性键 C.非极性键 D.氢键 E.范德华力
(6)CuCl的晶胞中,
 的位置如图所示,
的位置如图所示, 填充于
填充于 构成的四面体空隙中。
构成的四面体空隙中。
 的配位数为
的配位数为②由
 构成的八面体空隙与有
构成的八面体空隙与有 填充的
填充的 构成的四面体空隙的数目之比为
构成的四面体空隙的数目之比为
您最近一年使用:0次
22-23高三上·贵州贵阳·期末
解题方法
4 . 铜及其化合物在日常生产、生活中有着广泛的应用。回答下列问题:
(1)基态Cu原子价电子排布式为_______ 。
(2)K与Cu同周期,最外层电子数相同,但Cu的熔点远高于K,因为_______ 。
(3)含铜废液可以利用铜萃取剂M,通过如下反应实现铜离子的富集,进行回收。
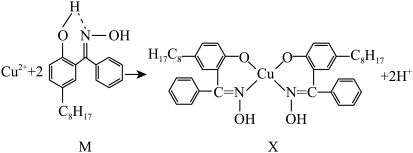
①M所含元素的电负性由大到小顺序是_______ (用元素符号表示)。
②X化合物中中心原子铜的配位数是_______ ,上述反应中断裂和生成的化学键有_______ (填字母序号)。
a.离子键 b.共价键 c.金属键 d.氢键 e.配位键
(4)高温下, 比CuO稳定的原因是
比CuO稳定的原因是_______ 。
(5)离子型配合物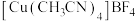 中,阴离子的空间构型为
中,阴离子的空间构型为_______ ,配体中碳原子的杂化方式是_______ 。
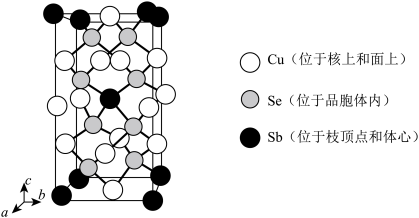
(6)由Cu,Sb,Se组成的热电材料,其晶胞结构如图所示, ,
,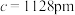 ,该晶体的密度是
,该晶体的密度是_______  (列式即可)
(列式即可)
(1)基态Cu原子价电子排布式为
(2)K与Cu同周期,最外层电子数相同,但Cu的熔点远高于K,因为
(3)含铜废液可以利用铜萃取剂M,通过如下反应实现铜离子的富集,进行回收。

①M所含元素的电负性由大到小顺序是
②X化合物中中心原子铜的配位数是
a.离子键 b.共价键 c.金属键 d.氢键 e.配位键
(4)高温下,
 比CuO稳定的原因是
比CuO稳定的原因是(5)离子型配合物
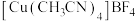 中,阴离子的空间构型为
中,阴离子的空间构型为(6)由Cu,Sb,Se组成的热电材料,其晶胞结构如图所示,
 ,
,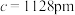 ,该晶体的密度是
,该晶体的密度是 (列式即可)
(列式即可)
您最近一年使用:0次
名校
解题方法
5 . 过渡元素中,Ti被誉为“未来金属”、“战略金属”,其具有稳定的化学性质。回答下列问题:
(1)基态钛原子的电子排布式为_______ 。
(2)Ti可形成多种配合物。 、
、 、
、 的配体所含原子中电负性由大到小的顺序是
的配体所含原子中电负性由大到小的顺序是_______ (写元素符号);CO作配体时,配位原子是C而不是O,其原因是_______ ; 中
中
_______ (填“大于”、“小于”或“等于”)单个水分子中 。
。
(3) 是氧化法制取钛的中间产物。
是氧化法制取钛的中间产物。 的分子结构与
的分子结构与 相同,二者在常温下都是液体。
相同,二者在常温下都是液体。 分子的空间构型是
分子的空间构型是_______ ,其中Ti原子采取_______ 杂化。
(4)如图为四方晶系的 晶体结构:
晶体结构:
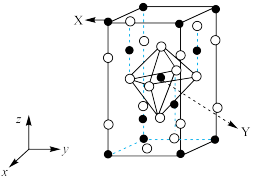
●表示_______ 原子(填元素符号),晶胞参数 ,底面边长为
,底面边长为 ,高为
,高为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,
, 的密度为
的密度为 ,则m的表达式为
,则m的表达式为_______ pm(列出计算式)。
(1)基态钛原子的电子排布式为
(2)Ti可形成多种配合物。
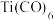 、
、 、
、 的配体所含原子中电负性由大到小的顺序是
的配体所含原子中电负性由大到小的顺序是 中
中
 。
。(3)
 是氧化法制取钛的中间产物。
是氧化法制取钛的中间产物。 的分子结构与
的分子结构与 相同,二者在常温下都是液体。
相同,二者在常温下都是液体。 分子的空间构型是
分子的空间构型是(4)如图为四方晶系的
 晶体结构:
晶体结构:
●表示
 ,底面边长为
,底面边长为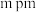 ,高为
,高为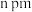 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,
, 的密度为
的密度为 ,则m的表达式为
,则m的表达式为
您最近一年使用:0次
名校
解题方法
6 . 非金属硼化物在现代工农业、医学和国防中有着重要的应用价值。回答下列问题:
(1)氨硼烷(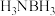 )是目前最具潜力的储氢材料之一、氨硼烷分子中与N相连的H呈正电性,与B原子相连的H呈负电性,它们之间存在静电相互吸引作用,称为双氢键,用“N—H…H—B”表示。以下物质之间可能形成双氢键的是___________(填序号)。
)是目前最具潜力的储氢材料之一、氨硼烷分子中与N相连的H呈正电性,与B原子相连的H呈负电性,它们之间存在静电相互吸引作用,称为双氢键,用“N—H…H—B”表示。以下物质之间可能形成双氢键的是___________(填序号)。
(2)氮杂氟硼二吡咯具有作为光动力学治疗(PDT)光敏剂的潜能,结构如图所示,分子内含有一个大Π键,大Π键可用符号 表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为
表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为 )、该大Π键的表示形式为
)、该大Π键的表示形式为___________ ,该分子中所有元素的电负性由大到小的顺序为___________ 。
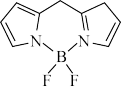
(3)硼氢化钠( )是一种常用的还原剂,其晶胞结构如图所示:
)是一种常用的还原剂,其晶胞结构如图所示:
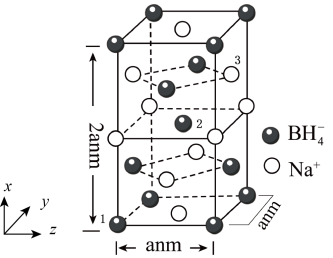
① 的配位数是
的配位数是___________ 。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子坐标参数,其中原子坐标参数“1”为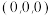 ;“2”为
;“2”为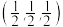 ;标注为“3”的
;标注为“3”的 坐标参数为
坐标参数为___________ 。
③已知硼氢化钠晶体的密度为 ,
, 代表阿伏加德罗常数的值,则
代表阿伏加德罗常数的值,则 与
与 之间的最近距离为
之间的最近距离为___________ nm(用含ρ、 的代数式表示)。
的代数式表示)。
④若硼氢化钠晶胞上、下底心处的 被
被 取代,得到晶体的化学式为
取代,得到晶体的化学式为___________ 。
(1)氨硼烷(
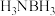 )是目前最具潜力的储氢材料之一、氨硼烷分子中与N相连的H呈正电性,与B原子相连的H呈负电性,它们之间存在静电相互吸引作用,称为双氢键,用“N—H…H—B”表示。以下物质之间可能形成双氢键的是___________(填序号)。
)是目前最具潜力的储氢材料之一、氨硼烷分子中与N相连的H呈正电性,与B原子相连的H呈负电性,它们之间存在静电相互吸引作用,称为双氢键,用“N—H…H—B”表示。以下物质之间可能形成双氢键的是___________(填序号)。A. 和 和 | B.LiH和HCN | C. 和 和 | D. 和 和 |
 表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为
表示,其中m代表参与形成大Π键的原子数,n代表参与形成大Π键的电子数(如苯分子中的大Π键可表示为 )、该大Π键的表示形式为
)、该大Π键的表示形式为
(3)硼氢化钠(
 )是一种常用的还原剂,其晶胞结构如图所示:
)是一种常用的还原剂,其晶胞结构如图所示:
①
 的配位数是
的配位数是②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子坐标参数,其中原子坐标参数“1”为
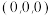 ;“2”为
;“2”为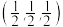 ;标注为“3”的
;标注为“3”的 坐标参数为
坐标参数为③已知硼氢化钠晶体的密度为
 ,
, 代表阿伏加德罗常数的值,则
代表阿伏加德罗常数的值,则 与
与 之间的最近距离为
之间的最近距离为 的代数式表示)。
的代数式表示)。④若硼氢化钠晶胞上、下底心处的
 被
被 取代,得到晶体的化学式为
取代,得到晶体的化学式为
您最近一年使用:0次
名校
解题方法
7 . Ⅰ.尿素[CO(NH2)2]是人工合成的第一种有机物,可用于制有机铁肥,主要代表有[Fe(H2NCONH2)6](NO3)3。
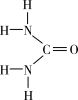
(1)[Fe(H2NCONH2)6](NO3)3中所含元素的电负性由大到小的顺序是______________ 。
(2)尿素中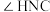
______________ 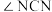 (填“>”“=”“<”),理由是
(填“>”“=”“<”),理由是______________ 。
(3)[Fe(H2NCONH2)6](NO3)3中不存在 的化学键____________ (填序号)。
A.离子键 B.金属键 C.配位键 D. 键 E.
键 E. 键
键
Ⅱ. 是一种贮氢的金属氢化物,可通过氢化镁和镍单质球磨制成。
是一种贮氢的金属氢化物,可通过氢化镁和镍单质球磨制成。 晶胞形状为如图立方体,边长为
晶胞形状为如图立方体,边长为 ,
, 原子占据顶点和面心,
原子占据顶点和面心, 处于八个小立方体的体心。
处于八个小立方体的体心。
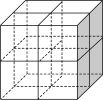
(4) 原子的价电子排布式为
原子的价电子排布式为______________ 。
(5) 位于
位于 原子形成的
原子形成的______________ (填“八面体空隙”或“四面体空隙”)。
(6)该晶体的密度为___________  (用含a、
(用含a、 代数式表示)。
代数式表示)。

(1)[Fe(H2NCONH2)6](NO3)3中所含元素的电负性由大到小的顺序是
(2)尿素中
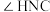
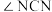 (填“>”“=”“<”),理由是
(填“>”“=”“<”),理由是(3)[Fe(H2NCONH2)6](NO3)3中
A.离子键 B.金属键 C.配位键 D.
 键 E.
键 E. 键
键Ⅱ.
 是一种贮氢的金属氢化物,可通过氢化镁和镍单质球磨制成。
是一种贮氢的金属氢化物,可通过氢化镁和镍单质球磨制成。 晶胞形状为如图立方体,边长为
晶胞形状为如图立方体,边长为 ,
, 原子占据顶点和面心,
原子占据顶点和面心, 处于八个小立方体的体心。
处于八个小立方体的体心。
(4)
 原子的价电子排布式为
原子的价电子排布式为(5)
 位于
位于 原子形成的
原子形成的(6)该晶体的密度为
 (用含a、
(用含a、 代数式表示)。
代数式表示)。
您最近一年使用:0次
8 . 钛和锆为同族的元素,它们形成的化合物用途广泛。
(1)锆为第五周期元素,基态原子的价层电子排布式为_______ 。
(2)钛与EDTA(乙二胺四乙酸根离子,结构如图1)形成的配位离子如图2所示。
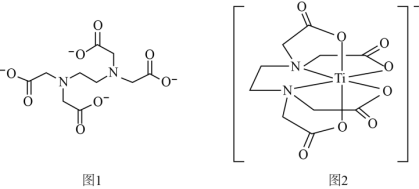
①EDTA中所含元素的电负性从大到小的顺序为_______ ;
②EDTA中键角∠NCC_______ (填“>”、“<”或“=”)∠CNC;
③钛与EDTA形成的配位离子中配位数为_______ 。
(3)常温下TiCl4为液体,ZrCl4为易升华的固体。两者熔点不同的原因是_______ 。
(4)ZrO2是制作全瓷牙的主要原料。ZrO2的晶体有立方晶相(如图3)、单斜晶相(如图4,微粒未画出,微粒分布与立方晶相相似,晶胞参数α=γ=900≠β,apm、bpm、cpm)等。
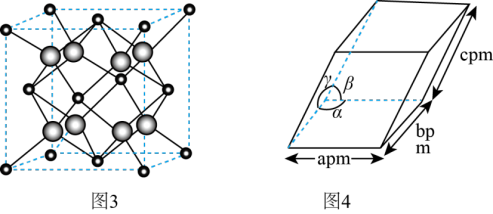
①ZrO2立方晶相中,与Zr等距离且最近的O围成的几何图形是_______ 。
②设阿伏加德罗常数的值为NA,则单斜晶相ZrO2的密度为_______ g·cm-3(列出含字母的计算表达式)。
(1)锆为第五周期元素,基态原子的价层电子排布式为
(2)钛与EDTA(乙二胺四乙酸根离子,结构如图1)形成的配位离子如图2所示。

①EDTA中所含元素的电负性从大到小的顺序为
②EDTA中键角∠NCC
③钛与EDTA形成的配位离子中配位数为
(3)常温下TiCl4为液体,ZrCl4为易升华的固体。两者熔点不同的原因是
(4)ZrO2是制作全瓷牙的主要原料。ZrO2的晶体有立方晶相(如图3)、单斜晶相(如图4,微粒未画出,微粒分布与立方晶相相似,晶胞参数α=γ=900≠β,apm、bpm、cpm)等。

①ZrO2立方晶相中,与Zr等距离且最近的O围成的几何图形是
②设阿伏加德罗常数的值为NA,则单斜晶相ZrO2的密度为
您最近一年使用:0次
9 . 锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为_______ ,最高能级电子的电子云轮廓形状为_______ 。
(2)比较下列锗卤化物的熔点和沸点,分析其变化的原因_______ 。
(3)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是_______ 。
(4)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为_______ ,微粒之间存在的作用力是_______ 。
(5)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为( ,0,
,0, );C为(
);C为( ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为_______ 。
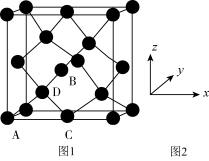
②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a=565.76pm,其密度为_______ g·cm-3(列出计算式即可)。
(1)基态Ge原子的核外电子排布式为
(2)比较下列锗卤化物的熔点和沸点,分析其变化的原因
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | −49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
(4)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为
(5)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(
 ,0,
,0, );C为(
);C为(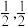 ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为
②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a=565.76pm,其密度为
您最近一年使用:0次
解题方法
10 . 用“>”、“<”、“=”填空
(1)第一电离能:P_______ S;
(2)酸性:H3PO4_______ H2SO4;
(3)稳定性:H2O_______ H2S
(4)微粒半径:S_______ S2-
(5)碱性:KOH_______ NaOH
(6)元素的电负性:S_______ Cl。
(1)第一电离能:P
(2)酸性:H3PO4
(3)稳定性:H2O
(4)微粒半径:S
(5)碱性:KOH
(6)元素的电负性:S
您最近一年使用:0次



