名校
1 . 碳、硫、氧、氮是中学常见元素,下列说法不正确的是
A. 、 、 、 、 都是直线形分子 都是直线形分子 |
B. 、 、 、 、 的键角依次减小 的键角依次减小 |
C. 、 、 分子的中心原子都是 分子的中心原子都是 化 化 |
| D.C、N、F元素的电负性依次增大 |
您最近一年使用:0次
2023-06-08更新
|
144次组卷
|
5卷引用:福建省三明市四地四校2021-2022学年高二下学期期中联考化学试题
22-23高三下·福建泉州·阶段练习
解题方法
2 . 点击化学(click chemistry)是一种能够让分子的构建模块快速、高效地结合在一起的化学反应。科学工作者可以利用基础模块搭建出变化无穷的造型,就如同玩乐高玩具一般。叠氨化物和块经合成抗真菌药物三唑是点击化学的重要应用,反应示例如下:
 +CH3CH2N3
+CH3CH2N3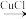

 +CH3CH2N3→
+CH3CH2N3→
回答下列问题:
(1) 的核外电子排布式为
的核外电子排布式为_______ 。
(2)C、N、Cu的电负性由大到小的顺序为_______ 。
(3)分子乙中存在5中心6电子的大 键,其中,提供两个电子形成大
键,其中,提供两个电子形成大 键(
键(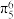 )的原子是
)的原子是_______ (填对应原子的序号)。
(4)分子中碳碳三键的活泼性:甲_______ 丙(填“>”“=”“<”),理由是_______ (从分子的结构角度分析)。
(5)丁形成的晶体中不存在的微粒间作用力有_______ 。
A.离子键 B.极性键 C.非极性键 D.氢键 E.范德华力
(6)CuCl的晶胞中, 的位置如图所示,
的位置如图所示, 填充于
填充于 构成的四面体空隙中。
构成的四面体空隙中。

① 的配位数为
的配位数为_______ 。
②由 构成的八面体空隙与有
构成的八面体空隙与有 填充的
填充的 构成的四面体空隙的数目之比为
构成的四面体空隙的数目之比为_______ 。
 +CH3CH2N3
+CH3CH2N3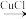

 +CH3CH2N3→
+CH3CH2N3→
回答下列问题:
(1)
 的核外电子排布式为
的核外电子排布式为(2)C、N、Cu的电负性由大到小的顺序为
(3)分子乙中存在5中心6电子的大
 键,其中,提供两个电子形成大
键,其中,提供两个电子形成大 键(
键(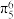 )的原子是
)的原子是(4)分子中碳碳三键的活泼性:甲
(5)丁形成的晶体中不存在的微粒间作用力有
A.离子键 B.极性键 C.非极性键 D.氢键 E.范德华力
(6)CuCl的晶胞中,
 的位置如图所示,
的位置如图所示, 填充于
填充于 构成的四面体空隙中。
构成的四面体空隙中。
①
 的配位数为
的配位数为②由
 构成的八面体空隙与有
构成的八面体空隙与有 填充的
填充的 构成的四面体空隙的数目之比为
构成的四面体空隙的数目之比为
您最近一年使用:0次
3 . 钛和锆为同族的元素,它们形成的化合物用途广泛。
(1)锆为第五周期元素,基态原子的价层电子排布式为_______ 。
(2)钛与EDTA(乙二胺四乙酸根离子,结构如图1)形成的配位离子如图2所示。
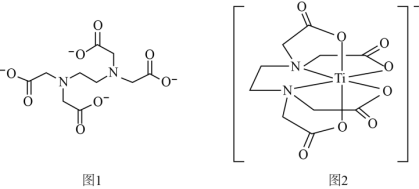
①EDTA中所含元素的电负性从大到小的顺序为_______ ;
②EDTA中键角∠NCC_______ (填“>”、“<”或“=”)∠CNC;
③钛与EDTA形成的配位离子中配位数为_______ 。
(3)常温下TiCl4为液体,ZrCl4为易升华的固体。两者熔点不同的原因是_______ 。
(4)ZrO2是制作全瓷牙的主要原料。ZrO2的晶体有立方晶相(如图3)、单斜晶相(如图4,微粒未画出,微粒分布与立方晶相相似,晶胞参数α=γ=900≠β,apm、bpm、cpm)等。
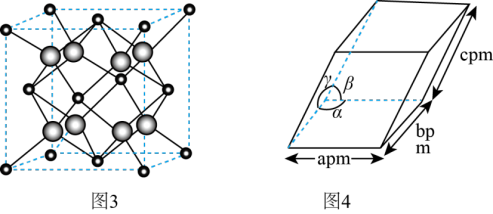
①ZrO2立方晶相中,与Zr等距离且最近的O围成的几何图形是_______ 。
②设阿伏加德罗常数的值为NA,则单斜晶相ZrO2的密度为_______ g·cm-3(列出含字母的计算表达式)。
(1)锆为第五周期元素,基态原子的价层电子排布式为
(2)钛与EDTA(乙二胺四乙酸根离子,结构如图1)形成的配位离子如图2所示。

①EDTA中所含元素的电负性从大到小的顺序为
②EDTA中键角∠NCC
③钛与EDTA形成的配位离子中配位数为
(3)常温下TiCl4为液体,ZrCl4为易升华的固体。两者熔点不同的原因是
(4)ZrO2是制作全瓷牙的主要原料。ZrO2的晶体有立方晶相(如图3)、单斜晶相(如图4,微粒未画出,微粒分布与立方晶相相似,晶胞参数α=γ=900≠β,apm、bpm、cpm)等。

①ZrO2立方晶相中,与Zr等距离且最近的O围成的几何图形是
②设阿伏加德罗常数的值为NA,则单斜晶相ZrO2的密度为
您最近一年使用:0次
4 . 锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为_______ ,最高能级电子的电子云轮廓形状为_______ 。
(2)比较下列锗卤化物的熔点和沸点,分析其变化的原因_______ 。
(3)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是_______ 。
(4)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为_______ ,微粒之间存在的作用力是_______ 。
(5)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为( ,0,
,0, );C为(
);C为(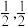 ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为_______ 。
②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a=565.76pm,其密度为_______ g·cm-3(列出计算式即可)。
(1)基态Ge原子的核外电子排布式为
(2)比较下列锗卤化物的熔点和沸点,分析其变化的原因
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | −49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
(4)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为
(5)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(
 ,0,
,0, );C为(
);C为(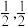 ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为
②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a=565.76pm,其密度为
您最近一年使用:0次
5 . 下列按电负性减小顺序排列的是
| A.K、Na、Li | B.As、P、N | C.N、O、F | D.O、S、Se |
您最近一年使用:0次
解题方法
6 . 一水合甘氨酸锌是一种矿物类饲料添加剂,其结构简式如图所示。下列说法错误的是


A.基态Zn原子价电子排布式为 |
B.Cu与Zn相邻,第一电离能: |
C.该物质中, 的配位数为5,配原子为O、N 的配位数为5,配原子为O、N |
D.电负性由小到大的顺序为 |
您最近一年使用:0次
2022-09-24更新
|
572次组卷
|
3卷引用:福建省泉州科技中学2021-2022学年高二下学期期末考试化学试题
解题方法
7 . 1932年美国化学家鲍林首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
请仔细分析,回答下列有关问题:
(1)预测周期表中电负性最大的元素应为_______ ;估计钙元素的电负性的取值范围:_______ <X<_______ 。
(2)经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为_______ 。
(3)请你预测Br与I元素的X数值的大小关系:X(Br)_______ X(I)。
(4)某有机化合物分子中含有S—N键,你认为该共用电子对偏向于_______ 原子(填元素符号)。
(5)根据表中的所给数据分析: 同主族内的不同元素的X值变化的规律是_______ ;
(6)化合物NaH能与水反应产生氢气,所以可用做生氢剂,写出该反应的化学方程式:_______ 。
(7)下列表述中,不能证明氯的非金属性比硫强的是_______ 。
A.气态氢化物的稳定性:HCl>H2S
B.两元素的电负性:S<Cl
C.最高价含氧酸的酸性:HClO4>H2SO4
D.常温时,硫单质为固态,氯单质为气态
E.两者间可发生反应:Cl2+H2S=2HCl+S↓
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
(1)预测周期表中电负性最大的元素应为
(2)经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为
(3)请你预测Br与I元素的X数值的大小关系:X(Br)
(4)某有机化合物分子中含有S—N键,你认为该共用电子对偏向于
(5)根据表中的所给数据分析: 同主族内的不同元素的X值变化的规律是
(6)化合物NaH能与水反应产生氢气,所以可用做生氢剂,写出该反应的化学方程式:
(7)下列表述中,不能证明氯的非金属性比硫强的是
A.气态氢化物的稳定性:HCl>H2S
B.两元素的电负性:S<Cl
C.最高价含氧酸的酸性:HClO4>H2SO4
D.常温时,硫单质为固态,氯单质为气态
E.两者间可发生反应:Cl2+H2S=2HCl+S↓
您最近一年使用:0次
名校
解题方法
8 . 科学研究发现铁氮化合物具有非常优异的磁性能、机械性能和耐腐蚀性,因此受到研究人员的广泛关注。γ−Fe4N是一种性能优异的铁氮化合物,其可由氨气与羰基铁粉[Fe(CO)5]反应得到。
(1)Fe变为Fe2+时是失去_______ 轨道电子。
(2)NH3中H−N−H的键角比NH 中H−N−H的键角
中H−N−H的键角_______ (填“大”或“小”)。
(3)羰基铁粉[Fe(CO)5]中配位原子为_______ 。
(4)氨气与羰基铁粉的反应中涉及元素电负性由大到小的顺序为_______ 。
(5)γ−Fe4N的晶胞如图所示,设晶胞中Fe1点的原子坐标为(0,0,0),N点的原子坐标为( ,
, ,
, ),则Fe2点的原子坐标为
),则Fe2点的原子坐标为_______ 。已知该晶体的密度为d g/cm3,阿伏加德罗常数的值为NA,则晶胞参数a为_______ nm(用含d和NA的代数式表示)。
(1)Fe变为Fe2+时是失去
(2)NH3中H−N−H的键角比NH
 中H−N−H的键角
中H−N−H的键角(3)羰基铁粉[Fe(CO)5]中配位原子为
(4)氨气与羰基铁粉的反应中涉及元素电负性由大到小的顺序为
(5)γ−Fe4N的晶胞如图所示,设晶胞中Fe1点的原子坐标为(0,0,0),N点的原子坐标为(
 ,
, ,
, ),则Fe2点的原子坐标为
),则Fe2点的原子坐标为
您最近一年使用:0次
2022-08-29更新
|
88次组卷
|
2卷引用:福建省龙岩第一中学2022-2023学年高三上学期第一次月考化学试题
解题方法
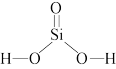
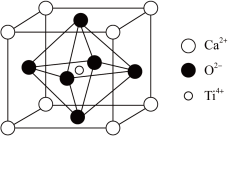
9 . 建盏由建阳坯土、天然矿物釉烧制,含有SiO2、Al2O3、Fe2O3、FeO、CaO、TiO2等化学成分。
(1)现代化学可利用_______ 特征谱线来鉴定建盏中的元素。
(2)建盏胎釉中含SiO2是硅酸的酸酐。硅酸结构式如图所示,硅原子的杂化方式_______ 。
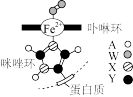
(3)Fe2+与蛋白质链上咪唑环通过配位键连接形成的物质结构如图所示。A、W、X、Y为短周期前10号主族元素。四种元素的电负性由大到小的顺序为_______ (用元素符号表示)。
(4)元素Fe在周期表中的位置为_______ ;其第三电离能(I3)为2957 KJ· mol-1、第四电离能(I4)为5290 KJ· mol-1,I4远大于I3的原因为_______ 。
(5)建盏胎釉矿石中的钙钛矿晶胞如图所示,Ti4+处于6个O2-组成的_______ 空隙中,在钙钛矿晶胞结构的另一种表示中,Ti4+处于各顶角位置,则O2-处于_______ 位置(选填“面心”“体心”或“棱心”)。已知晶胞密度为 ρ g∙cm-3,则两个O2-离子间的最短距离为_______ nm(阿伏加德罗常数的值为NA,列出表达式)。
(1)现代化学可利用
(2)建盏胎釉中含SiO2是硅酸的酸酐。硅酸结构式如图所示,硅原子的杂化方式

(3)Fe2+与蛋白质链上咪唑环通过配位键连接形成的物质结构如图所示。A、W、X、Y为短周期前10号主族元素。四种元素的电负性由大到小的顺序为

(4)元素Fe在周期表中的位置为
(5)建盏胎釉矿石中的钙钛矿晶胞如图所示,Ti4+处于6个O2-组成的

您最近一年使用:0次
名校
解题方法
10 . 某种锂盐的结构如图所示,其阴离子由W、X、Y、Z四种同周期主族元素构成,X原子的最外层电子数是W原子的次外层电子数的3倍,化合物中除Li+外其它原子均满足8电子稳定结构。下列说法正确的是
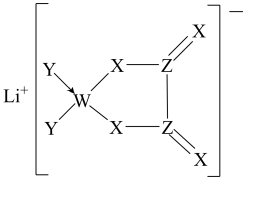

| A.W位于第2周期IVA族 | B.原子半径:Z>X>Y |
| C.元素电负性:Y>Z>X | D.最高化合价:Y>Z>W |
您最近一年使用:0次
2022-05-07更新
|
430次组卷
|
6卷引用:福建省龙岩市2022届高中毕业班第三次教学质量检测化学试题



