1 . 双极膜电渗析法制备缩水甘油(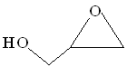 )的原理:将3-氯-1,2-丙二醇的水溶液通过膜M与双极膜之间的电渗析室,最终得到的缩水甘油纯度很高(几乎不含无机盐)。在直流电场的作用下,双极膜复合层间的
)的原理:将3-氯-1,2-丙二醇的水溶液通过膜M与双极膜之间的电渗析室,最终得到的缩水甘油纯度很高(几乎不含无机盐)。在直流电场的作用下,双极膜复合层间的 解离成
解离成 和
和 并分别通过阴膜和阳膜。下列说法正确的是
并分别通过阴膜和阳膜。下列说法正确的是
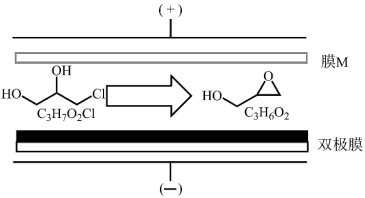
 )的原理:将3-氯-1,2-丙二醇的水溶液通过膜M与双极膜之间的电渗析室,最终得到的缩水甘油纯度很高(几乎不含无机盐)。在直流电场的作用下,双极膜复合层间的
)的原理:将3-氯-1,2-丙二醇的水溶液通过膜M与双极膜之间的电渗析室,最终得到的缩水甘油纯度很高(几乎不含无机盐)。在直流电场的作用下,双极膜复合层间的 解离成
解离成 和
和 并分别通过阴膜和阳膜。下列说法正确的是
并分别通过阴膜和阳膜。下列说法正确的是
| A.装置工作时,3-氯-1,2-丙二醇被氧化 |
| B.3-氯-1,2-丙二醇生成缩水甘油的过程中均有极性键和非极性键的断裂和生成 |
| C.上述转化物质涉及元素的第一电离能大到小排列顺序和电负性大到小排列顺序一致 |
D.装置工作时,阴极上发生的电极反应: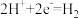 ↑ ↑ |
您最近一年使用:0次
2022-03-14更新
|
129次组卷
|
2卷引用:福建省三明第一中学2021-2022学年高二下学期第一次月考化学试题
名校
解题方法
2 . 下列说法错误的是
| A.石墨晶体中层内导电性强于层间导电性 |
| B.基态Cr3+的最高能层中成对电子与未成对电子的数目比为8∶3 |
| C.(CH3COO)2Ni·4H2O的空间构型为八面体,中心离子的配位数为6 |
| D.N元素的电负性比P元素的大,可推断NCl3分子的极性比PCl3的大 |
您最近一年使用:0次
2022-03-03更新
|
780次组卷
|
7卷引用:福建省漳平第二中学2021-2022学年高二下学期第一次月考化学试题
福建省漳平第二中学2021-2022学年高二下学期第一次月考化学试题山东省淄博市2022届高三下学期第一次模拟考试化学试题(已下线)提升卷05-【新高考新题型】2022年高考化学选择题标准化练习20卷(山东专用)(已下线)必刷卷03-2022年高考化学考前信息必刷卷(山东专用)湖北武汉市2022届高三5月第一次模拟考试化学试题(已下线)化学预测卷(四)-预测卷(浙江专版)江西省铜鼓中学2022-2023学年高二下学期4月月考化学试题
名校
3 . 短周期元素X、Y、Z、W、R的原子序数依次增大,Y与W同主族,Z与R同主族,它们形成的甲、乙两种物质(如图)是有机合成中常用的还原剂。下列说法正确的是
甲: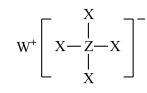 ,乙:
,乙: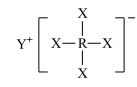
甲:
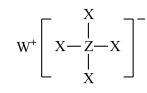 ,乙:
,乙: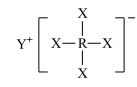
| A.电负性:X>Z>R |
| B.第一电离能:Y<Z<R |
| C.元素Z和R最高价氧化物对应的水化物都具有两性 |
| D.单质Y和W在空气中燃烧的产物所含化学键类型完全相同 |
您最近一年使用:0次
2022-03-03更新
|
723次组卷
|
6卷引用:福建省福安市第一中学2023届高三上学期第一次检测化学试题
福建省福安市第一中学2023届高三上学期第一次检测化学试题山东省淄博市2022届高三下学期第一次模拟考试化学试题广东省佛山市第四中学2021-2022学年高二下学期3月段考化学试题(已下线)专项08 物质结构 元素周期律-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)云南省富源县第一中学2021-2022学年高三下学期4月月考化学试题福建省福清虞阳中学2023-2024学年高三上学期第一次综合训练化学试题
4 . 钛硅分子筛是一种新型固体催化剂,可催化合成重要有机合成活性试剂甲乙酮肟(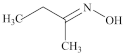 )。回答下列问题:
)。回答下列问题:
(1)基态硅原子的核外电子空间运动状态有___________ 种。
(2)甲乙酮肟中同周期三种元素电负性由大到小的顺序为___________ ,氮原子的杂化方式为___________ ,C=N与C-C键夹角___________ (填“<”“>”或“=”)C=N与N-O键夹角。
(3) 和
和 均是制备钛硅分子筛的重要中间体。
均是制备钛硅分子筛的重要中间体。
① 与光气
与光气 反应可用于制取四氯化钛。
反应可用于制取四氯化钛。 中σ键和π键的数目比为
中σ键和π键的数目比为___________ ,其空间构型为___________ 。
② 与金属
与金属 在高温条件下可反应生成
在高温条件下可反应生成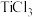 ,
,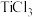 中
中 极易被氧化,还原性很强。试解释
极易被氧化,还原性很强。试解释 还原性强的原因
还原性强的原因___________ 。
 )。回答下列问题:
)。回答下列问题:(1)基态硅原子的核外电子空间运动状态有
(2)甲乙酮肟中同周期三种元素电负性由大到小的顺序为
(3)
 和
和 均是制备钛硅分子筛的重要中间体。
均是制备钛硅分子筛的重要中间体。①
 与光气
与光气 反应可用于制取四氯化钛。
反应可用于制取四氯化钛。 中σ键和π键的数目比为
中σ键和π键的数目比为②
 与金属
与金属 在高温条件下可反应生成
在高温条件下可反应生成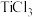 ,
,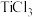 中
中 极易被氧化,还原性很强。试解释
极易被氧化,还原性很强。试解释 还原性强的原因
还原性强的原因
您最近一年使用:0次
5 . C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用。请回答下列问题:
(1)科学家常利用___________ 区分晶体SiO2和非晶体SiO2。
(2)基态Ge原子核外电子的空间运动状态有___________ 种。
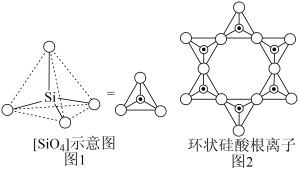
(3)Si为重要的半导体材料,硅与NaOH溶液反应生成Na2SiO3溶液,该溶液中四种元素电负性由小到大的顺序为___________ 。硅酸盐中的硅酸根离子通常以[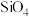 ]四面体(如图1所示)的方式形成链状、环状或网络状复杂阴离子,图2所示为一种环状硅酸根离子,写出其化学式:
]四面体(如图1所示)的方式形成链状、环状或网络状复杂阴离子,图2所示为一种环状硅酸根离子,写出其化学式:___________ 。
(4)实验中常用K3[Fe(CN)6]检验Fe2+,K3[Fe(CN)6]中Fe3+的配位数为___________ ,其中碳原子的杂化轨道类型为___________ 。1 mol K3[Fe(CN)6]中含有σ键与π键的数目之比为___________ 。
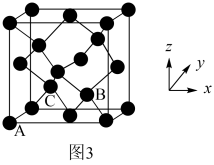
(5)灰锡的晶体结构(如图3所示)与金刚石相似,其中A处原子的原子分数坐标为(0,0,0),则C处原子的原子分数坐标为___________ 。
(1)科学家常利用
(2)基态Ge原子核外电子的空间运动状态有
(3)Si为重要的半导体材料,硅与NaOH溶液反应生成Na2SiO3溶液,该溶液中四种元素电负性由小到大的顺序为
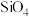 ]四面体(如图1所示)的方式形成链状、环状或网络状复杂阴离子,图2所示为一种环状硅酸根离子,写出其化学式:
]四面体(如图1所示)的方式形成链状、环状或网络状复杂阴离子,图2所示为一种环状硅酸根离子,写出其化学式:

(4)实验中常用K3[Fe(CN)6]检验Fe2+,K3[Fe(CN)6]中Fe3+的配位数为
(5)灰锡的晶体结构(如图3所示)与金刚石相似,其中A处原子的原子分数坐标为(0,0,0),则C处原子的原子分数坐标为
您最近一年使用:0次
名校
解题方法
6 . 下列对有关事实的原因分析错误的是
| 事实 | 原因 | |
| A | 白磷(P4)为正四面体分子 | 白磷分子中P−P键间的夹角是109°28′ |
| B | 分子内不同化学键之间存在一定的夹角 | 共价键具有方向性 |
| C | 键的极性H−O键>H−S键 | O的电负性大于S的电负性 |
| D | 通常状况下,1体积水溶解700体积氨气 | 氨是极性分子且有氢键的影响 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-01-24更新
|
1070次组卷
|
9卷引用:福建省连城县第一中学2021-2022学年高二下学期第一次月考化学试题
福建省连城县第一中学2021-2022学年高二下学期第一次月考化学试题山东省烟台市2021-2022学年高二上学期期末考试化学试题(已下线)第二章 分子结构与性质 章节过关检测-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)湖北省新高考联考协作体2021-2022学年高二3月考试化学试题山东省枣庄市第三中学2021-2022学年高二3月质量检测化学试题广东省佛山市顺德区第一中学 2021-2022学年高二下学期期中考试化学试题山东省沂南第一中学2021-2022学年高二4月月考化学试题(已下线)专题33 物质结构与性质基础-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)广东省深圳市盐田高级中学2022-2023学年高二下学期第一次月考化学试题
7 . 2021年5月15日,“天问一号” 火星控测器成功着陆火星。“天问一号”的着陆巡视器突破了高强度铝合金贮箱壳体材料、焊接、250N发动机硅化钼高温抗氧化涂层等多项关键技术,为“天问一号”提供了可靠、精准、稳定的动力。回答下列问题:
(1)钼与铬为同族元素,则钼位于周期表的___________ 区。
(2)铝锂合金是航天飞机低温外贮箱的壳体材料。在合金中加入钪,可大大增加合金的强度。基态钪原子的电子排布式为___________ 。
(3)氢气还原SiHCl3(Si的化合价为+4价),得到高纯硅。将高纯硅和钼高温化合制得硅化钼。SiHCl3的分子空间构型是___________ ;SiHCl3中所含元素电负性由大到小的顺序为___________ 。
(4)火星大气层的主要成分是二氧化碳,其次是氮气、氩气,此外还含有少量的氧气和水蒸气,若将这几种气体降温液化,最先液化的气体是___________ ,原因是___________ 。
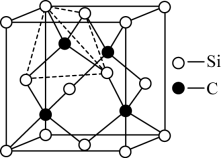
(5)文献报道,硅化钼涂层可提高碳化硅电热元件高温抗氧化性能,SiC的晶胞结构如图所示。晶体中硅原子的配位数为___________ 。图中晶胞含有硅原子数为___________ 。
(1)钼与铬为同族元素,则钼位于周期表的
(2)铝锂合金是航天飞机低温外贮箱的壳体材料。在合金中加入钪,可大大增加合金的强度。基态钪原子的电子排布式为
(3)氢气还原SiHCl3(Si的化合价为+4价),得到高纯硅。将高纯硅和钼高温化合制得硅化钼。SiHCl3的分子空间构型是
(4)火星大气层的主要成分是二氧化碳,其次是氮气、氩气,此外还含有少量的氧气和水蒸气,若将这几种气体降温液化,最先液化的气体是
(5)文献报道,硅化钼涂层可提高碳化硅电热元件高温抗氧化性能,SiC的晶胞结构如图所示。晶体中硅原子的配位数为

您最近一年使用:0次
名校
解题方法
8 . 根据元素性质递变规律,下列判断不正确的是
| A.酸性:H2SiO3 < H3PO4 < H2SO4 | B.电负性:F > Cl > Br > I |
| C.第一电离能:Na < Mg < Al | D.原子半径:N > O > F |
您最近一年使用:0次
2021-12-03更新
|
206次组卷
|
3卷引用:福建省莆田华侨中学2021-2022学年高二下学期期中考试化学试题
福建省莆田华侨中学2021-2022学年高二下学期期中考试化学试题(已下线)第1.2.2讲 元素周期律-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)浙江省绍兴市诸暨中学2021-2022学年高二上学期期中考试(平行班)化学试题
名校
9 . 下列叙述正确的是
| A.钾原子由激发态转变为基态可获得吸收光谱 |
B.磷化铜(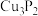 )用于制造磷青铜,电负性: )用于制造磷青铜,电负性: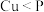 |
C.用原子轨道描述氢分子中化学键的形成: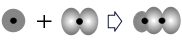 |
D.俗称光气的二氯甲醛(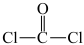 )分子中 )分子中 键角恰好为 键角恰好为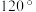 |
您最近一年使用:0次
2021-07-20更新
|
244次组卷
|
3卷引用:福建省连城县第一中学2021-2022学年高二下学期月考(二)化学试题
10 . 科学工作者合成了含镁、镍、碳3种元素的超导材料,具有良好的应用前景,回答下列问题:
(1)镍元素位于周期表第_______ 列,基态镍原子d轨道中成对电子与单电子的数量比为_______ 。
(2)在CO分子中,C与O之间形成_______ 个σ键、_______ 个π键,在这些化学键中,O原子共提供了_______ 个电子。
(3)第二周期元素的第一电离能(I1)随原子序数(Z)的变化情况如图。I1随Z的递增而呈增大趋势的原因是_______ 。原子核对外层电子的引力增大,导致I1在a点出现齿峰的原因是_______ 。
(4)VA族元素及其化合物在生产、生活中用途广泛。如P4S3常用于制造火柴,As4S4俗称雄黄,那么
①P、S、As电负性由大到小的顺序是_______ 。
②NH3、PH3、AsH3中沸点最高的是_______ ,其主要原因是_______ 。
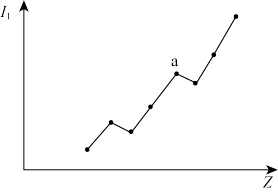
(1)镍元素位于周期表第
(2)在CO分子中,C与O之间形成
(3)第二周期元素的第一电离能(I1)随原子序数(Z)的变化情况如图。I1随Z的递增而呈增大趋势的原因是
(4)VA族元素及其化合物在生产、生活中用途广泛。如P4S3常用于制造火柴,As4S4俗称雄黄,那么
①P、S、As电负性由大到小的顺序是
②NH3、PH3、AsH3中沸点最高的是

您最近一年使用:0次
2021-05-11更新
|
128次组卷
|
2卷引用:福建省晋江市磁灶中学等校2022-2023学年高三上学期期中联考化学试题



