解题方法
1 . 已知①~⑦号元素在周期表中的位置如图。请回答下列问题:
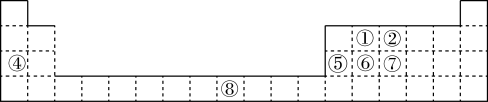
(1)基态③原子核外有____ 种空间运动状态不同的电子,其中能量最高的电子所在原子轨道的电子云轮廓图为____ 形。
(2)①、④、⑥三种元素的电负性由大到小的顺序为____ (用元素符号表示)。
(3)⑧位于元素周期表中____ (填“s、p、d或ds”)区,与⑧位于同一周期且含有相同未成对电子数的元素为____ (填元素符号)。
(4)①和⑤可形成一种黄色晶体,熔点2200℃,熔融态不导电。该晶体的类型为____ 。
(5)⑦号元素的五氯化物是共价化合物,其分子的空间结构为三角双锥形,依靠sp3d杂化形成。②和⑦同主族,但不存在②号元素的五氯化物,从原子结构的角度分析其原因是____ 。

(1)基态③原子核外有
(2)①、④、⑥三种元素的电负性由大到小的顺序为
(3)⑧位于元素周期表中
(4)①和⑤可形成一种黄色晶体,熔点2200℃,熔融态不导电。该晶体的类型为
(5)⑦号元素的五氯化物是共价化合物,其分子的空间结构为三角双锥形,依靠sp3d杂化形成。②和⑦同主族,但不存在②号元素的五氯化物,从原子结构的角度分析其原因是
您最近一年使用:0次
解题方法
2 . 化合物A是一种新型锅炉水除氧剂,其结构式如图所示: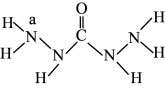 ,下列说法正确的是
,下列说法正确的是
 ,下列说法正确的是
,下列说法正确的是A.碳、氮元素的电负性比较是 |
B.氮原子与碳原子分别为 杂化与 杂化与 杂化 杂化 |
C. 分子中所含 分子中所含 键、 键、 键的数目之比为10∶1 键的数目之比为10∶1 |
| D.编号为a的氮原子和与其成键的另外三个原子在同一平面内 |
您最近一年使用:0次
3 . 按要求回答下列问题:
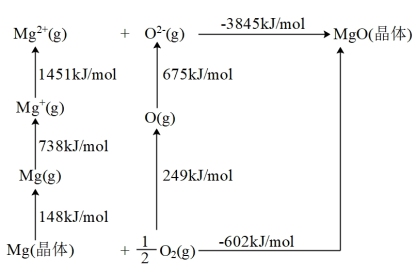
(1)MgO的Born-Haber循环如图所示。O=O键键能为_______ kJ·mol-1,Mg原子的第一电离能为_______ kJ·mol-1。
(2)已知共价键的键能:Cl-Cl:243 kJ·mol-1,Si-Si:176 kJ·mol-1,Si-Cl:360 kJ·mol-1,则反应Si(s)+2Cl2(g)=SiCl4(g) △H=_______ kJ·mol-1
(3)元素的化合价与元素的电负性、原子所处的具体的化学环境紧密相关。如:有机化合物CH3I发生水解时的反应为:CHЗI+H2O→CHЗOH+HI,已知有机化合物CFЗI中I为+1价,请写出CF3I发生水解反应的化学方程式:_______ 。
(1)MgO的Born-Haber循环如图所示。O=O键键能为

(2)已知共价键的键能:Cl-Cl:243 kJ·mol-1,Si-Si:176 kJ·mol-1,Si-Cl:360 kJ·mol-1,则反应Si(s)+2Cl2(g)=SiCl4(g) △H=
(3)元素的化合价与元素的电负性、原子所处的具体的化学环境紧密相关。如:有机化合物CH3I发生水解时的反应为:CHЗI+H2O→CHЗOH+HI,已知有机化合物CFЗI中I为+1价,请写出CF3I发生水解反应的化学方程式:
您最近一年使用:0次
解题方法
4 . O、S、Cl、Fe、Cu五种元素的单质及其化合物在工农业生产和生活中有着广泛的应用。请回答下列问题:
(1)基态Fe原子价电子的轨道表示式为_______ 。
(2)O、S、Cl的电负性由大到小的顺序是_______ (填元素符号)。
(3)O、S的最简单氢化物中键角较大的是_______ (填化学式),原因是_______ 。
(4) 的空间结构为
的空间结构为_______ 。
(5)O、Cu组成的一种化合物的晶胞结构示意图如下。
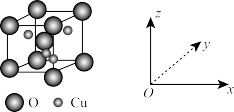
则该化合物的化学式为_______ 。
(1)基态Fe原子价电子的轨道表示式为
(2)O、S、Cl的电负性由大到小的顺序是
(3)O、S的最简单氢化物中键角较大的是
(4)
 的空间结构为
的空间结构为(5)O、Cu组成的一种化合物的晶胞结构示意图如下。

则该化合物的化学式为
您最近一年使用:0次
解题方法
5 . 第三代半导体中,碳化硅(SiC)和氮化镓(GaN)是核心半导体。它们具有更宽的禁带宽度、更高的导热率、更高的抗辐射能力、更大的电子饱和漂移速率等特性。
(1)基态Ga原子的价电子排布式为_______ 。
(2)晶体硅、碳化硅、金刚石三种晶体的熔点由高到低的顺序为_______ 。
(3)氮化镓不存在于自然界中,只能通过人工合成来制备,反应为 。
。
①GaCl3熔点为77.9℃,其晶体类型为_______ 。GaF3的熔点为1000℃,则将GaF3熔化时,被破坏的作用力是_______ 。
②上述反应涉及的元素中,电负性最小的是_______ (填元素符号,下同),第一电离能最大的是_______ 。
(1)基态Ga原子的价电子排布式为
(2)晶体硅、碳化硅、金刚石三种晶体的熔点由高到低的顺序为
(3)氮化镓不存在于自然界中,只能通过人工合成来制备,反应为
 。
。①GaCl3熔点为77.9℃,其晶体类型为
②上述反应涉及的元素中,电负性最小的是
您最近一年使用:0次
6 . 下列各项叙述中,正确的是
| A.d区中,族序数最大、原子序数最小的元素,它+3价离子比+2价离子稳定 |
| B.最外层电子数为ns2的原子,其价电子数也为2 |
| C.第一电离能越大,元素的电负性也越大 |
| D.“电子云”中的小黑点是电子在核外某空间内出现过的痕迹 |
您最近一年使用:0次
2022-04-25更新
|
129次组卷
|
2卷引用:福建省福州市八县(市)一中2021-2022学年高二下学期期中联考化学试题
解题方法
7 . 前四周期的A、B、C、D、E、F六种元素,原子序数依次增大。基态A原子核外电子的L层电子数是K层的2倍;B原子基态时的2p轨道上未成对的电子数最多;C元素为最活泼的非金属元素;D元素核外有3个电子层,最外层电子数是核外电子总数的 ;E元素正三价离子的3d轨道为半充满状态;F元素与B元素位于同一主族,其某种氧化物有剧毒。
;E元素正三价离子的3d轨道为半充满状态;F元素与B元素位于同一主族,其某种氧化物有剧毒。
(1)E元素在周期表中位置为_______ ,E3+价电子轨道表示式为_______ 。
(2)B、C、F三种元素电负性由大到小的顺序为_______ (用元素符号表示),第一电离能D_______ (填“>”、“<”或“=”)Al,其原因是_______ 。
(3)相同条件下,A、B的简单氢化物在水中溶解度较大的是_______ (填化学式),理由是_______ 。
(4)F元素可能的性质_______ (填标号)。
 ;E元素正三价离子的3d轨道为半充满状态;F元素与B元素位于同一主族,其某种氧化物有剧毒。
;E元素正三价离子的3d轨道为半充满状态;F元素与B元素位于同一主族,其某种氧化物有剧毒。(1)E元素在周期表中位置为
(2)B、C、F三种元素电负性由大到小的顺序为
(3)相同条件下,A、B的简单氢化物在水中溶解度较大的是
(4)F元素可能的性质
| A.其单质可作半导体材料 |
| B.存在-3、+3、+5等多种化合价 |
| C.最高价氧化物对应的水化物是强酸 |
| D.单质还原性弱于磷单质 |
您最近一年使用:0次
2022-04-16更新
|
299次组卷
|
3卷引用:福建省龙岩市一级校联盟(九校)2021-2022学年高二下学期期中联考化学试题
名校
解题方法
8 . 按要求回答下列问题
(1)中国古代四大发明之一-黑火药,它的爆炸反应为:2KNO3 + 3C+S A + N2↑+ 3CO2↑(已配平)
A + N2↑+ 3CO2↑(已配平)
①除S外,上列元素的电负性从大到小依次为_______ 。
②在生成物中,A的电子式_______ ,含极性共价键的分子的中心原子轨道杂化类型为_______ 。
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为_______ 。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为_______ ,Q2+的未成对电子数是_______ 。
(3)ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
①O、S、Se原子的第一电离能由大到小的顺序为_______ 。
②H2Se的酸性比H2S_______ (填“强”或“弱”)。气态SeO3分子的价层电子对互斥模型为_______ ,SeO 离子中Se的杂化方式为
离子中Se的杂化方式为_______ 。
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是_______ 。
(5)已知Ti3+可形成配位数为6的配合物。现有紫色和绿色两种含钛晶体的配合物,其组成均为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种晶体的样品配成溶液;
b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤,经洗涤干燥后称量,发现绿色晶体产生沉淀的质量为紫色晶体产生沉淀质量的三分之二。则绿色晶体的配合物为_______ 。
(1)中国古代四大发明之一-黑火药,它的爆炸反应为:2KNO3 + 3C+S
 A + N2↑+ 3CO2↑(已配平)
A + N2↑+ 3CO2↑(已配平)①除S外,上列元素的电负性从大到小依次为
②在生成物中,A的电子式
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为
(3)ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
①O、S、Se原子的第一电离能由大到小的顺序为
②H2Se的酸性比H2S
 离子中Se的杂化方式为
离子中Se的杂化方式为(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是
(5)已知Ti3+可形成配位数为6的配合物。现有紫色和绿色两种含钛晶体的配合物,其组成均为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种晶体的样品配成溶液;
b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤,经洗涤干燥后称量,发现绿色晶体产生沉淀的质量为紫色晶体产生沉淀质量的三分之二。则绿色晶体的配合物为
您最近一年使用:0次
解题方法
9 . 一种高储能电池的电解液微观结构如图,R、W、X、Y、Z、M为原子序数依次增大的短周期元素,M的原子半径大于Z。下列说法正确的是


| A.电负性:R<W | B.简单氢化物的熔点:W<M |
C. 呈四面体 呈四面体 | D.最高价氧化物对应水化物的酸性:Y<X |
您最近一年使用:0次
名校
10 . 石墨烯具有优异的光学、电学、力学特性,在材料学、微纳加工、能源和生物医学等方面具有广阔的应用前景,石墨烯可采用化学方法制备,如以六氯苯、六溴苯为原料可制备石墨烯。下表是六氯苯、六溴苯、苯六酸的熔点和水溶性:
下列说法正确的是
| 物质 | 六氯苯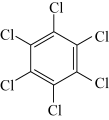 | 六溴苯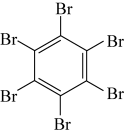 | 苯六酸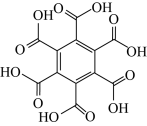 |
| 熔点/℃ | 231 | 325 | 287 |
| 水溶性 | 不溶 | 不溶 | 易溶 |
| A.苯六酸所含元素的电负性:C>O>H |
| B.从结构上看,六氯苯、六溴苯和苯六酸均为极性分子 |
| C.六氯苯、六溴苯和苯六酸分子中C的杂化方式均为sp2杂化 |
| D.苯六酸与六氯苯、六溴苯的水溶性存在明显的差异是因为其分子结构庞大 |
您最近一年使用:0次
2022-03-20更新
|
444次组卷
|
9卷引用:福建省名校联盟2021-2022学年高二下学期期中考试化学试题.
福建省名校联盟2021-2022学年高二下学期期中考试化学试题.湖南省2021-2022学年高二下学期3月大联考化学试题河北省邢台市四校联考2021-2022学年高二下学期第二次月考化学试题山东省名校联盟2021-2022学年高二下学期质量检测联合调考化学试题山东省名校联盟2021-2022学年高二下学期质量检测联合调考化学(B2)试题吉林省吉林市第一中学2021-2022学年高二下学期第一次质量检测化学试题广东省名校联盟2021-2022学年高二下学期4月大联考化学试题内蒙古额尔古纳市第一中学2021-2022学年高二下学期阶段性考试化学试题辽宁省抚顺市第一中学2022届高三下学期5月模拟考试化学试题



