1 . 某化学兴趣小组对BeCl2是离子化合物还是共价化合物进行探究,从经验看铍是金属元素,易失去电子,氯是非金属元素,易得到电子。
(1)查表得知,Be的电负性是1.5,Cl的电负性是3.0,则BeCl2应为_______ (填“离子”或“共价”)化合物。
(2)工业上制取BeCl2的方法是将得到的BeCl2溶液在HCl气流中蒸干灼烧,防止BeCl2水解,请写出BeCl2水解的化学方程式:_______ 。
(3)经实验验证,熔融的BeCl2不能导电,说明它是_______ (填“离子”或“共价”)化合物;BeCl2能溶于水,水溶液能导电,是因为它在溶液中能电离,写出它的电离方程式:_______ 。
(4)在周期表中,铍元素和铝元素恰好处于对角线位置,根据对角线法则,BeCl2应与_______ (填“MgCl2”或“AlCl3”)的化学性质更相似。
(5)氢氧化铍能与氢氧化钠溶液发生反应,写出该反应的化学方程式:_______ 。
(1)查表得知,Be的电负性是1.5,Cl的电负性是3.0,则BeCl2应为
(2)工业上制取BeCl2的方法是将得到的BeCl2溶液在HCl气流中蒸干灼烧,防止BeCl2水解,请写出BeCl2水解的化学方程式:
(3)经实验验证,熔融的BeCl2不能导电,说明它是
(4)在周期表中,铍元素和铝元素恰好处于对角线位置,根据对角线法则,BeCl2应与
(5)氢氧化铍能与氢氧化钠溶液发生反应,写出该反应的化学方程式:
您最近一年使用:0次
2 . A、B、C、D、E、F、G为周期表前四周期元素,原子序数依次增大。A元素的价电子构型为 ;C元素为最活泼的非金属元素;D元素核外有三个电子层,最外层电子数是核外电子总数的1/6;E元素正三价阳离子的
;C元素为最活泼的非金属元素;D元素核外有三个电子层,最外层电子数是核外电子总数的1/6;E元素正三价阳离子的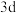 轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。回答下列问题:
轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。回答下列问题:
(1)第一电离能:A__________ B,电负性:C__________ B(填“>”“=”或“<”)
(2)基态D原子核外电子的运动状态有___________ 种。
(3)元素E在周期表中的位置是______________ 。F属于周期表的__________ 区。
(4)基态G原子的价电子排布式为_____________________ 。
 ;C元素为最活泼的非金属元素;D元素核外有三个电子层,最外层电子数是核外电子总数的1/6;E元素正三价阳离子的
;C元素为最活泼的非金属元素;D元素核外有三个电子层,最外层电子数是核外电子总数的1/6;E元素正三价阳离子的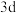 轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。回答下列问题:
轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。回答下列问题:(1)第一电离能:A
(2)基态D原子核外电子的运动状态有
(3)元素E在周期表中的位置是
(4)基态G原子的价电子排布式为
您最近一年使用:0次
解题方法
3 . 下列是原子基态的最外层电子排布,其电负性最大的是
| A.2s2 | B.2s22p 1 | C.3s23p4 | D.2s22p5 |
您最近一年使用:0次
2022-10-24更新
|
799次组卷
|
4卷引用:黑龙江省饶河县高级中学2021-2022学年高二下学期第一次月考化学试题
黑龙江省饶河县高级中学2021-2022学年高二下学期第一次月考化学试题(已下线)【知识图鉴】单元讲练测选择性必修2第1章02基础练第一章 原子结构与性质(A卷·知识通关练)-2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修2)(已下线)第一章 原子结构与性质(A卷)
名校
解题方法
4 . 下表是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号,其中J为0族元素。下列说法正确的是
| X | Y | Z | |
| R | |||
| W | |||
| J |
A.R原子的核外电子的轨道表示式为  |
| B.R2-与Na+的半径大小关系为R2-<Na+ |
| C.X的第一电离能小于Y的第一电离能 |
| D.表中电负性最大的元素为Z |
您最近一年使用:0次
名校
解题方法
5 . 硼的化合物在生产、生活和科研中应用广泛。回答下列问题:
(1)基态硼原子的电子排布图为:_____ ;B、N、H的电负性由大到小的顺序为_____ 。
(2)科学家合成了一种含硼阴离子[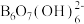 ],其结构如图1所示。其中硼原子的杂化方式为
],其结构如图1所示。其中硼原子的杂化方式为_______ ,该结构中共有_______ 种不同化学环境的氧原子。

图1
(3) 与
与 结合形成固态化合物
结合形成固态化合物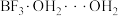 ,该物质在6.2℃时熔化电离出
,该物质在6.2℃时熔化电离出 和一种含硼阴离子
和一种含硼阴离子_______ (填离子符号); 空间构型为
空间构型为_______ 。
(1)基态硼原子的电子排布图为:
(2)科学家合成了一种含硼阴离子[
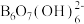 ],其结构如图1所示。其中硼原子的杂化方式为
],其结构如图1所示。其中硼原子的杂化方式为
图1
(3)
 与
与 结合形成固态化合物
结合形成固态化合物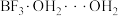 ,该物质在6.2℃时熔化电离出
,该物质在6.2℃时熔化电离出 和一种含硼阴离子
和一种含硼阴离子 空间构型为
空间构型为
您最近一年使用:0次
6 . 下面是几种元素原子的基态电子排布式,其中所表示的元素电负性最大的是
| A.1s22s22p5 | B.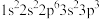 | C.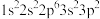 | D. |
您最近一年使用:0次
7 . 填写下列空白[第(1)~(3)小题用元素符号填写]。
(1)第三周期简单离子半径最小的离子为_______ 。
(2)前四周期第一电离能最大的元素为_______ 。
(3)周期表中电负性最大的元素为_______ 。
(4)前四周期元素中未成对电子数最多的元素基态原子价电子轨道表式为_______ 。
(5) 、HCOOH、
、HCOOH、 的酸性由强到弱的顺序为
的酸性由强到弱的顺序为_______ 。
(1)第三周期简单离子半径最小的离子为
(2)前四周期第一电离能最大的元素为
(3)周期表中电负性最大的元素为
(4)前四周期元素中未成对电子数最多的元素基态原子价电子轨道表式为
(5)
 、HCOOH、
、HCOOH、 的酸性由强到弱的顺序为
的酸性由强到弱的顺序为
您最近一年使用:0次
8 . 法国一家公司研发出一种比锂电池成本更低、寿命更长、充电速度更快的钠离子电池,该电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解液为NaClO4的碳酸丙烯酯溶液。回答下列问题:
(1)C、O、Cl三种元素电负性由大到小的顺序为_______ 。
(2)基态Na原子中,核外不同电子运动状态的数目为_______ ,Co属于元素周期表中_______ 区元素,其基态原子的价电子排布式为_______ 。
(3)碳酸丙烯酯的结构简式如图所示,其中碳原子的杂化轨道类型为_______ ,1mol碳酸丙烯酯中σ键的数目为_______ 。

(4)Na和O形成的离子化合物的晶胞结构如图所示,已知该晶胞的密度为ρg·cm-3,阿伏加德罗常数的值为NA,则Na与O之间的最短距离为_______ cm(用含有ρ、NA的代数式表示)。
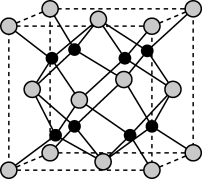
(1)C、O、Cl三种元素电负性由大到小的顺序为
(2)基态Na原子中,核外不同电子运动状态的数目为
(3)碳酸丙烯酯的结构简式如图所示,其中碳原子的杂化轨道类型为

(4)Na和O形成的离子化合物的晶胞结构如图所示,已知该晶胞的密度为ρg·cm-3,阿伏加德罗常数的值为NA,则Na与O之间的最短距离为

您最近一年使用:0次
名校
9 . 下列有关元素周期表及其分区的理解不正确的是
| A.元素周期表的每个周期中最后一种元素是稀有气体元素 |
| B.基态原子最外层电子排布为ns2的元素都位于周期表第IIA族 |
| C.主族元素处于元素周期表的s区和p区 |
| D.电负性最大的元素位于周期表的右上角(稀有气体除外) |
您最近一年使用:0次
2022-04-21更新
|
754次组卷
|
8卷引用:黑龙江省哈尔滨市宾县第二中学2021-2022学年高二下学期期末考试化学试题
名校
10 . 意大利科学家获得了极具研究价值的N4(分子结构如图所示),以下有关物质结构的说法正确的是

A.N均是以sp3杂化,N-N均为 键 键 |
| B.N的电负性大于O,所以NH3的沸点低于H2O |
| C.N4空间结构为正四面体,夹角为109.28' |
| D.N原子核外有5个未成对电子 |
您最近一年使用:0次
2022-04-19更新
|
125次组卷
|
3卷引用:黑龙江省大庆中学2021-2022学年高二下学期第一次月考化学试题



