硼的化合物在生产、生活和科研中应用广泛。回答下列问题:
(1)基态硼原子的电子排布图为:_____ ;B、N、H的电负性由大到小的顺序为_____ 。
(2)科学家合成了一种含硼阴离子[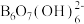 ],其结构如图1所示。其中硼原子的杂化方式为
],其结构如图1所示。其中硼原子的杂化方式为_______ ,该结构中共有_______ 种不同化学环境的氧原子。

图1
(3) 与
与 结合形成固态化合物
结合形成固态化合物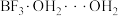 ,该物质在6.2℃时熔化电离出
,该物质在6.2℃时熔化电离出 和一种含硼阴离子
和一种含硼阴离子_______ (填离子符号); 空间构型为
空间构型为_______ 。
(1)基态硼原子的电子排布图为:
(2)科学家合成了一种含硼阴离子[
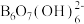 ],其结构如图1所示。其中硼原子的杂化方式为
],其结构如图1所示。其中硼原子的杂化方式为
图1
(3)
 与
与 结合形成固态化合物
结合形成固态化合物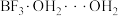 ,该物质在6.2℃时熔化电离出
,该物质在6.2℃时熔化电离出 和一种含硼阴离子
和一种含硼阴离子 空间构型为
空间构型为
更新时间:2022-06-01 16:17:05
|
相似题推荐
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐1】硼元素及其化合物具有各异的结构与性质。氮化硼(BN)晶体有多种相结构。六方相氮化硼(I)与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼(II)是超硬材料,有优异的耐磨性。它们的晶体结构如下图所示。
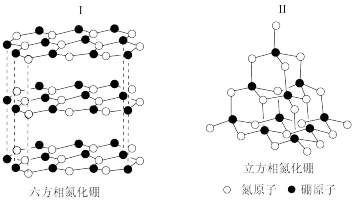
(1)基态硼原子的电子排布式为_______ ,同周期中第一电离能小于硼的元素有_______ 种。
(2)关于这两种晶体的说法,正确的是_______ (填序号)。
a.I中存在分子间作用力 b.II含有σ键和π键,所以硬度大
c.I与II结构中B:B−N的值相同 d.两种晶体中的B−N键均为共价键
(3)I中硼原子的杂化轨道类型为_______ ,判断其是否导电并说明原因_______ 。
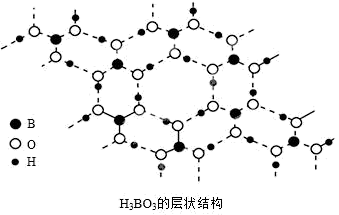
(4)常温常压下硼酸( )晶体结构为层状,其二维平面结构如图所示。1mol
)晶体结构为层状,其二维平面结构如图所示。1mol 晶体中含有
晶体中含有_______ mol氢键。
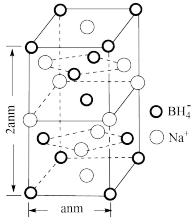
(5)硼氢化钠是一种常用的还原剂。其晶胞结构如图所示。回答下列问题:
① 分子中的O−B−O的键角
分子中的O−B−O的键角_______ (填“大于”“等于”或“小于”) 中的H−B−H的键角,判断依据是
中的H−B−H的键角,判断依据是_______ 。
②晶胞参数如图所示,已知晶胞密度为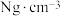 ,则阿伏加德罗常数可以表示为
,则阿伏加德罗常数可以表示为_________ ,(已知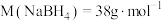 ,列出计算式即可);若硼氢化钠晶胞上下底心处的
,列出计算式即可);若硼氢化钠晶胞上下底心处的 被
被 取代,得到的晶体的化学式为
取代,得到的晶体的化学式为_______ 。

(1)基态硼原子的电子排布式为
(2)关于这两种晶体的说法,正确的是
a.I中存在分子间作用力 b.II含有σ键和π键,所以硬度大
c.I与II结构中B:B−N的值相同 d.两种晶体中的B−N键均为共价键
(3)I中硼原子的杂化轨道类型为
(4)常温常压下硼酸(
 )晶体结构为层状,其二维平面结构如图所示。1mol
)晶体结构为层状,其二维平面结构如图所示。1mol 晶体中含有
晶体中含有
(5)硼氢化钠是一种常用的还原剂。其晶胞结构如图所示。回答下列问题:

①
 分子中的O−B−O的键角
分子中的O−B−O的键角 中的H−B−H的键角,判断依据是
中的H−B−H的键角,判断依据是②晶胞参数如图所示,已知晶胞密度为
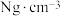 ,则阿伏加德罗常数可以表示为
,则阿伏加德罗常数可以表示为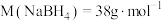 ,列出计算式即可);若硼氢化钠晶胞上下底心处的
,列出计算式即可);若硼氢化钠晶胞上下底心处的 被
被 取代,得到的晶体的化学式为
取代,得到的晶体的化学式为
您最近一年使用:0次
【推荐2】按要求完成下列问题:
Ⅰ.氧化锆(化学式为 )晶胞结构如图所示:
)晶胞结构如图所示:
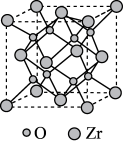
(1) 在晶胞中的配位数是
在晶胞中的配位数是______ ,若该晶胞的密度为 ,用
,用 表示
表示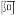 伏伽德罗常数的值,则该晶胞的体积是
伏伽德罗常数的值,则该晶胞的体积是______  (列出计算式)。(氧化锆的摩尔质量
(列出计算式)。(氧化锆的摩尔质量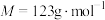 )
)
Ⅱ.Ce、Zr、Mn和Fe都是过渡金属元素,Mn与Fe两元素的部分电离能如下表所示。
(2)铁元素位于元素周期表______ 族,属于______ 区。
(3)比较两元素的 、
、 可知,气态
可知,气态 再失去1个电子比气态
再失去1个电子比气态 再失去1个电子更难,请从原子结构分析原因
再失去1个电子更难,请从原子结构分析原因______ 。
Ⅰ.氧化锆(化学式为
 )晶胞结构如图所示:
)晶胞结构如图所示:
(1)
 在晶胞中的配位数是
在晶胞中的配位数是 ,用
,用 表示
表示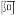 伏伽德罗常数的值,则该晶胞的体积是
伏伽德罗常数的值,则该晶胞的体积是 (列出计算式)。(氧化锆的摩尔质量
(列出计算式)。(氧化锆的摩尔质量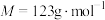 )
)Ⅱ.Ce、Zr、Mn和Fe都是过渡金属元素,Mn与Fe两元素的部分电离能如下表所示。
| 元素 | 电离能( ) ) | ||
 |  |  | |
| Mn | 717 | 1509 | 3248 |
| Fe | 759 | 1561 | 2957 |
(2)铁元素位于元素周期表
(3)比较两元素的
 、
、 可知,气态
可知,气态 再失去1个电子比气态
再失去1个电子比气态 再失去1个电子更难,请从原子结构分析原因
再失去1个电子更难,请从原子结构分析原因
您最近一年使用:0次
【推荐3】A、B、C、D、E、F六种元素原子序数依次增大,前四种为短周期元素,E、F位于第四周期。已知A是自然界中含量最多的元素;B、C、D同周期,且B在同周期元素中第一电离能最小;C的第一、二、三电离能分别为738 kJ·mol−1、1451 kJ·mol−1、7733 kJ·mol−1;D在同周期元素中(除稀有气体元素外)第一电离能最大;E元素为金属元素,常用于合成催化剂,其基态原子的价电子数为7;F元素的某种高价盐可用作城市饮用水的净水剂,比D的单质用于净水更安全环保,F基态原子的3d能级上有6个电子。
(1)试写出下列四种元素的元素符号:A_____ ;B_____ ;E_____ ;F_________ 。
(2)写出A、B两种元素组成的所有化合物的化学式:_____________ 。
(3)写出电解CD2的化学方程式:_____ 。
(4)E、F均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
E元素位于第ⅦB族,请画出基态E2+的价电子排布图:_____ ,F元素在周期表中的位置是_____ 。比较两元素的I2、I3可知,气态基态E2+再失去1个电子比气态基态F2+再失去1个电子更难,对此你的解释是:_____ 。
(1)试写出下列四种元素的元素符号:A
(2)写出A、B两种元素组成的所有化合物的化学式:
(3)写出电解CD2的化学方程式:
(4)E、F均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
| 元素 | E | F | |
| 电离能/ kJ·mol−1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
E元素位于第ⅦB族,请画出基态E2+的价电子排布图:
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐1】普鲁士蓝的部分或全部铁离子可以被其他过渡金属离子取代形成类普鲁士蓝化合物,其具有独特的空心微纳米结构可以增大电极和电解质的接触面积,为电化学反应提供更多的活性位点,可应用于析氢、析氧反应,超级电容器和金属离子电池等。某种普鲁士蓝面心立方体结构如图所示,晶格常数为11.02nm。回答下列问题:
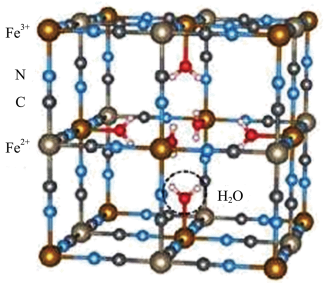
(1)写出Fe2+的核外电子排式为___________ 。
(2)写出一个与氰根离子(CN-)互为等电子体的分子的化学式___________ 。
(3)该晶体中与Fe3+形成配位键的配位原子有___________ (填元素名称);第一电离能最大的原子为___________ (填元素符号)。
(4)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态的Fe原子,其自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的Fe原子,其自旋磁量子数的代数和为___________ 。
(5)该普鲁士蓝晶体密度为___________ g·cm-3(写出未经化简的表达式)。
(6)普鲁士蓝晶体中少部分铁原子被钴或镍原子取代可形成类普鲁士蓝,其晶体结构基本不变,但性能更加优良。下列有关替代原子说法错误的是
a.都处于副族,结构相似 b.常见化合价为+2或+3
c.均属于d区元素 d.替代离子与原离子的离子半径相近
(7)常用K3[Fe(CN)6]制备类普鲁士蓝化合物。在0.1mol·L-1 K3[Fe(CN)6]溶液中滴加几滴0.1mol·L-1 KSCN溶液,是否有血红色溶液生成,请通过计算说明。___________ (写出分析过程)
(已知:Fe3++6SCN-=Fe(SCN)
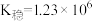 ;Fe3++6CN-=Fe(CN)
;Fe3++6CN-=Fe(CN)
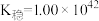 )。
)。

(1)写出Fe2+的核外电子排式为
(2)写出一个与氰根离子(CN-)互为等电子体的分子的化学式
(3)该晶体中与Fe3+形成配位键的配位原子有
(4)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用
 表示,与之相反的用
表示,与之相反的用 表示,称为电子的自旋磁量子数。对于基态的Fe原子,其自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的Fe原子,其自旋磁量子数的代数和为(5)该普鲁士蓝晶体密度为
(6)普鲁士蓝晶体中少部分铁原子被钴或镍原子取代可形成类普鲁士蓝,其晶体结构基本不变,但性能更加优良。下列有关替代原子说法错误的是
a.都处于副族,结构相似 b.常见化合价为+2或+3
c.均属于d区元素 d.替代离子与原离子的离子半径相近
(7)常用K3[Fe(CN)6]制备类普鲁士蓝化合物。在0.1mol·L-1 K3[Fe(CN)6]溶液中滴加几滴0.1mol·L-1 KSCN溶液,是否有血红色溶液生成,请通过计算说明。
(已知:Fe3++6SCN-=Fe(SCN)

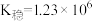 ;Fe3++6CN-=Fe(CN)
;Fe3++6CN-=Fe(CN)
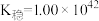 )。
)。
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
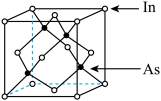
【推荐2】砷化铟(InAs)是一种优良的半导体化合物,有广泛用途。
(1)基态In的价层电子排布式为5s25p1,In在周期表中的位置是____________ 。
(2)在Ar保护下分别将InCl3和AsCl3在气化室中加热转化为蒸气,在反应室中混合反应,即可得到橘黄色的InAs晶体。已知:AsCl3和InCl3均为分子晶体。AsCl3沸点为130℃,InCl3沸点为500℃
①33As简化的电子排布式为___________ 。
②AsCl3分子的空间结构为___________ 。
③AsCl3沸点低于InCl3沸点的原因是___________ 。
④InCl3晶体中分子间存在配位键,配位原子是___________ 。
(3)InAs为原子之间以共价键的成键方式结合而成的晶体,其晶胞结构如图所示。已知该晶胞棱长为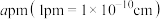 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,InAs的摩尔质量为Mg·mol-1,则该晶体的密度
,InAs的摩尔质量为Mg·mol-1,则该晶体的密度
___________ g·cm-3。
(1)基态In的价层电子排布式为5s25p1,In在周期表中的位置是
(2)在Ar保护下分别将InCl3和AsCl3在气化室中加热转化为蒸气,在反应室中混合反应,即可得到橘黄色的InAs晶体。已知:AsCl3和InCl3均为分子晶体。AsCl3沸点为130℃,InCl3沸点为500℃

①33As简化的电子排布式为
②AsCl3分子的空间结构为
③AsCl3沸点低于InCl3沸点的原因是
④InCl3晶体中分子间存在配位键,配位原子是
(3)InAs为原子之间以共价键的成键方式结合而成的晶体,其晶胞结构如图所示。已知该晶胞棱长为
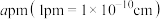 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,InAs的摩尔质量为Mg·mol-1,则该晶体的密度
,InAs的摩尔质量为Mg·mol-1,则该晶体的密度
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
解题方法
【推荐3】有A、B、C、D四种元素,其中A和B原子都有1个未成对电子,A+比B-少一个电子层。B原子得一个电子填入3p轨道后,3p轨道已充满。C原子的p轨道中有3个未成对电子,其气态氢化物的水溶液的pH在同族氢化物中最大。D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D40%,且其核内质子数等于中子数。据此判断:
(1)A是__ ,B是___ ,C是___ ,D是___ 。(填元素名称)
(2)B-的电子排布式___ ,A+的结构示意图___ ,D原子的轨道表示式__ 。
(3)在A、B、D三种元素的简单离子中,半径最小的是___ ,其离子还原性最强的是__ 。(填离子符号)
(4)AB电子式___ 。
(1)A是
(2)B-的电子排布式
(3)在A、B、D三种元素的简单离子中,半径最小的是
(4)AB电子式
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐1】卤族元素能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解。
(1)下面曲线(图1)表示卤族元素某种性质随核电荷数的变化趋势。正确的是___ 。
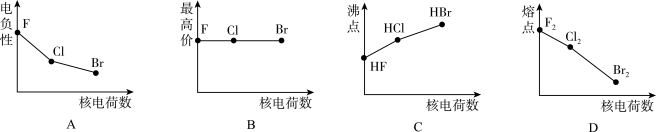
(2)溴化碘(IBr)的化学性质类似于卤素单质,溴化碘和水反应所得产物中有一种为三原子分子,该分子的电子式为___ 。
(3)F2与其他卤素单质反应可以生成ClF3、BrF3等。已知反应Cl2(g)+3F2(g)=2C1F3(g)△H=−313kJ/mol;F−F键的键能为159kJ/mol;Cl−C1键的键能为242kJ/mol;则ClF3中C1−F键的平均键能为___ kJ/mol。ClF3的熔、沸点比BrF3的___ (填“高”或“低”)。
(4)根据第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是___ 。
(5)(CN)2与Cl2的化学性质相似,(CN)2与NaOH溶液反应的化学方程式为___ 。
(6)上述反应涉及到的元素中,氯原子核外电子能量最高能级符号是___ ;H、Cl、N、O、Na的电负性从小到大的顺序为___ 。
(7)氯有多种含氧酸,其酸性:HClO4>HClO3>HClO2>HClO,从物质结构的角度解释以上含氧酸酸性依次减小的原因___ 。
(1)下面曲线(图1)表示卤族元素某种性质随核电荷数的变化趋势。正确的是

(2)溴化碘(IBr)的化学性质类似于卤素单质,溴化碘和水反应所得产物中有一种为三原子分子,该分子的电子式为
(3)F2与其他卤素单质反应可以生成ClF3、BrF3等。已知反应Cl2(g)+3F2(g)=2C1F3(g)△H=−313kJ/mol;F−F键的键能为159kJ/mol;Cl−C1键的键能为242kJ/mol;则ClF3中C1−F键的平均键能为
(4)根据第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(5)(CN)2与Cl2的化学性质相似,(CN)2与NaOH溶液反应的化学方程式为
(6)上述反应涉及到的元素中,氯原子核外电子能量最高能级符号是
(7)氯有多种含氧酸,其酸性:HClO4>HClO3>HClO2>HClO,从物质结构的角度解释以上含氧酸酸性依次减小的原因
您最近一年使用:0次
【推荐2】已知尿素的结构式为: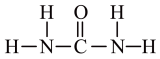 ,尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。
,尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。
(1)C、N、O三种元素的电负性由大到小顺序是__________ 。
(2) NH4+中H—N—H键角比NH3中H—N—H键角大,原因为______________________ 。
(3)美国科学家合成了结构呈“V”形的N5+,已知该离子中各原子均达到8电子稳定结构。则有关该离子的下列说法中正确的是_____ 。
A.每个N5+中含有35个质子和36个电子 B.该离子中有非极性键和配位键 C.该离子中含有2个π键 D.与PCl4+互为等电子体
(4)Fe(Ⅲ)除可与H2NCONH2形成配合物[Fe(H2NCONH2)6](NO3)3外,FeCl3溶液也可与KSCN溶液混合,得到含多种配合物的红色溶液,其中配位数为5的配合物的化学式是__________________ 。
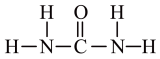 ,尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。
,尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。(1)C、N、O三种元素的电负性由大到小顺序是
(2) NH4+中H—N—H键角比NH3中H—N—H键角大,原因为
(3)美国科学家合成了结构呈“V”形的N5+,已知该离子中各原子均达到8电子稳定结构。则有关该离子的下列说法中正确的是
A.每个N5+中含有35个质子和36个电子 B.该离子中有非极性键和配位键 C.该离子中含有2个π键 D.与PCl4+互为等电子体
(4)Fe(Ⅲ)除可与H2NCONH2形成配合物[Fe(H2NCONH2)6](NO3)3外,FeCl3溶液也可与KSCN溶液混合,得到含多种配合物的红色溶液,其中配位数为5的配合物的化学式是
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐3】锡、铬、钴、铜等金属及其化合物在工业上有重要用途。
(1)锡合金具有优异的抗蚀性能,可以用来生产制作各种精美合金饰品。
①基态Sn原子价层电子排布为_______
②Co元素在元素周期表中的位置是_______
③Cu元素位于元素周期表的_______ 区
(2)制备CrO2Cl2的反应为K2Cr2O7 + 3CCl4 = 2KCl + 2CrO2Cl2 + 3COCl2↑
①上述方程式中非金属元素电负性由小到大的顺序为_______ (用元素符号表示)。
②COCl2分子中π键和σ键的个数比为_______ ,中心原子的杂化方式为_______ ,COCl2属于_______ 分子(填“极性”或“非极性”)。
(3)Cu−Mn−Al合金为磁性形状记忆合金材料之一,其晶胞结构如图所示:
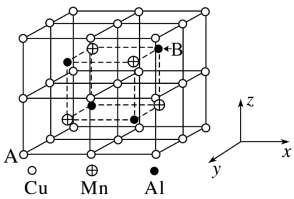
①合金的化学式为_______ 。
②A原子坐标参数为(0,1,0),则B原子坐标参数为_______ 。
③已知该合金晶体密度为ρg·cm-3,则两个Al原子间的最近距离为_______ nm (阿伏加德罗常数用NA表示,只列计算式)。
(1)锡合金具有优异的抗蚀性能,可以用来生产制作各种精美合金饰品。
①基态Sn原子价层电子排布为
②Co元素在元素周期表中的位置是
③Cu元素位于元素周期表的
(2)制备CrO2Cl2的反应为K2Cr2O7 + 3CCl4 = 2KCl + 2CrO2Cl2 + 3COCl2↑
①上述方程式中非金属元素电负性由小到大的顺序为
②COCl2分子中π键和σ键的个数比为
(3)Cu−Mn−Al合金为磁性形状记忆合金材料之一,其晶胞结构如图所示:

①合金的化学式为
②A原子坐标参数为(0,1,0),则B原子坐标参数为
③已知该合金晶体密度为ρg·cm-3,则两个Al原子间的最近距离为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
【推荐1】2023年诺贝尔化学奖授予蒙吉·G·巴文迪等三位科学家,以表彰他们在发现和合成量子点方面所作出的贡献,碳量子点是一类具有显著荧光性能的零维碳纳米材料,其结构如图所示。回答下列问题:_______ 区,图中C的杂化方式为_______ 。
(2)碳量子点结构包含的元素中电负性由大到小排列为:_______ 。
(3)碳量子点水溶性_______ (选填“>”“<”“=”)石墨水溶性,理由是:_______ 。
(4)高压合成金刚石的原料是廉价的石墨,用高压釜持续施加高温高压并加入金属镍等金属催化剂,石墨可转化为金刚石。基态镍原子核外电子的空间运动状态有_______ 种,比较二者C-C共价键的键长:石墨_______ 金刚石(选填“>”“<”“=”)。
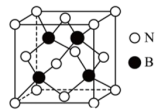
(5)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,其中一种结构为立方氮化硼(如图),类似于金刚石。_______ ,则立方氮化硼晶体密度为_______ g·cm-3(列出计算式,阿伏加德罗常数的值为NA)。

(2)碳量子点结构包含的元素中电负性由大到小排列为:
(3)碳量子点水溶性
(4)高压合成金刚石的原料是廉价的石墨,用高压釜持续施加高温高压并加入金属镍等金属催化剂,石墨可转化为金刚石。基态镍原子核外电子的空间运动状态有
(5)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,其中一种结构为立方氮化硼(如图),类似于金刚石。
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐2】硅电池、锂离子电池都是现代高性能电池的代表,高性能的电极材料与物质结构密切相关。
(1)LiFePO4因具有良好的结构稳定性而成为新一代正极材料,这与 的结构密切相关,
的结构密切相关, 的空间结构为
的空间结构为_______ 。P、O、S的电负性从大到小的顺序为_______ 。
(2)通常在电极材料表面进行“碳”包覆处理以增强其导电性。抗坏血酸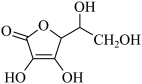 常被用作碳包覆的碳源,其易溶于水的原因是
常被用作碳包覆的碳源,其易溶于水的原因是_______ ,抗坏血酸中碳原子的杂化方式为_______ ,1 mol抗坏血酸中手性碳原子的数目为_______ 。
(3)目前最常用的电极材料有锂钴复合氧化物和石墨。
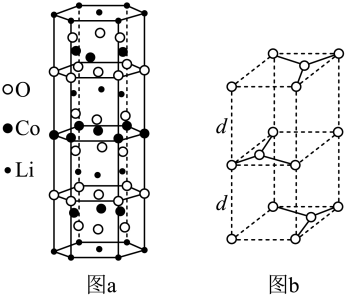
①锂钴复合氧化物中Li、Co、O分别形成了六边层状结构(图a),按照Li−O−Co−O−Li−O−Co−O−Li……顺序排列,则该化合物的化学式为_______ ,Co3+的价层电子排布式为_______ 。
②石墨晶胞(图b)层间距为d pm,C−C键长为a pm,石墨晶体的密度为ρ g·cm−3,列式表示阿伏加德罗常数为_______ mol−l。
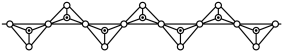
(4)硅酸盐中Si元素一般显+4价,如下图所示是一种无限长单键的多聚硅酸根离子的结构,其中“ ”表示Si原子,“o”表示氧原子,则该长链硅酸根离子的通式为
”表示Si原子,“o”表示氧原子,则该长链硅酸根离子的通式为_______ 。
(1)LiFePO4因具有良好的结构稳定性而成为新一代正极材料,这与
 的结构密切相关,
的结构密切相关, 的空间结构为
的空间结构为(2)通常在电极材料表面进行“碳”包覆处理以增强其导电性。抗坏血酸
 常被用作碳包覆的碳源,其易溶于水的原因是
常被用作碳包覆的碳源,其易溶于水的原因是(3)目前最常用的电极材料有锂钴复合氧化物和石墨。

①锂钴复合氧化物中Li、Co、O分别形成了六边层状结构(图a),按照Li−O−Co−O−Li−O−Co−O−Li……顺序排列,则该化合物的化学式为
②石墨晶胞(图b)层间距为d pm,C−C键长为a pm,石墨晶体的密度为ρ g·cm−3,列式表示阿伏加德罗常数为
(4)硅酸盐中Si元素一般显+4价,如下图所示是一种无限长单键的多聚硅酸根离子的结构,其中“
 ”表示Si原子,“o”表示氧原子,则该长链硅酸根离子的通式为
”表示Si原子,“o”表示氧原子,则该长链硅酸根离子的通式为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐3】2020年2月15日,由国家科研攻关组的主要成员单位的专家组共同研判磷酸氯喹在细胞水平上能
有效抑制新型冠状病毒(2019-nCoV)的感染。
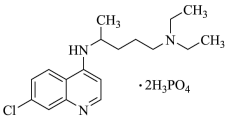
(1)已知磷酸氯喹的结构如图所示,则所含C、N、O三种元素第一电离能由大到小的顺序为_______________ 。P原子核外价层电子排布式为________ ,其核外电子有____ 个空间运动状态。
(2)磷酸氯喹中N原子的杂化方式为_________ ,NH3是一种极易溶于水的气体,其沸点比AsH3的沸点高,其原因是_______________________ 。
(3)H3PO4中PO43- 的空间构型为________________ 。
(4)磷化镓是一种由ⅢA族元素镓(Ga)与VA族元素磷(P)人工合成的Ⅲ—V族化合物半导体材料。晶胞结构可看作金刚石晶胞内部的碳原子被P原子代替,顶点和面心的碳原子被Ga原子代替。
①磷化镓晶体中含有的化学键类型为__________ (填选项字母)
A.离子键 B.配位键 C.σ键 D.π键 E.极性键 F.非极性键
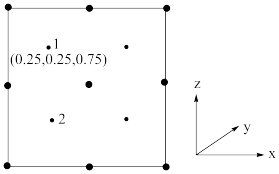
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。若沿y轴投影的晶胞中所有原子的分布图如图,则原子2的分数坐标为______________ 。
③若磷化镓的晶体密度为ρ g·cm-3,阿伏加 德罗常数的值为NA,则晶胞中Ga和P原子的最近距离为___________ pm。
有效抑制新型冠状病毒(2019-nCoV)的感染。

(1)已知磷酸氯喹的结构如图所示,则所含C、N、O三种元素第一电离能由大到小的顺序为
(2)磷酸氯喹中N原子的杂化方式为
(3)H3PO4中PO43- 的空间构型为
(4)磷化镓是一种由ⅢA族元素镓(Ga)与VA族元素磷(P)人工合成的Ⅲ—V族化合物半导体材料。晶胞结构可看作金刚石晶胞内部的碳原子被P原子代替,顶点和面心的碳原子被Ga原子代替。
①磷化镓晶体中含有的化学键类型为
A.离子键 B.配位键 C.σ键 D.π键 E.极性键 F.非极性键
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。若沿y轴投影的晶胞中所有原子的分布图如图,则原子2的分数坐标为

③若磷化镓的晶体密度为ρ g·cm-3,阿伏加 德罗常数的值为NA,则晶胞中Ga和P原子的最近距离为
您最近一年使用:0次



