1 . 四种元素基态原子的电子排布式如下:① ;②
;② ;③
;③ ;④
;④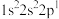 。下列有关比较中正确的是
。下列有关比较中正确的是
 ;②
;② ;③
;③ ;④
;④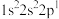 。下列有关比较中正确的是
。下列有关比较中正确的是| A.第一电离能:④>③>②>① | B.原子半径:④>③>①>② |
| C.电负性:③>④>①>② | D.最高正化合价:④=①>③=② |
您最近半年使用:0次
2024-01-24更新
|
138次组卷
|
7卷引用:天津市河北区2020-2021学年高二上学期期末检测化学试题
名校
解题方法
2 . 下列说法中正确的是
| A.电负性的大小可以作为判断元素非金属性强弱的依据 |
| B.金属导电的原因是在外加电场作用下金属产生自由电子,电子定向移动 |
| C.第四周期元素中,未成对电子数最多的元素位于钾元素后面第六位 |
| D.共价晶体中的各相邻原子不一定都以共价键相结合 |
您最近半年使用:0次
名校
解题方法
3 . 已知:元素的电负性和元素的化合价一样,也是元素的一种基本性质;两成键元素间电负性差值大于1.7时,通常形成离子键,两成键元素间电负性差值小于1.7时,通常形成共价键。下表给出了14种元素的电负性,则下列说法错误的是
| 元素 | Al | B | Be | C | Cl | F | Li |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 |
| 元素 | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
| A.随着原子序数递增,元素的电负性呈周期性变化 |
| B.元素电负性越大,其非金属性越强 |
| C.根据电负性数据可知Mg3N2中含有离子键 |
| D.BeCl2含金属元素铍,故属于离子化合物 |
您最近半年使用:0次
2023-07-29更新
|
96次组卷
|
6卷引用:江西省赣州市石城县石城中学2020-2021学年高一下学期3月月考化学试题
江西省赣州市石城县石城中学2020-2021学年高一下学期3月月考化学试题【全国百强校】重庆市第一中学2017-2018学年高一下学期期中考试化学试题(已下线)第38练 原子结构与元素的性质-2023年高考化学一轮复习小题多维练(全国通用)第一章 本章复习提升1云南省龙陵县第一中学2022-2023学年高二下学期期末考试化学试题陕西省西安交通大学附属中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
4 . a、b、c、d、e、f分别是H、C、N、Na、Si、Cu六种元素中的其中一种,已知:下图甲表示的是这六种元素单质的熔点高低顺序,其中c、d均是热和电的良导体,f形成的某种单质硬度最大。
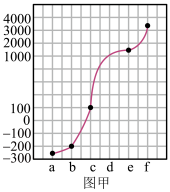
回答下列问题:
(1)a、b、f三种元素的电负性从小到大的顺序为___________ (用元素符号表示);
(2)元素b的单质的一个分子中含有___________ 个σ键和___________ 个π键;
(3)c单质分别与氟气和氯气形成化合物甲和乙,则甲的熔点___________ 乙的熔点(填>或<);
(4)元素d的基态原子的价电子排布式为___________ ;
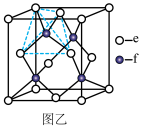
(5)元素e和f可形成化合物丙(丙的晶胞结构如图乙所示),则丙的化学式为___________ 丙的晶体类型为___________ ,在丙中,每个e原子周围最近的e原子数目为___________ 若晶胞参数为apm,则丙的密度表达式为___________ g・cm-3(用NA表示阿伏加德罗常数的值,丙的摩尔质量为Mg・mol-1)。

回答下列问题:
(1)a、b、f三种元素的电负性从小到大的顺序为
(2)元素b的单质的一个分子中含有
(3)c单质分别与氟气和氯气形成化合物甲和乙,则甲的熔点
(4)元素d的基态原子的价电子排布式为
(5)元素e和f可形成化合物丙(丙的晶胞结构如图乙所示),则丙的化学式为

您最近半年使用:0次
2021高三·全国·专题练习
解题方法
5 . 根据所学知识回答问题
(1)基态Ge原子的核外电子排布式为[Ar]___________ ,有___________ 个未成对电子。光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是___________ 。
(2)镍元素基态原子的电子排布式为___________ ,3d能级上的未成对电子数为___________ 。元素铜与镍的第二电离能分别为:ICu=1 958 kJ·mol-1、INi=1 753 kJ·mol-1,ICu>INi的原因是___________ 。
(3)写出基态As原子的核外电子排布式___________ 。根据元素周期律,原子半径Ga___________ As,第一电离能Ga___________ As(填“大于”或“小于”)。
(1)基态Ge原子的核外电子排布式为[Ar]
(2)镍元素基态原子的电子排布式为
(3)写出基态As原子的核外电子排布式
您最近半年使用:0次
解题方法
6 . 一个外围电子构型为2s22p5的元素,下列有关它的描述不正确的是
| A.原子序数为9 | B.电负性是所有元素中最大的 |
| C.原子半径是同周期元素中最小的 | D.第一电离能是所有元素中最大的 |
您最近半年使用:0次
7 . 回答下列问题
(1)铁元素在元素周期表中的位置为___________ ,其形成的离子常见的有 和
和 ,基态
,基态 的价电子的排布式为
的价电子的排布式为___________ ,相同条件下, 比
比 稳定,原因是
稳定,原因是___________ 。
(2)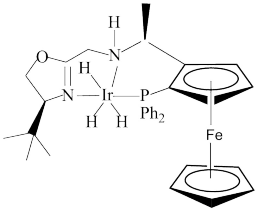 一种二茂铁为骨架的新型手性膦氮配合物结构示意图(见上),其中
一种二茂铁为骨架的新型手性膦氮配合物结构示意图(见上),其中 为苯基,
为苯基, 为铱元素。该结构中电负性最大的元素为
为铱元素。该结构中电负性最大的元素为___________ (填元素符号,下同),分子中第二周期元素的第一电离能由大到小的顺序为___________ ,分子中不含有的化学键类型是___________ (填标号)。
A.离子键B.配位键C.极性共价键D.非极性共价键E. 键、
键、 键
键
(3) 与
与 位于同一周期且最外层电子构型相同,铁的熔点和沸点均比钙的高,其原因是
位于同一周期且最外层电子构型相同,铁的熔点和沸点均比钙的高,其原因是___________
(1)铁元素在元素周期表中的位置为
 和
和 ,基态
,基态 的价电子的排布式为
的价电子的排布式为 比
比 稳定,原因是
稳定,原因是(2)
 一种二茂铁为骨架的新型手性膦氮配合物结构示意图(见上),其中
一种二茂铁为骨架的新型手性膦氮配合物结构示意图(见上),其中 为苯基,
为苯基, 为铱元素。该结构中电负性最大的元素为
为铱元素。该结构中电负性最大的元素为A.离子键B.配位键C.极性共价键D.非极性共价键E.
 键、
键、 键
键(3)
 与
与 位于同一周期且最外层电子构型相同,铁的熔点和沸点均比钙的高,其原因是
位于同一周期且最外层电子构型相同,铁的熔点和沸点均比钙的高,其原因是
您最近半年使用:0次
8 . 具有下列选项中电负性数值的两种元素的原子,最容易形成离子键的是
| A.4.0和1.0 | B.3.5和1.0 | C.1.8和2.5 | D.4.0和0.8 |
您最近半年使用:0次
解题方法
9 . 下列元素中,电负性最大的是
A. | B.O | C.S | D. |
您最近半年使用:0次
解题方法
10 . 利用电负性的相关知识,回答下列问题。
(1) 和
和 所含的三种元素电负性从大到小的顺序为
所含的三种元素电负性从大到小的顺序为_______ 。
(2) 中共用电子对偏向C,
中共用电子对偏向C, 中共用电子对偏向H,则C、
中共用电子对偏向H,则C、 、H的电负性由大到小的顺序为
、H的电负性由大到小的顺序为_______ 。
(3)溴与氯能以_______ 键结合形成 。
。 分子中
分子中 化合价为
化合价为_______ 。写出 与水发生反应的化学方程式:
与水发生反应的化学方程式:_______ 。
(1)
 和
和 所含的三种元素电负性从大到小的顺序为
所含的三种元素电负性从大到小的顺序为(2)
 中共用电子对偏向C,
中共用电子对偏向C, 中共用电子对偏向H,则C、
中共用电子对偏向H,则C、 、H的电负性由大到小的顺序为
、H的电负性由大到小的顺序为(3)溴与氯能以
 。
。 分子中
分子中 化合价为
化合价为 与水发生反应的化学方程式:
与水发生反应的化学方程式:
您最近半年使用:0次



