名校
解题方法
1 . 请回答下列有关问题。
(1)Fe元素按周期表分区属于___________ 区元素
(2)地壳中含量最多的三种元素O、Si、Al中,电负性最大的是___________ 。
(3)钠在火焰上灼烧产生的黄光是一种___________ (填字母)
A.吸收光谱 B.发射光谱
(4)Cu的基态原子的电子排布式是___________ 。
(5)钛被称为继铁、铝之后的第三金属,基态钛原子价电子层的电子排布图是___________ 。
(6)基态Fe3+与Fe2+离子中未成对的电子数之比为___________
(7)COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为________ 。
(8)H2O分子的空间构型为___________
(1)Fe元素按周期表分区属于
(2)地壳中含量最多的三种元素O、Si、Al中,电负性最大的是
(3)钠在火焰上灼烧产生的黄光是一种
A.吸收光谱 B.发射光谱
(4)Cu的基态原子的电子排布式是
(5)钛被称为继铁、铝之后的第三金属,基态钛原子价电子层的电子排布图是
(6)基态Fe3+与Fe2+离子中未成对的电子数之比为
(7)COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为
(8)H2O分子的空间构型为
您最近一年使用:0次
名校
解题方法
2 . 下列说法正确的是
| A.Na、Mg、Al 的第一电离能逐渐增大 |
| B.F的第一电离能最大 |
| C.S2-、Cl—、K+的半径依次减小 |
| D.F、O 、N 的电负性逐渐增大 |
您最近一年使用:0次
名校
解题方法
3 . 已知X、Y为同周期非金属元素,且电负性Y>X,下列说法正确的是
| A.化学键的极性:H—Y大于H—X |
| B.第一电离能Y一定大于X |
| C.含氧酸的酸性:Y对应的酸的酸性强于X对应的酸的酸性 |
| D.X和Y形成化合物时,X显负价,Y显正价 |
您最近一年使用:0次
名校
4 . Ⅰ.已知元素M是组成物质 NH4Al(SO4)2的其中一种元素。元素M的气态原子逐个失去第1个至第4个电子所需能量(即电离能,用符号I1至I4表示)如表所示:
(1)元素M是_______ (填元素符号)。
(2)NH4Al(SO4)2中,电负性最大的元素是_______ (填元素符号),S的_______ 杂化轨道与O的2p轨道形成_______ 键。
Ⅱ.如图所示为高温超导领域里的一种化合物-钙钛矿晶体结构,该结构是具有代表性的最小重复单位。
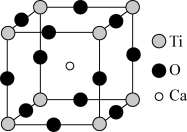
(3)在该物质的晶体结构中,每个钛离子周围与它最接近且距离相等的氧离子、钙离子各有_______ 个、_______ 个。
(4)该晶体结构中,氧、钛、钙的离子个数比是_______
(5)若钙、钛、氧三种元素的相对质量分别为a、b、c,晶体结构图中正方体边长(钛离子之间的距离)为d nm(1 nm=10-9 m),则该晶体的密度为_______ g/cm3。
| I1 | I2 | I3 | I4 | |
| 电离能(kJ·mol-1) | 578 | 1817 | 2745 | 11578 |
(2)NH4Al(SO4)2中,电负性最大的元素是
Ⅱ.如图所示为高温超导领域里的一种化合物-钙钛矿晶体结构,该结构是具有代表性的最小重复单位。

(3)在该物质的晶体结构中,每个钛离子周围与它最接近且距离相等的氧离子、钙离子各有
(4)该晶体结构中,氧、钛、钙的离子个数比是
(5)若钙、钛、氧三种元素的相对质量分别为a、b、c,晶体结构图中正方体边长(钛离子之间的距离)为d nm(1 nm=10-9 m),则该晶体的密度为
您最近一年使用:0次
名校
5 . 下列说法中错误的是
| A.根据对角线规则,B和Si的性质具有相似性 |
| B.元素电负性越大的原子,吸引电子的能力越强 |
| C.气体单质分子中,一定没有π键 |
| D.金属焰色反应原理是发生了电子跃迁 |
您最近一年使用:0次
2022-01-08更新
|
301次组卷
|
4卷引用:四川省达州市2020-2021学年高二上学期期末检测化学试题
名校
解题方法
6 . 由于铁氮化合物具有非常优异的磁性能、机械性能和耐腐蚀性,受到研究人员的广泛关注。γˊ−Fe4N是一种性能优异的铁氮化合物,其可由氨气与羰基铁粉[Fe(CO)5]反应得到。
(1)Fe变为Fe2+时是失去___________ 轨道电子,Fe3+价层电子排布图为___________ 。
(2)氨气中N的杂化类型是___________ ,NH3中H−N−H的键角比NH4+中H−N−H的键角___________ (填“大”或“小”),理由是___________ 。
(3) 与CO中均存在化学键的类型有
与CO中均存在化学键的类型有___________ (填标号)。
A.离子键 B.氢键 C.配位键 D.共价键 E.金属键
(4)羰基铁粉[Fe(CO)5]中铁元素的配位数是___________ ,配位原子为___________ 。
(5)氨气与羰基铁粉的反应中涉及元素电负性由大到小的顺序为___________ 。
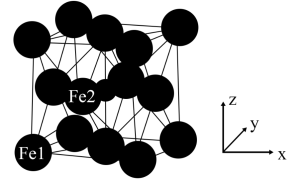
(6)γ−Fe4N的晶胞如图所示,设晶胞中Fe1点的原子坐标为(0,0,0),N点的原子坐标为( ,
, ,
, ),则Fe2点的原子坐标为
),则Fe2点的原子坐标为___________ 。已知该晶体的密度为dg/cm3,阿伏加德罗常数的值为NA,则晶胞参数a为___________ nm(用含d和NA的代数式表示)。
(1)Fe变为Fe2+时是失去
(2)氨气中N的杂化类型是
(3)
 与CO中均存在化学键的类型有
与CO中均存在化学键的类型有A.离子键 B.氢键 C.配位键 D.共价键 E.金属键
(4)羰基铁粉[Fe(CO)5]中铁元素的配位数是
(5)氨气与羰基铁粉的反应中涉及元素电负性由大到小的顺序为
(6)γ−Fe4N的晶胞如图所示,设晶胞中Fe1点的原子坐标为(0,0,0),N点的原子坐标为(
 ,
, ,
, ),则Fe2点的原子坐标为
),则Fe2点的原子坐标为
您最近一年使用:0次
2021-12-31更新
|
288次组卷
|
5卷引用:石家庄示范性高中2022届高三上学期调研考试化学试题
解题方法
7 . 高压发电系统常用 作为绝缘气体,该气体分子呈正八面体结构,如图所示。下列有关
作为绝缘气体,该气体分子呈正八面体结构,如图所示。下列有关 的说法错误的是
的说法错误的是

 作为绝缘气体,该气体分子呈正八面体结构,如图所示。下列有关
作为绝缘气体,该气体分子呈正八面体结构,如图所示。下列有关 的说法错误的是
的说法错误的是
| A.是非极性分子 |
| B.键角∠FSF都等于90° |
| C.S与F之间共用电子对偏向F |
D.基态硫原子的价电子排布式为 |
您最近一年使用:0次
21-22高二·全国·课时练习
8 . 某有机化合物结构如下,分析其结构并回答下列问题。

(1)写出其分子式___________ 。
(2)其中含有___________ 个不饱和碳原子,分子中有___________ 种双键。
(3)分子中的极性键有___________ (写出两种即可)。
(4)分子中的饱和碳原子有___________ 个。
(5)分子中所含元素的电负性数值由大到小的顺序是___________ 。

(1)写出其分子式
(2)其中含有
(3)分子中的极性键有
(4)分子中的饱和碳原子有
(5)分子中所含元素的电负性数值由大到小的顺序是
您最近一年使用:0次
21-22高二·全国·课时练习
9 . a、b、c、d是四种短周期元素,a、b、d同周期,c、d同主族。a的原子结构示意图为 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为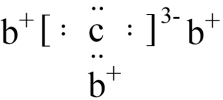 。下列比较中正确的是
。下列比较中正确的是
 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为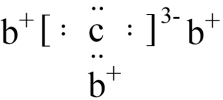 。下列比较中正确的是
。下列比较中正确的是| A.原子半径:a>c>d>b |
| B.电负性:a>b>d>c |
| C.原子序数:a>d>b>c |
| D.最高价含氧酸的酸性:c>d>a |
您最近一年使用:0次
2021高三·全国·专题练习
解题方法
10 . H2SeO4比H2SeO3酸性强的原因:___ 。
您最近一年使用:0次



