1 . Ⅰ.(1)下列晶体中,属于离子晶体的是_______ 。
A. B.
B.  C.
C.  D.
D. 
(2)下列关于元素电负性大小的比较中,正确的是_______ 。
A.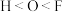 B.
B.  C.
C. 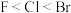 D.
D. 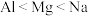
(3)下列能级中轨道数为5的是_______ 。
A. 能级 B.
能级 B.  能级 C.
能级 C.  能级 D.
能级 D.  能级
能级
(4)用短线“—”表示共用电子对,用“··”表示未成键孤电子对的式子叫路易斯结构式。 分子的路易斯结构式可以表示为
分子的路易斯结构式可以表示为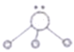 ,以下叙述正确的是
,以下叙述正确的是_______ 。
A. 可以是
可以是 B.
B.  分子的立体构型为三角锥形
分子的立体构型为三角锥形
C. 是非极性分子 D. 键角大于
是非极性分子 D. 键角大于
(5)下列有关 键、π键说法中
键、π键说法中不正确 的是_______ 。
A. 分子中有2个
分子中有2个 键,2个π键
键,2个π键
B. 气体单质中,一定有 键,可能有π键
键,可能有π键
C. 键比π键重叠程度大,形成的共价键较强
键比π键重叠程度大,形成的共价键较强
D. 两个原子之间形成共价键时,最多有一个 键
键
Ⅱ. 第四周期中的18种元素具有重要的用途。
(1)基态 原子的价层电子排布式为
原子的价层电子排布式为_______ , 成为阳离子时首先失去
成为阳离子时首先失去_______ 轨道电子。
(2)金属 在材料科学上也有重要作用,它易形成配合物,如:
在材料科学上也有重要作用,它易形成配合物,如: 、
、 等。写出一种与配体
等。写出一种与配体 互为等电子体的阴离子
互为等电子体的阴离子_______ 。
(3)已知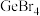 是电子工业中的一种常用试剂,其熔点为
是电子工业中的一种常用试剂,其熔点为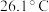 ,沸点为
,沸点为 ,则
,则 晶体类型为
晶体类型为_______ ,中心原子的杂化类型为_______ 。
(4)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,但 的第一电离能却明显低于
的第一电离能却明显低于 ,原因是
,原因是_______ 。
(5) 和
和 形成的一种晶体晶胞,原子堆积方式如图所示。图中六棱柱体积为
形成的一种晶体晶胞,原子堆积方式如图所示。图中六棱柱体积为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该晶体的密度
,则该晶体的密度
_______  。
。
A.
 B.
B.  C.
C.  D.
D. 
(2)下列关于元素电负性大小的比较中,正确的是
A.
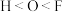 B.
B.  C.
C. 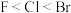 D.
D. 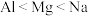
(3)下列能级中轨道数为5的是
A.
 能级 B.
能级 B.  能级 C.
能级 C.  能级 D.
能级 D.  能级
能级(4)用短线“—”表示共用电子对,用“··”表示未成键孤电子对的式子叫路易斯结构式。
 分子的路易斯结构式可以表示为
分子的路易斯结构式可以表示为 ,以下叙述正确的是
,以下叙述正确的是A.
 可以是
可以是 B.
B.  分子的立体构型为三角锥形
分子的立体构型为三角锥形C.
 是非极性分子 D. 键角大于
是非极性分子 D. 键角大于
(5)下列有关
 键、π键说法中
键、π键说法中A.
 分子中有2个
分子中有2个 键,2个π键
键,2个π键B. 气体单质中,一定有
 键,可能有π键
键,可能有π键C.
 键比π键重叠程度大,形成的共价键较强
键比π键重叠程度大,形成的共价键较强D. 两个原子之间形成共价键时,最多有一个
 键
键Ⅱ. 第四周期中的18种元素具有重要的用途。
(1)基态
 原子的价层电子排布式为
原子的价层电子排布式为 成为阳离子时首先失去
成为阳离子时首先失去(2)金属
 在材料科学上也有重要作用,它易形成配合物,如:
在材料科学上也有重要作用,它易形成配合物,如: 、
、 等。写出一种与配体
等。写出一种与配体 互为等电子体的阴离子
互为等电子体的阴离子(3)已知
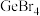 是电子工业中的一种常用试剂,其熔点为
是电子工业中的一种常用试剂,其熔点为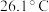 ,沸点为
,沸点为 ,则
,则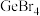 晶体类型为
晶体类型为(4)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,但
 的第一电离能却明显低于
的第一电离能却明显低于 ,原因是
,原因是(5)
 和
和 形成的一种晶体晶胞,原子堆积方式如图所示。图中六棱柱体积为
形成的一种晶体晶胞,原子堆积方式如图所示。图中六棱柱体积为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该晶体的密度
,则该晶体的密度
 。
。
您最近一年使用:0次
2021高三·全国·专题练习
2 . 回答下列问题
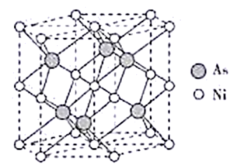
(1)Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性小的元素是___________ ;26号元素价层电子排布式为___________ ;L原子核外电子占有9个轨道,而且有一个未成对电子,L是___________ 元素。
(2)硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物。
①基态硒原子的价层电子排布式为___________ 。
②锗、砷、硒三种元素的第一电离能大小排序为___________ 。
(3)①Cu元素基态原子的价层电子排布式为___________ 。
②下列说法正确的是___________ (填字母)。
A.第一电离能:As>Ga
B.电负性:As>Ga
C.原子半径:As>Ga
③锗(Ge)是用途很广的半导体材料,基态锗原子的价层电子排布式为___________ 。在第二周期中,第一电离能位于硼元素与氮元素之间的元素有___________ 种。
④硼(B)及其化合物在化学中有重要的地位。Ga与B同主族,Ga的基态原子的核外电子排布式为___________ ,B、C、O三种元素的第一电离能由大到小的顺序是___________ 。
(4)已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X与Y可形成化合物X2Y3,Z元素可以形成负一价离子。
①X元素基态原子的电子排布式为___________ ,该元素的化学符号是___________ 。
②Y元素原子的价层电子排布图为___________ ,该元素的名称是___________ 。
③已知化合物X2Y3在稀硫酸中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是___________ 。
(1)Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性小的元素是
(2)硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物。
①基态硒原子的价层电子排布式为
②锗、砷、硒三种元素的第一电离能大小排序为
(3)①Cu元素基态原子的价层电子排布式为
②下列说法正确的是
A.第一电离能:As>Ga
B.电负性:As>Ga
C.原子半径:As>Ga
③锗(Ge)是用途很广的半导体材料,基态锗原子的价层电子排布式为
④硼(B)及其化合物在化学中有重要的地位。Ga与B同主族,Ga的基态原子的核外电子排布式为
(4)已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X与Y可形成化合物X2Y3,Z元素可以形成负一价离子。
①X元素基态原子的电子排布式为
②Y元素原子的价层电子排布图为
③已知化合物X2Y3在稀硫酸中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是
您最近一年使用:0次
解题方法
3 . 铁及其化合物在国民生产、生活中用途广泛。
(1)向FeCl3溶液加入少量的KSCN溶液,生成红色的[Fe(SCN)(H2O)5]2+。N、C、H元素的第一电离能由大到小的顺序为___________ ,O、N、C、H四种元素电负性最大的是___________ (填元素符号) 。
(2)FeCl3 与K4[Fe(CN)6]溶液混合生成Fe4[Fe(CN)6]3沉淀。配体CN-中C原子的杂化方式为___________ ,CH2=CHCH2CN分子中σ键与π键的数目比n(σ)∶n(π)=___________ 。
(3)用邻二氮菲(phen,如图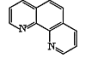 )与琥珀酸亚铁生成稳定的橙色配合物,可测定Fe2+的浓度,发生反应:Fe2++3phen=[Fe(phen)3]2+。
)与琥珀酸亚铁生成稳定的橙色配合物,可测定Fe2+的浓度,发生反应:Fe2++3phen=[Fe(phen)3]2+。
①[Fe(phen)3]2+中,存在的化学键有___________ (填序号)。
a.配位键 b.离子键 c.π键 d.氢键
②用邻二氮菲测定Fe2+浓度时应控制pH为2~9的适宜范围,请解释原因___________ 。
(4)铁合金用途广泛,某种铁镁合金储氢效率很高,其晶胞如图所示。
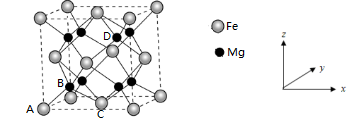
晶体中每个铁原子周围距离最近的镁原子有___________ 个,原子坐标参数可以表示晶胞内部各原子的相对位置,其中原子坐标参数A为(0,0,0),B为( ),C为(
),C为(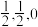 ),则D点坐标参数为
),则D点坐标参数为___________ 。
(1)向FeCl3溶液加入少量的KSCN溶液,生成红色的[Fe(SCN)(H2O)5]2+。N、C、H元素的第一电离能由大到小的顺序为
(2)FeCl3 与K4[Fe(CN)6]溶液混合生成Fe4[Fe(CN)6]3沉淀。配体CN-中C原子的杂化方式为
(3)用邻二氮菲(phen,如图
 )与琥珀酸亚铁生成稳定的橙色配合物,可测定Fe2+的浓度,发生反应:Fe2++3phen=[Fe(phen)3]2+。
)与琥珀酸亚铁生成稳定的橙色配合物,可测定Fe2+的浓度,发生反应:Fe2++3phen=[Fe(phen)3]2+。①[Fe(phen)3]2+中,存在的化学键有
a.配位键 b.离子键 c.π键 d.氢键
②用邻二氮菲测定Fe2+浓度时应控制pH为2~9的适宜范围,请解释原因
(4)铁合金用途广泛,某种铁镁合金储氢效率很高,其晶胞如图所示。

晶体中每个铁原子周围距离最近的镁原子有
 ),C为(
),C为(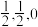 ),则D点坐标参数为
),则D点坐标参数为
您最近一年使用:0次
2021-01-29更新
|
299次组卷
|
2卷引用:山东省烟台市2020-2021学年高二上学期期末考试化学试题



