1 . 电池有铅蓄电池、燃料电池(如NO2NH3电池)、锂离子电池、Mg—次氯酸盐电池等,它们可以将化学能转化为电能。NH3、CH4、NaBH4都可用作燃料电池的燃料。CH4的燃烧热为890.3kJ•mol-1。电解则可以将电能转化为化学能,电解饱和NaCl溶液可以得到Cl2,用电解法可制备消毒剂高铁酸钠(Na2FeO4)。下列物质结构与性质或物质性质与用途不具有对应关系的是
| A.H的电负性比B的大,NaBH4中H显负电性 |
| B.Li的原子半径比Na的小,金属锂的熔点比钠的高 |
| C.NO2具有强氧化性,可作为火箭发射的助燃剂 |
| D.CH4的热稳定性较强,可用作燃料电池的燃料 |
您最近半年使用:0次
名校
2 . 钛能与卤素单质发生反应,生成用途多样的卤化钛。
(1)卤族元素(F、Cl、Br、I)随着原子序数的递增,相关性质逐渐增强或变大的是___________。
(2) 易与
易与 结合,下列关于
结合,下列关于 分子说法错误的是___________。
分子说法错误的是___________。
(1)卤族元素(F、Cl、Br、I)随着原子序数的递增,相关性质逐渐增强或变大的是___________。
| A.元素的电负性 | B.简单离子的还原性 |
| C.气态氢化物的热稳定性 | D.最高价氧化物对应水化物的酸性 |
 易与
易与 结合,下列关于
结合,下列关于 分子说法错误的是___________。
分子说法错误的是___________。A.键角为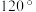 | B.是极性分子 |
C.含有 键 键 | D.中心原子采取 杂化 杂化 |
您最近半年使用:0次
3 . 第四周期的元素形成的化合物在生产生活中有着重要的用途。
(1)镍铬钢抗腐蚀性能强,基态铬原子的价电子排布式为___________ ,按照电子排布式,镍元素在周期表中位于___________ 区。
(2)“玉兔二号”月球车通过砷化镓(GaAs)太阳能电池提供能量进行工作。基态砷原子的电子占据最高能级的电子云轮廓图为___________ 形。砷的电负性比镓___________ (填“大”或“小”)。
(3)基态Fe3+、Fe2+离子中未成对的电子数之比为___________ 。
(1)镍铬钢抗腐蚀性能强,基态铬原子的价电子排布式为
(2)“玉兔二号”月球车通过砷化镓(GaAs)太阳能电池提供能量进行工作。基态砷原子的电子占据最高能级的电子云轮廓图为
(3)基态Fe3+、Fe2+离子中未成对的电子数之比为
您最近半年使用:0次
2023-11-01更新
|
139次组卷
|
2卷引用:上海市育才中学2023-2024学年高三上学期10月第一次质量调研(等级考)化学试题
解题方法
4 . 铁及其化合物在国民生产、生活中用途广泛。
(1)向 溶液中加入少量的
溶液中加入少量的 溶液,生成红色的
溶液,生成红色的 。N、C、H元素的第一电离能由大到小的顺序为
。N、C、H元素的第一电离能由大到小的顺序为____ ,O、N、C、H四种元素电负性最大的是____ (填元素符号)。
(2) 与
与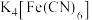 溶液混合生成
溶液混合生成 沉淀。配体
沉淀。配体 中C原子的杂化方式为
中C原子的杂化方式为_______ ,CH2=CHCH2CN分子中σ键与π键的数目之比为_______ 。
(3)用邻二氮菲(phen,结构为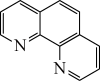 )与琥珀酸亚铁生成稳定的橙色配合物,可测定
)与琥珀酸亚铁生成稳定的橙色配合物,可测定 的浓度,发生反应:
的浓度,发生反应: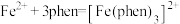 。
。
① 中,存在的化学键有
中,存在的化学键有_______ (填字母)。
a.配位键 b.离子键 c.π键 d.氢键
②用邻二氮菲测定 浓度时应控制pH为2~9的适宜范围,请解释原因:
浓度时应控制pH为2~9的适宜范围,请解释原因:_______ 。
(1)向
 溶液中加入少量的
溶液中加入少量的 溶液,生成红色的
溶液,生成红色的 。N、C、H元素的第一电离能由大到小的顺序为
。N、C、H元素的第一电离能由大到小的顺序为(2)
 与
与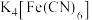 溶液混合生成
溶液混合生成 沉淀。配体
沉淀。配体 中C原子的杂化方式为
中C原子的杂化方式为(3)用邻二氮菲(phen,结构为
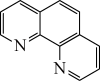 )与琥珀酸亚铁生成稳定的橙色配合物,可测定
)与琥珀酸亚铁生成稳定的橙色配合物,可测定 的浓度,发生反应:
的浓度,发生反应: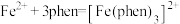 。
。①
 中,存在的化学键有
中,存在的化学键有a.配位键 b.离子键 c.π键 d.氢键
②用邻二氮菲测定
 浓度时应控制pH为2~9的适宜范围,请解释原因:
浓度时应控制pH为2~9的适宜范围,请解释原因:
您最近半年使用:0次
名校
解题方法
5 . 含硫矿物如黄铁矿(FeS2)、黄铜矿、芒硝在工业上有着重要的用途。收集黄铜矿炼铜过程中产生的SO2制备SO3,其反应为2SO2(g)+O2(g)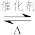 2SO3(g) ΔH= -197
2SO3(g) ΔH= -197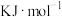 。下列有关说法正确的是
。下列有关说法正确的是
 2SO3(g) ΔH= -197
2SO3(g) ΔH= -197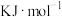 。下列有关说法正确的是
。下列有关说法正确的是| A.SO2溶于水所得溶液能导电,所以SO2是电解质 |
B. 的空间构型为平面三角形 的空间构型为平面三角形 |
| C.电负性:O<S |
| D.如果反应制得2molSO3,则转移的电子数目为4NA |
您最近半年使用:0次
名校
解题方法
6 . 锡、铬、钴、铜等金属及其化合物在工业上有重要用途。
(1)锡合金具有优异的抗蚀性能,可以用来生产制作各种精美合金饰品。
①基态Sn原子价层电子排布为_______
②Co元素在元素周期表中的位置是_______
③Cu元素位于元素周期表的_______ 区
(2)制备CrO2Cl2的反应为K2Cr2O7 + 3CCl4 = 2KCl + 2CrO2Cl2 + 3COCl2↑
①上述方程式中非金属元素电负性由小到大的顺序为_______ (用元素符号表示)。
②COCl2分子中π键和σ键的个数比为_______ ,中心原子的杂化方式为_______ ,COCl2属于_______ 分子(填“极性”或“非极性”)。
(3)Cu−Mn−Al合金为磁性形状记忆合金材料之一,其晶胞结构如图所示:
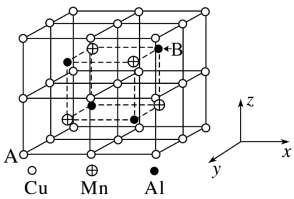
①合金的化学式为_______ 。
②A原子坐标参数为(0,1,0),则B原子坐标参数为_______ 。
③已知该合金晶体密度为ρg·cm-3,则两个Al原子间的最近距离为_______ nm (阿伏加德罗常数用NA表示,只列计算式)。
(1)锡合金具有优异的抗蚀性能,可以用来生产制作各种精美合金饰品。
①基态Sn原子价层电子排布为
②Co元素在元素周期表中的位置是
③Cu元素位于元素周期表的
(2)制备CrO2Cl2的反应为K2Cr2O7 + 3CCl4 = 2KCl + 2CrO2Cl2 + 3COCl2↑
①上述方程式中非金属元素电负性由小到大的顺序为
②COCl2分子中π键和σ键的个数比为
(3)Cu−Mn−Al合金为磁性形状记忆合金材料之一,其晶胞结构如图所示:

①合金的化学式为
②A原子坐标参数为(0,1,0),则B原子坐标参数为
③已知该合金晶体密度为ρg·cm-3,则两个Al原子间的最近距离为
您最近半年使用:0次
2022-05-16更新
|
131次组卷
|
2卷引用:甘肃省兰州第一中学2021-2022学年高二下学期期中考试化学试题
7 . Ⅰ.(1)下列晶体中,属于离子晶体的是_______ 。
A. B.
B.  C.
C.  D.
D. 
(2)下列关于元素电负性大小的比较中,正确的是_______ 。
A.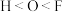 B.
B.  C.
C. 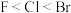 D.
D. 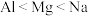
(3)下列能级中轨道数为5的是_______ 。
A. 能级 B.
能级 B.  能级 C.
能级 C.  能级 D.
能级 D.  能级
能级
(4)用短线“—”表示共用电子对,用“··”表示未成键孤电子对的式子叫路易斯结构式。 分子的路易斯结构式可以表示为
分子的路易斯结构式可以表示为 ,以下叙述正确的是
,以下叙述正确的是_______ 。
A. 可以是
可以是 B.
B.  分子的立体构型为三角锥形
分子的立体构型为三角锥形
C. 是非极性分子 D. 键角大于
是非极性分子 D. 键角大于
(5)下列有关 键、π键说法中
键、π键说法中不正确 的是_______ 。
A. 分子中有2个
分子中有2个 键,2个π键
键,2个π键
B. 气体单质中,一定有 键,可能有π键
键,可能有π键
C. 键比π键重叠程度大,形成的共价键较强
键比π键重叠程度大,形成的共价键较强
D. 两个原子之间形成共价键时,最多有一个 键
键
Ⅱ. 第四周期中的18种元素具有重要的用途。
(1)基态 原子的价层电子排布式为
原子的价层电子排布式为_______ , 成为阳离子时首先失去
成为阳离子时首先失去_______ 轨道电子。
(2)金属 在材料科学上也有重要作用,它易形成配合物,如:
在材料科学上也有重要作用,它易形成配合物,如: 、
、 等。写出一种与配体
等。写出一种与配体 互为等电子体的阴离子
互为等电子体的阴离子_______ 。
(3)已知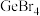 是电子工业中的一种常用试剂,其熔点为
是电子工业中的一种常用试剂,其熔点为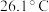 ,沸点为
,沸点为 ,则
,则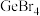 晶体类型为
晶体类型为_______ ,中心原子的杂化类型为_______ 。
(4)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,但 的第一电离能却明显低于
的第一电离能却明显低于 ,原因是
,原因是_______ 。
(5) 和
和 形成的一种晶体晶胞,原子堆积方式如图所示。图中六棱柱体积为
形成的一种晶体晶胞,原子堆积方式如图所示。图中六棱柱体积为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该晶体的密度
,则该晶体的密度
_______  。
。
A.
 B.
B.  C.
C.  D.
D. 
(2)下列关于元素电负性大小的比较中,正确的是
A.
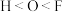 B.
B.  C.
C. 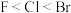 D.
D. 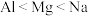
(3)下列能级中轨道数为5的是
A.
 能级 B.
能级 B.  能级 C.
能级 C.  能级 D.
能级 D.  能级
能级(4)用短线“—”表示共用电子对,用“··”表示未成键孤电子对的式子叫路易斯结构式。
 分子的路易斯结构式可以表示为
分子的路易斯结构式可以表示为 ,以下叙述正确的是
,以下叙述正确的是A.
 可以是
可以是 B.
B.  分子的立体构型为三角锥形
分子的立体构型为三角锥形C.
 是非极性分子 D. 键角大于
是非极性分子 D. 键角大于
(5)下列有关
 键、π键说法中
键、π键说法中A.
 分子中有2个
分子中有2个 键,2个π键
键,2个π键B. 气体单质中,一定有
 键,可能有π键
键,可能有π键C.
 键比π键重叠程度大,形成的共价键较强
键比π键重叠程度大,形成的共价键较强D. 两个原子之间形成共价键时,最多有一个
 键
键Ⅱ. 第四周期中的18种元素具有重要的用途。
(1)基态
 原子的价层电子排布式为
原子的价层电子排布式为 成为阳离子时首先失去
成为阳离子时首先失去(2)金属
 在材料科学上也有重要作用,它易形成配合物,如:
在材料科学上也有重要作用,它易形成配合物,如: 、
、 等。写出一种与配体
等。写出一种与配体 互为等电子体的阴离子
互为等电子体的阴离子(3)已知
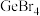 是电子工业中的一种常用试剂,其熔点为
是电子工业中的一种常用试剂,其熔点为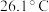 ,沸点为
,沸点为 ,则
,则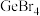 晶体类型为
晶体类型为(4)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,但
 的第一电离能却明显低于
的第一电离能却明显低于 ,原因是
,原因是(5)
 和
和 形成的一种晶体晶胞,原子堆积方式如图所示。图中六棱柱体积为
形成的一种晶体晶胞,原子堆积方式如图所示。图中六棱柱体积为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该晶体的密度
,则该晶体的密度
 。
。
您最近半年使用:0次
解题方法
8 . 许多元素及它们的化合物在科学研究和工业生产中具有许多用途,请回答下列有关问题:
(1)某同学画出基态碳原子的核外电子排布图: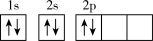 ,该电子排布图违背了
,该电子排布图违背了_______ ;CH 、-CH3、CH
、-CH3、CH 都是重要的有机反应中间体,CH
都是重要的有机反应中间体,CH 的VSEPR模型为
的VSEPR模型为_______ 。
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为___________ 。
(3)基态溴原子的价层电子排布图为________ ,用价层电子对互斥理论推断SnBr2分子中Sn—Br的键角___________ 120°(填“>”、“<”或“=”)。
(4)CN-能与多种金属离子形成配合物,例如,工业冶炼金的原理:2[Zn(CN)2]-+Zn=2Au+[Zn(CN)4]2-。与CN-互为等电子体的分子有___________ (只写一种),1mol[Zn(CN)4]2-中含_____ molσ键。
(5)类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是___________ 。
(1)某同学画出基态碳原子的核外电子排布图:
 ,该电子排布图违背了
,该电子排布图违背了 、-CH3、CH
、-CH3、CH 都是重要的有机反应中间体,CH
都是重要的有机反应中间体,CH 的VSEPR模型为
的VSEPR模型为(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为
(3)基态溴原子的价层电子排布图为
(4)CN-能与多种金属离子形成配合物,例如,工业冶炼金的原理:2[Zn(CN)2]-+Zn=2Au+[Zn(CN)4]2-。与CN-互为等电子体的分子有
(5)类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是
您最近半年使用:0次
解题方法
9 . ⅤA族元素及其化合物在材料等方面有重要用途。根据所学知识回答下列问题:
(1)基态砷原子处于最高能级的电子云轮廓图为_______ 形。
(2) 、
、 、
、 是同主族元素的氢化物,其中键角最小的是
是同主族元素的氢化物,其中键角最小的是_______ 。
(3)叠氮化钠( )用于汽车的安全气囊中,当发生车祸时迅速分解放出氮气,使安全气囊充气。可与酸反应生成叠氮酸(
)用于汽车的安全气囊中,当发生车祸时迅速分解放出氮气,使安全气囊充气。可与酸反应生成叠氮酸(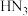 ),叠氮酸中3个氮原子的杂化类型分别为
),叠氮酸中3个氮原子的杂化类型分别为_______ (不分先后)。
(4)N原子之间可以形成π键,而 原子之间较难形成π键。从原子结构角度分析,其原因为
原子之间较难形成π键。从原子结构角度分析,其原因为_______ 。
(5)往硫酸铜溶液中加入过量氨水,可生成配离子 。已知
。已知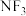 与
与 的空间构型都是三角锥形,但
的空间构型都是三角锥形,但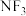 不易与
不易与 形成配离子,其原因是
形成配离子,其原因是_______ 。
(6)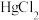 和不同浓度
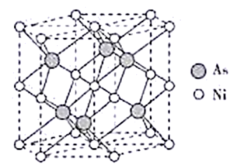
和不同浓度 反应得到某种含汞化合物的晶胞结构(有四个等同的小立方体)如图所示。(部分微粒不在晶胞内,每个
反应得到某种含汞化合物的晶胞结构(有四个等同的小立方体)如图所示。(部分微粒不在晶胞内,每个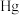 原子均处于小立方体的面心)
原子均处于小立方体的面心)
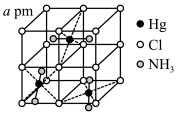
写出该含汞化合物的化学式:_______ 。则该晶体的密度
_______  (设阿伏加德罗常数的值为
(设阿伏加德罗常数的值为 ,用含a、
,用含a、 的代数式表示)。
的代数式表示)。
(1)基态砷原子处于最高能级的电子云轮廓图为
(2)
 、
、 、
、 是同主族元素的氢化物,其中键角最小的是
是同主族元素的氢化物,其中键角最小的是(3)叠氮化钠(
 )用于汽车的安全气囊中,当发生车祸时迅速分解放出氮气,使安全气囊充气。可与酸反应生成叠氮酸(
)用于汽车的安全气囊中,当发生车祸时迅速分解放出氮气,使安全气囊充气。可与酸反应生成叠氮酸(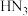 ),叠氮酸中3个氮原子的杂化类型分别为
),叠氮酸中3个氮原子的杂化类型分别为(4)N原子之间可以形成π键,而
 原子之间较难形成π键。从原子结构角度分析,其原因为
原子之间较难形成π键。从原子结构角度分析,其原因为(5)往硫酸铜溶液中加入过量氨水,可生成配离子
 。已知
。已知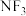 与
与 的空间构型都是三角锥形,但
的空间构型都是三角锥形,但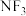 不易与
不易与 形成配离子,其原因是
形成配离子,其原因是(6)
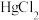 和不同浓度
和不同浓度 反应得到某种含汞化合物的晶胞结构(有四个等同的小立方体)如图所示。(部分微粒不在晶胞内,每个
反应得到某种含汞化合物的晶胞结构(有四个等同的小立方体)如图所示。(部分微粒不在晶胞内,每个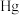 原子均处于小立方体的面心)
原子均处于小立方体的面心)
写出该含汞化合物的化学式:

 (设阿伏加德罗常数的值为
(设阿伏加德罗常数的值为 ,用含a、
,用含a、 的代数式表示)。
的代数式表示)。
您最近半年使用:0次
2021高三·全国·专题练习
10 . 回答下列问题
(1)Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性小的元素是___________ ;26号元素价层电子排布式为___________ ;L原子核外电子占有9个轨道,而且有一个未成对电子,L是___________ 元素。
(2)硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物。
①基态硒原子的价层电子排布式为___________ 。
②锗、砷、硒三种元素的第一电离能大小排序为___________ 。
(3)①Cu元素基态原子的价层电子排布式为___________ 。
②下列说法正确的是___________ (填字母)。
A.第一电离能:As>Ga
B.电负性:As>Ga
C.原子半径:As>Ga
③锗(Ge)是用途很广的半导体材料,基态锗原子的价层电子排布式为___________ 。在第二周期中,第一电离能位于硼元素与氮元素之间的元素有___________ 种。
④硼(B)及其化合物在化学中有重要的地位。Ga与B同主族,Ga的基态原子的核外电子排布式为___________ ,B、C、O三种元素的第一电离能由大到小的顺序是___________ 。
(4)已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X与Y可形成化合物X2Y3,Z元素可以形成负一价离子。
①X元素基态原子的电子排布式为___________ ,该元素的化学符号是___________ 。
②Y元素原子的价层电子排布图为___________ ,该元素的名称是___________ 。
③已知化合物X2Y3在稀硫酸中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是___________ 。
(1)Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性小的元素是
(2)硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物。
①基态硒原子的价层电子排布式为
②锗、砷、硒三种元素的第一电离能大小排序为
(3)①Cu元素基态原子的价层电子排布式为
②下列说法正确的是
A.第一电离能:As>Ga
B.电负性:As>Ga
C.原子半径:As>Ga
③锗(Ge)是用途很广的半导体材料,基态锗原子的价层电子排布式为
④硼(B)及其化合物在化学中有重要的地位。Ga与B同主族,Ga的基态原子的核外电子排布式为
(4)已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X与Y可形成化合物X2Y3,Z元素可以形成负一价离子。
①X元素基态原子的电子排布式为
②Y元素原子的价层电子排布图为
③已知化合物X2Y3在稀硫酸中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是
您最近半年使用:0次



