1 . 锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为_______ ,最高能级电子的电子云轮廓形状为_______ 。
(2)比较下列锗卤化物的熔点和沸点,分析其变化的原因_______ 。
(3)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是_______ 。
(4)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为_______ ,微粒之间存在的作用力是_______ 。
(5)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为( ,0,
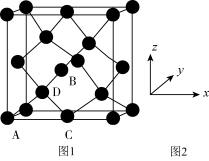
,0, );C为(
);C为(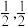 ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为_______ 。
②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a=565.76pm,其密度为_______ g·cm-3(列出计算式即可)。
(1)基态Ge原子的核外电子排布式为
(2)比较下列锗卤化物的熔点和沸点,分析其变化的原因
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | −49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
(4)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为
(5)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(
 ,0,
,0, );C为(
);C为(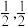 ,0)。则D原子的坐标参数为
,0)。则D原子的坐标参数为
②晶胞参数,描述晶胞的大小和形状。已知Ge单晶的晶胞参数a=565.76pm,其密度为
您最近一年使用:0次
名校
解题方法
2 . 下列说法正确的是
| A.S、Cl、K、Ca原子半径逐渐增大 |
B. 的电离方程式为: 的电离方程式为: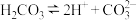 |
C. 和 和 互为同素异形体 互为同素异形体 |
| D.Ge,As,Se、Br的电负性依次增大 |
您最近一年使用:0次
名校
解题方法
3 . 晶体的特殊性质是科学家不断研究和探索的新领域,根据你对晶体的认识,回答下列问题。
(1)一种发光二极管的半导体材料为GaAsxP1-x,该化合物中Ga、As、P的电负性从大到小的顺序为_______ 。
(2)下表列出了钠的卤化物和硅的卤化物的熔点:
从表中可以看出,钠的卤化物的熔点比相应的硅的卤化物的熔点高很多,请用所学知识简单解释:_______ 。
(3)磷化硼(BP)是受高度关注的耐磨材料,可作为金属表面的保护层,其结构与金刚石类似,晶胞结构如图所示。B的杂化类型为_______ 。磷化硼晶胞沿z轴在xy平面的投影图中,B原子构成的几何形状是_______ 。已知晶胞边长为458pm,假设 是阿伏加德罗常数的值,则磷化硼晶体的密度是
是阿伏加德罗常数的值,则磷化硼晶体的密度是_______ g•cm-3(列出计算式)。
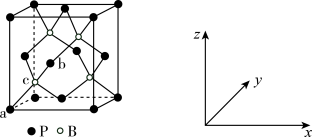
(4)原子坐标参数可表示晶胞内部各原子的相对位置。上图中原子坐标参数a为(0,0,0),b为( ,0,
,0, ),则c原子的坐标参数为
),则c原子的坐标参数为_______ 。
(1)一种发光二极管的半导体材料为GaAsxP1-x,该化合物中Ga、As、P的电负性从大到小的顺序为
(2)下表列出了钠的卤化物和硅的卤化物的熔点:
| NaX | NaF | NaCl | NaBr | NaI |
| 熔点/℃ | 995 | 801 | 775 | 651 |
| SiX4 | SiF4 | SiCl4 | SiBr4 | SiI4 |
| 熔点/℃ | -90.2 | -70.4 | 5.2 | 120.5 |
(3)磷化硼(BP)是受高度关注的耐磨材料,可作为金属表面的保护层,其结构与金刚石类似,晶胞结构如图所示。B的杂化类型为
 是阿伏加德罗常数的值,则磷化硼晶体的密度是
是阿伏加德罗常数的值,则磷化硼晶体的密度是
(4)原子坐标参数可表示晶胞内部各原子的相对位置。上图中原子坐标参数a为(0,0,0),b为(
 ,0,
,0, ),则c原子的坐标参数为
),则c原子的坐标参数为
您最近一年使用:0次
解题方法
4 . 下列是原子基态的最外层电子排布,其电负性最大的是
| A.2s2 | B.2s22p 1 | C.3s23p4 | D.2s22p5 |
您最近一年使用:0次
2022-10-24更新
|
799次组卷
|
4卷引用:黑龙江省饶河县高级中学2021-2022学年高二下学期第一次月考化学试题
黑龙江省饶河县高级中学2021-2022学年高二下学期第一次月考化学试题(已下线)【知识图鉴】单元讲练测选择性必修2第1章02基础练第一章 原子结构与性质(A卷·知识通关练)-2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修2)(已下线)第一章 原子结构与性质(A卷)
解题方法
5 . 有机物M的结构简式如图,下列有关M的说法正确的是
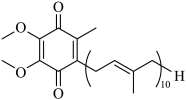

| A.组成元素中电负性最大的是O | B.分子中含有5个甲基 |
| C.分子式为C60H92O4 | D.分子中的氧原子不在同一平面 |
您最近一年使用:0次
名校
解题方法
6 . 从海水中可以获取Na、Mg、Cl、Br的单质及其化合物。下列说法正确的是
A.电负性大小: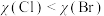 | B.半径大小: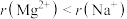 |
C.电离能大小: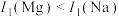 | D.酸性强弱: |
您最近一年使用:0次
名校
7 . 下列是A、B、C、D、E五种短周期元素的某些性质,下列判断正确的是
| A | B | C | D | E | |
| 化合价 | -4 | -2 | -1 | -2 | -1 |
| 电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
| A.C、D、E的氢化物的稳定性顺序为C>D>E |
| B.元素A的最外层轨道中无自旋方向相同的电子 |
| C.元素B、C不可能形成所有原子都满足8电子结构的化合物 |
| D.与元素B同周期第一电离能最小的元素的单质能与H2O发生置换反应 |
您最近一年使用:0次
名校
解题方法
8 . 下列各组元素的性质正确的是
| A.最高正价:F>S>Si | B.原子半径:P>N>C |
| C.第一电离能:B>Al>Ga | D.电负性:F>N>O |
您最近一年使用:0次
名校
解题方法
9 . 从废旧锂离子二次电池(主要成分为 ,还含有少量石墨和镀镍金属钢壳、铝箔以及钙等杂质)中回收钴和锂的工艺流程如下:
,还含有少量石墨和镀镍金属钢壳、铝箔以及钙等杂质)中回收钴和锂的工艺流程如下:

回答下列问题:
(1)“碱浸”的目的是_______ 。
(2)“酸浸”过程中 发生反应的离子方程式为:
发生反应的离子方程式为:_______ 。
(3)“萃取分离”中钴、锂萃取率与平衡pH关系如图所示,为使分离率最高,pH一般选择约在_______ 。

(4)若“沉锂”中 ,加入等体积等浓度
,加入等体积等浓度 溶液,此时实验所得沉锂率为
溶液,此时实验所得沉锂率为_______ 。(已知 的
的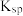 为
为 )
)
(5)化学电池在各行各业都得到了广泛应用,其发展对调整能源结构,实现低碳经济有着重要意义、通过下列反应可以制备某电池正极的活性物质 。
。
请回答下列问题:
①上述反应中涉及的N、O、P元素电负性由小到大的顺序是_______ 。
②基态 原子的价电子排布式为
原子的价电子排布式为_______ 。
③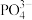 的立体构型为
的立体构型为_______ ,其中P原子的杂化方式是_______ 。
 ,还含有少量石墨和镀镍金属钢壳、铝箔以及钙等杂质)中回收钴和锂的工艺流程如下:
,还含有少量石墨和镀镍金属钢壳、铝箔以及钙等杂质)中回收钴和锂的工艺流程如下:
回答下列问题:
(1)“碱浸”的目的是
(2)“酸浸”过程中
 发生反应的离子方程式为:
发生反应的离子方程式为:(3)“萃取分离”中钴、锂萃取率与平衡pH关系如图所示,为使分离率最高,pH一般选择约在

(4)若“沉锂”中
 ,加入等体积等浓度
,加入等体积等浓度 溶液,此时实验所得沉锂率为
溶液,此时实验所得沉锂率为 的
的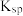 为
为 )
)(5)化学电池在各行各业都得到了广泛应用,其发展对调整能源结构,实现低碳经济有着重要意义、通过下列反应可以制备某电池正极的活性物质
 。
。
请回答下列问题:
①上述反应中涉及的N、O、P元素电负性由小到大的顺序是
②基态
 原子的价电子排布式为
原子的价电子排布式为③
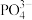 的立体构型为
的立体构型为
您最近一年使用:0次
22-23高二上·浙江·期末
解题方法
10 . 现有六种元素,其中A、B、C、D、E为短周期主族元素,F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
(1)某同学根据上述信息,推断A基态原子的核外电子排布为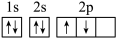 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了_______ 。
(2)B元素的电负性_______ (填“大于”“小于”或“等于”)C元素的电负性。B元素的第一电离能_______ (填“大于”“小于”或“等于”)C元素的第一电离能。
(3)E基态原子中能量最高的电子,其电子云在空间有_______ 个方向。
(4)下列关于F原子的价层电子轨道表示式正确的是_______(填字母)。
(5)与F同周期,原子序数为24的元素M,其基态原子的核外电子排布式为_______ 。
(6)元素铜与镍的第二电离能分别为ICu=1959kJ·mol-1,INi=1753kJ·mol-1,ICu>INi原因是_______ 。
(7)AC 的空间结构为
的空间结构为_______ 中心原子的杂化轨道类型为_______ 。
| A元素形成的物质种类繁多,其形成的一种固体单质工业上常用作切割工具 |
| B元素原子的核外p电子数比s电子数少1 |
| C元素基态原子p轨道有两个未成对电子 |
| D原子的第一至第四电离能分别是:I1=738kJ·mol-1;I2=1451kJ·mol-1;I3=7733kJ·mol-1;I4=10540kJ·mol-1 |
| E原子核外所有p轨道全满或半满 |
| F在周期表的第8纵列 |
 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了(2)B元素的电负性
(3)E基态原子中能量最高的电子,其电子云在空间有
(4)下列关于F原子的价层电子轨道表示式正确的是_______(填字母)。
A.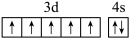 | B.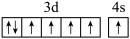 |
C.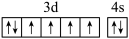 | D.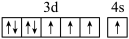 |
(6)元素铜与镍的第二电离能分别为ICu=1959kJ·mol-1,INi=1753kJ·mol-1,ICu>INi原因是
(7)AC
 的空间结构为
的空间结构为
您最近一年使用:0次



