1 . I.雄黄(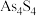 )、雌黄(
)、雌黄( )均可入药,具有解毒、杀菌、去燥湿的功效,也是中国画主要的黄色矿物质颜料。回答下列问题:
)均可入药,具有解毒、杀菌、去燥湿的功效,也是中国画主要的黄色矿物质颜料。回答下列问题:
(1)基态硫原子核外电子的运动轨道数有_______ 种;有___________ 种能量不同的电子;
(2)基态砷原子的价层电子的轨道表示式为___________ 。
(3)S和As比较,电负性较大的是___________
(4)As元素的第一电离能___________ Se元素的第一电离能(填“大于”“小于”或“等于”),原因是_______________________________ 。
II.目前已发现,在元素周期表中某些元素与右下方的主族元素的有些性质相似,这种相似性被称为对角线规则。据此回答下列问题:
(5)铍的最高价氧化物对应水化物的化学式是________ ,属于两性化合物,证明这一结论的有关离子方程式为__________________________ 、________________ 。
(6)若已知反应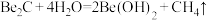 ,则
,则 与足量强碱溶液反应的离子方程式为
与足量强碱溶液反应的离子方程式为______________________ 。
(7)科学家证实, 属于共价化合物,请设计一个简单实验证明,方法是
属于共价化合物,请设计一个简单实验证明,方法是________________ 。用电子式表示 的形成过程:
的形成过程:__________
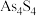 )、雌黄(
)、雌黄( )均可入药,具有解毒、杀菌、去燥湿的功效,也是中国画主要的黄色矿物质颜料。回答下列问题:
)均可入药,具有解毒、杀菌、去燥湿的功效,也是中国画主要的黄色矿物质颜料。回答下列问题:(1)基态硫原子核外电子的运动轨道数有
(2)基态砷原子的价层电子的轨道表示式为
(3)S和As比较,电负性较大的是
(4)As元素的第一电离能
II.目前已发现,在元素周期表中某些元素与右下方的主族元素的有些性质相似,这种相似性被称为对角线规则。据此回答下列问题:
(5)铍的最高价氧化物对应水化物的化学式是
(6)若已知反应
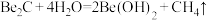 ,则
,则 与足量强碱溶液反应的离子方程式为
与足量强碱溶液反应的离子方程式为(7)科学家证实,
 属于共价化合物,请设计一个简单实验证明,方法是
属于共价化合物,请设计一个简单实验证明,方法是 的形成过程:
的形成过程:
您最近一年使用:0次
2 . 根据信息回答下列问题:
I.元素的电负性和元素的化合价一样,也是元素的一种基本性质。下面给出10种元素的电负性:
已知:
i.两成键元素间电负性差值大于1.7时,形成离子键;两成键元素间电负性差值小于1.7时,形成共价键。
ii.在水等强极性溶剂中,成键原子电负性的差异是影响化学键断裂难易程度的原因之一。水化物M−O−H结构中,成键原子电负性差异越大,所成化学键越容易断裂,电离出OH−或H+。
(1)通过分析电负性的变化规律,确定Mg元素电负性的最小范围___________ 。
(2)判断下列物质是离子化合物还是共价化合物:
A.Li3N B.BeCl2 C.AlCl3 D.SiC
①属于离子化合物的是___________ (填字母)。
②请设计实验方案证明其为离子化合物___________ 。
(3)HClO水溶液显酸性而不显碱性的依据是___________ 。
II.元素原子的第一电离能I1随原子序数呈周期性变化,请解释:
(4)Na的第一电离能小于Li,从原子结构的角度解释其原因___________ 。
(5)S的第一电离能小于P,结合价电子排布式解释其原因___________ 。
I.元素的电负性和元素的化合价一样,也是元素的一种基本性质。下面给出10种元素的电负性:
| 元素 | Al | Be | Mg | C | Cl | Na | Li | N | Si | O | H |
| 电负性 | 1.5 | 1.5 | 2.5 | 3.0 | 0.9 | 1.0 | 3.0 | 1.8 | 3.5 | 2.1 |
i.两成键元素间电负性差值大于1.7时,形成离子键;两成键元素间电负性差值小于1.7时,形成共价键。
ii.在水等强极性溶剂中,成键原子电负性的差异是影响化学键断裂难易程度的原因之一。水化物M−O−H结构中,成键原子电负性差异越大,所成化学键越容易断裂,电离出OH−或H+。
(1)通过分析电负性的变化规律,确定Mg元素电负性的最小范围
(2)判断下列物质是离子化合物还是共价化合物:
A.Li3N B.BeCl2 C.AlCl3 D.SiC
①属于离子化合物的是
②请设计实验方案证明其为离子化合物
(3)HClO水溶液显酸性而不显碱性的依据是
II.元素原子的第一电离能I1随原子序数呈周期性变化,请解释:
(4)Na的第一电离能小于Li,从原子结构的角度解释其原因
(5)S的第一电离能小于P,结合价电子排布式解释其原因
您最近一年使用:0次
名校
3 . 嫦娥5号月球探测器带回的月壤样品的元素分析结果如图,下列有关含量前六位元素的说法正确的是
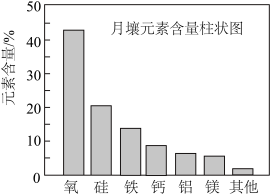
| A.基态Mg原子有6种能量不同的电子 | B.这六种元素中,电负性最大的是O |
| C.Ca原子核外有4种形状的原子轨道 | D.基态原子未成对电子数:Si<Al |
您最近一年使用:0次
4 . 下列有关说法正确的是
A.第一电离能: |
B.键角: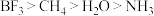 |
C.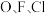 电负性由大到小的顺序为 电负性由大到小的顺序为 |
D. 溶于水和干冰升华都只有分子间作用力改变 溶于水和干冰升华都只有分子间作用力改变 |
您最近一年使用:0次
名校
解题方法
5 . 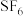 可用作高压发电系统的绝缘气体,分子呈正八面体结构,如图所示。有关
可用作高压发电系统的绝缘气体,分子呈正八面体结构,如图所示。有关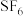 的说法正确的是
的说法正确的是
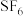 可用作高压发电系统的绝缘气体,分子呈正八面体结构,如图所示。有关
可用作高压发电系统的绝缘气体,分子呈正八面体结构,如图所示。有关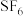 的说法正确的是
的说法正确的是
A.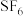 是只含极性键的非极性分子 是只含极性键的非极性分子 | B.键角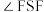 都等于 都等于 |
| C.S与F之间共用电子对偏向S | D.推测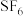 在水中溶解度较大 在水中溶解度较大 |
您最近一年使用:0次
6 . 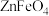 是一种性能优良的软磁材料,也是一种催化剂。工业上利用反应:
是一种性能优良的软磁材料,也是一种催化剂。工业上利用反应: 制备
制备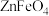 。下列说法错误的是
。下列说法错误的是
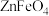 是一种性能优良的软磁材料,也是一种催化剂。工业上利用反应:
是一种性能优良的软磁材料,也是一种催化剂。工业上利用反应: 制备
制备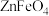 。下列说法错误的是
。下列说法错误的是A.电负性 |
B. 分子中有2个 分子中有2个 键,2个 键,2个 键 键 |
C.基态 的核外电子排布式为 的核外电子排布式为 |
D.基态氧原子中,电子占据的最高能级符号为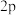 |
您最近一年使用:0次
17-18高一下·重庆·期中
名校
解题方法
7 . 已知:元素的电负性和元素的化合价一样,也是元素的一种基本性质;两成键元素间电负性差值大于1.7时,通常形成离子键,两成键元素间电负性差值小于1.7时,通常形成共价键。下表给出了14种元素的电负性,则下列说法错误的是
| 元素 | Al | B | Be | C | Cl | F | Li |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 |
| 元素 | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
| A.随着原子序数递增,元素的电负性呈周期性变化 |
| B.元素电负性越大,其非金属性越强 |
| C.根据电负性数据可知Mg3N2中含有离子键 |
| D.BeCl2含金属元素铍,故属于离子化合物 |
您最近一年使用:0次
2023-07-29更新
|
99次组卷
|
6卷引用:第38练 原子结构与元素的性质-2023年高考化学一轮复习小题多维练(全国通用)
(已下线)第38练 原子结构与元素的性质-2023年高考化学一轮复习小题多维练(全国通用)第一章 本章复习提升1【全国百强校】重庆市第一中学2017-2018学年高一下学期期中考试化学试题江西省赣州市石城县石城中学2020-2021学年高一下学期3月月考化学试题云南省龙陵县第一中学2022-2023学年高二下学期期末考试化学试题陕西省西安交通大学附属中学2023-2024学年高二上学期期中考试化学试题
名校
解题方法
8 . 元素X、Y、Z在周期表中的相对位置如下所示,已知Y元素原子的外围电子排布为ns(n-1)np(n+1),则下列说法不正确的是
| X | ||
| Y | ||
| Z |
| A.X元素所在周期中所含非金属元素最多 |
| B.Y元素在周期表的第3周期第ⅥA族 |
| C.Z的电负性比X和Y都弱 |
| D.Z元素原子的核外电子排布简式为:[Ar]4s24p3 |
您最近一年使用:0次
解题方法
9 . W、X、Y、Z、R是五种短周期主族元素,原子序数依次增大。W元素的一种离子与 具有相同的电子层排布且半径稍大,X原子核外L层的电子数与Y原子核外M层的电子数之比为3:2,X与Z同主族,Z的价层电子排布式为
具有相同的电子层排布且半径稍大,X原子核外L层的电子数与Y原子核外M层的电子数之比为3:2,X与Z同主族,Z的价层电子排布式为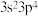 。下列说法错误的是
。下列说法错误的是
 具有相同的电子层排布且半径稍大,X原子核外L层的电子数与Y原子核外M层的电子数之比为3:2,X与Z同主族,Z的价层电子排布式为
具有相同的电子层排布且半径稍大,X原子核外L层的电子数与Y原子核外M层的电子数之比为3:2,X与Z同主族,Z的价层电子排布式为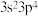 。下列说法错误的是
。下列说法错误的是| A.简单气态氢化物的热稳定性:Z>Y |
| B.W与Li的原子半径:W<Li |
| C.X和Y的第一电离能:X>Y |
| D.X、Z、R的电负性:R<Z<X |
您最近一年使用:0次
名校
解题方法
10 . 很多含巯基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物Ⅰ可与氧化汞生成化合物Ⅱ。
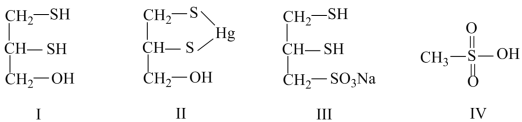
(1)1mol化合物Ⅰ含有_______ mol σ键。
(2)基态硫原子价层电子排布式为_______ 。
(3)H2S、CH4、H2O的沸点由高到低顺序为_______ 。
(4)汞的原子序数为80,位于元素周期表第_______ 周期第ⅡB族。
(5)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有_______ 。
A.在Ⅰ中S原子采取sp3杂化
B.在Ⅱ中S元素的电负性最大
C.在Ⅲ中C-C-C键角是180°
D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等

(1)1mol化合物Ⅰ含有
(2)基态硫原子价层电子排布式为
(3)H2S、CH4、H2O的沸点由高到低顺序为
(4)汞的原子序数为80,位于元素周期表第
(5)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有
A.在Ⅰ中S原子采取sp3杂化
B.在Ⅱ中S元素的电负性最大
C.在Ⅲ中C-C-C键角是180°
D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
您最近一年使用:0次



