1 . 依据原子结构知识回答下列问题。
(1)下列说法错误的是_______ 。
A.电负性:Si<H<C<N
B.离子半径: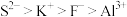
C.原子的未成对电子数: Cr>Mn>Si>Br
D.第二周期中元素原子的第一电离能介于B和N之间的元素有2种
E.前四周期元素中,基态原子中价电子数与其所在周期数相同的元素有4种
(2)基态S原子的价电子轨道表示式为_______ ,其电子占据的最高能层符号为_______ ,其价电子中两种自旋状态的电子数之比为_______ 。
(3)基态F原子核外电子的空间运动状态有_______ 种。下列属于F原子激发态的电子排布式是_______ (填标号,下同),其中能量较高的是_______ 。
A.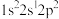 b.
b. c.
c. d.
d.
(4)Cr元素位于元素周期表_______ 区。Cr与Mn相比,第二电离能与第一电离能差值更大的是_______ ,原因是_______ 。
(1)下列说法错误的是
A.电负性:Si<H<C<N
B.离子半径:
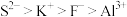
C.原子的未成对电子数: Cr>Mn>Si>Br
D.第二周期中元素原子的第一电离能介于B和N之间的元素有2种
E.前四周期元素中,基态原子中价电子数与其所在周期数相同的元素有4种
(2)基态S原子的价电子轨道表示式为
(3)基态F原子核外电子的空间运动状态有
A.
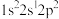 b.
b. c.
c. d.
d.
(4)Cr元素位于元素周期表
您最近一年使用:0次
2023-02-11更新
|
412次组卷
|
2卷引用:山东省淄博市2022-2023学年高二上学期期末考试化学试题
22-23高三上·贵州贵阳·期末
解题方法
2 . 铜及其化合物在日常生产、生活中有着广泛的应用。回答下列问题:
(1)基态Cu原子价电子排布式为_______ 。
(2)K与Cu同周期,最外层电子数相同,但Cu的熔点远高于K,因为_______ 。
(3)含铜废液可以利用铜萃取剂M,通过如下反应实现铜离子的富集,进行回收。
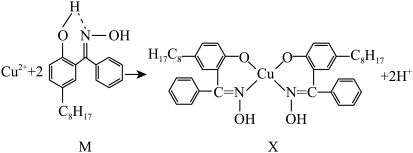
①M所含元素的电负性由大到小顺序是_______ (用元素符号表示)。
②X化合物中中心原子铜的配位数是_______ ,上述反应中断裂和生成的化学键有_______ (填字母序号)。
a.离子键 b.共价键 c.金属键 d.氢键 e.配位键
(4)高温下, 比CuO稳定的原因是
比CuO稳定的原因是_______ 。
(5)离子型配合物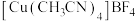 中,阴离子的空间构型为
中,阴离子的空间构型为_______ ,配体中碳原子的杂化方式是_______ 。
(6)由Cu,Sb,Se组成的热电材料,其晶胞结构如图所示, ,
,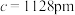 ,该晶体的密度是
,该晶体的密度是_______  (列式即可)
(列式即可)
(1)基态Cu原子价电子排布式为
(2)K与Cu同周期,最外层电子数相同,但Cu的熔点远高于K,因为
(3)含铜废液可以利用铜萃取剂M,通过如下反应实现铜离子的富集,进行回收。

①M所含元素的电负性由大到小顺序是
②X化合物中中心原子铜的配位数是
a.离子键 b.共价键 c.金属键 d.氢键 e.配位键
(4)高温下,
 比CuO稳定的原因是
比CuO稳定的原因是(5)离子型配合物
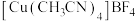 中,阴离子的空间构型为
中,阴离子的空间构型为(6)由Cu,Sb,Se组成的热电材料,其晶胞结构如图所示,
 ,
,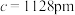 ,该晶体的密度是
,该晶体的密度是 (列式即可)
(列式即可)
您最近一年使用:0次
22-23高三上·山东临沂·期末
名校
3 . 铁、铜及其化合物在生产生活中有着广泛应用。回答下列问题:
(1)基态Fe原子核外电子的空间运动状态有_______ 种;试从结构角度解释 易被氧化为
易被氧化为 的原因
的原因_______ ; 是检验
是检验 的特征试剂,
的特征试剂,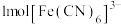 中含有
中含有_______ molσ键。
(2) 可形成
可形成 ,其中en代表
,其中en代表 。该化合物分子中VSEPR模型为四面体的非金属原子共有
。该化合物分子中VSEPR模型为四面体的非金属原子共有_______ 个;en中各元素的电负性由小到大的顺序为_______ 。
(3)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数和晶胞中各原子的投影位置如图所示,晶胞棱边夹角均为90°。
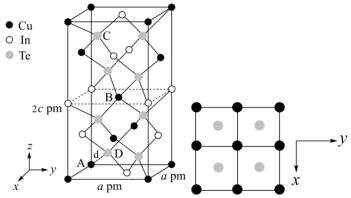
该晶体的化学式为_______ ;A点、B点原子的分数坐标分别为(0,0,0)、( ,
, ,
, ),则C点原子的分数坐标为
),则C点原子的分数坐标为_______ ;晶胞中A、D原子间距离d=_______ cm。
(1)基态Fe原子核外电子的空间运动状态有
 易被氧化为
易被氧化为 的原因
的原因 是检验
是检验 的特征试剂,
的特征试剂,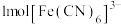 中含有
中含有(2)
 可形成
可形成 ,其中en代表
,其中en代表 。该化合物分子中VSEPR模型为四面体的非金属原子共有
。该化合物分子中VSEPR模型为四面体的非金属原子共有(3)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数和晶胞中各原子的投影位置如图所示,晶胞棱边夹角均为90°。

该晶体的化学式为
 ,
, ,
, ),则C点原子的分数坐标为
),则C点原子的分数坐标为
您最近一年使用:0次
4 . 锂离子电池能够成为产业发展方向,主要基于其拥有较高的能量重量比和能量体积比等多项特性,正极材料为钴酸锂、锰酸锂和磷酸亚铁锂材料等。
(1)工业上用 、
、 、LiCl及苯胺(
、LiCl及苯胺(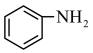 )为原料制备磷酸亚铁锂。基态Cl原子价电子的轨道表示式为
)为原料制备磷酸亚铁锂。基态Cl原子价电子的轨道表示式为_______ ,其在元素周期表中的位置为_______ ,O、N、P的电负性由大到小的顺序为_______ 。
(2)锂离子电池可采用离子液体作为电解质,以下为2种离子液体的结构。
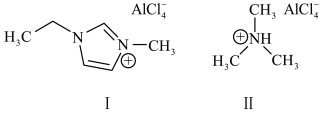
化合物Ⅰ中碳原子的杂化轨道类型为_______ ,1mol化合物Ⅰ中含有_______ 个σ键;化合物Ⅱ中阳离子的空间构型为_______ 。传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是_______ 。
(3)实验室可利用硝酸锰受热分解的方式制备锰的一种氧化物(晶胞结构如图所示)。
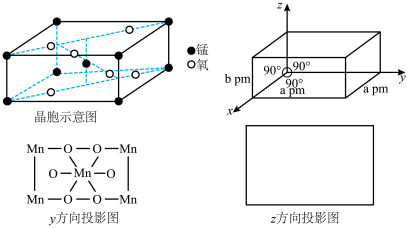
该锰的氧化物中Mn的化合价为_______ ,请画出z方向投影图_______ 。
(1)工业上用
 、
、 、LiCl及苯胺(
、LiCl及苯胺( )为原料制备磷酸亚铁锂。基态Cl原子价电子的轨道表示式为
)为原料制备磷酸亚铁锂。基态Cl原子价电子的轨道表示式为(2)锂离子电池可采用离子液体作为电解质,以下为2种离子液体的结构。

化合物Ⅰ中碳原子的杂化轨道类型为
(3)实验室可利用硝酸锰受热分解的方式制备锰的一种氧化物(晶胞结构如图所示)。

该锰的氧化物中Mn的化合价为
您最近一年使用:0次
名校
5 . 联合国将2019年定为“国际化学元素周期表年”。元素周期表前四周期的元素a、b、c、d、e、f的原子序数依次增大。a、b、d的价电子层中未成对电子均只有1个,a的基态原子核外有3种不同能量的电子,b、d的单质均能与水剧烈反应,b-和d+核外电子数相差8,c的最外层电子数为其电子层数的2倍,补充维生素D可促进人体对元素e的吸收,f的价电子层中的未成对电子数为4.回答下列问题:
(1)a、b、c的电负性由小到大的顺序为___________ (用元素符号表示)。基态f原子的核外电子排布式为___________ 。
(2)ab3分子中心原子的杂化方式为___________ ,其键角为___________ 。
(3)c的简单氢化物与同族相邻两种元素所形成的简单氢化物沸点由高到低的顺序为___________ (用化学式表示),理由:___________ 。
(4)CO与f形成的f(CO)5常温下是一种浅黄色液体,f(CO)5的空间构型为___________ ,提供孤电子对的原子是___________ (填元素符号),CO分子中σ键与π键数目之比为___________ 。
(1)a、b、c的电负性由小到大的顺序为
(2)ab3分子中心原子的杂化方式为
(3)c的简单氢化物与同族相邻两种元素所形成的简单氢化物沸点由高到低的顺序为
(4)CO与f形成的f(CO)5常温下是一种浅黄色液体,f(CO)5的空间构型为
您最近一年使用:0次
解题方法
6 . A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是_____ (填元素符号),其中C原子的核外电子排布式为_____ 。
(2)单质A有两种同素异形体,其中沸点高的是_____ (填分子式);A和B的氢化物所属的晶体类型分别为_____ 和_____ 。
(3)C和D反应可生成组成比为1︰3的化合物E,E的立体构型为_____ ,中心原子的杂化轨道类型为_____ 。
(4)化合物D2A的中心原子的价层电子对数为_____ ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为_____ 。
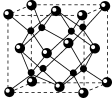
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为_____ ;晶胞中A原子的配位数为_____ 。
(1)四种元素中电负性最大的是
(2)单质A有两种同素异形体,其中沸点高的是
(3)C和D反应可生成组成比为1︰3的化合物E,E的立体构型为
(4)化合物D2A的中心原子的价层电子对数为
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为

您最近一年使用:0次
解题方法
7 . 大部分非金属元素分布在元素周期表的p区,非金属元素数量虽少,却构成了丰富的物质世界。回答下列问题:
(1)基态 原子的价电子排布式为
原子的价电子排布式为_______ , 、
、 、
、 的沸点由高到低的顺序依次为
的沸点由高到低的顺序依次为_______ 。
(2)超强酸“魔酸”是五氟化锑(SbF5))和氟磺酸(HSO3F)的混合物, 与
与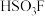 的结构如图:
的结构如图:

 中
中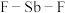 键的键角的度数分别为
键的键角的度数分别为_______ ,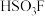 中所含元素电负性由大到小的顺序是
中所含元素电负性由大到小的顺序是_______ 。
(3)苯( )和吡啶(
)和吡啶( )结构相似,均具有芳香性。分子中的离域
)结构相似,均具有芳香性。分子中的离域 键可用符号
键可用符号 表示,其中m代表参与形成离域
表示,其中m代表参与形成离域 键的原子数,n代表参与形成离域
键的原子数,n代表参与形成离域 键的电子数(如苯分子中的离域
键的电子数(如苯分子中的离域 键可表示为
键可表示为 ,则
,则 中的离域
中的离域 键可表示为
键可表示为_______ ,N原子采用杂化_______ 。
(4)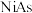 晶体有明显的金属性,是一种合金。
晶体有明显的金属性,是一种合金。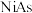 的晶体结构如图所示,六方晶胞底边长为
的晶体结构如图所示,六方晶胞底边长为 、高为
、高为 。晶胞中
。晶胞中 的分数坐标(
的分数坐标( ,
, ,
, )。
)。
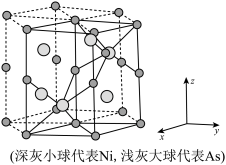
 原子的配位数
原子的配位数_______ ,晶胞中 的分数坐标
的分数坐标_______ ,晶胞密度为_______  。
。
(1)基态
 原子的价电子排布式为
原子的价电子排布式为 、
、 、
、 的沸点由高到低的顺序依次为
的沸点由高到低的顺序依次为(2)超强酸“魔酸”是五氟化锑(SbF5))和氟磺酸(HSO3F)的混合物,
 与
与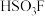 的结构如图:
的结构如图:
 中
中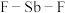 键的键角的度数分别为
键的键角的度数分别为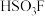 中所含元素电负性由大到小的顺序是
中所含元素电负性由大到小的顺序是(3)苯(
 )和吡啶(
)和吡啶( )结构相似,均具有芳香性。分子中的离域
)结构相似,均具有芳香性。分子中的离域 键可用符号
键可用符号 表示,其中m代表参与形成离域
表示,其中m代表参与形成离域 键的原子数,n代表参与形成离域
键的原子数,n代表参与形成离域 键的电子数(如苯分子中的离域
键的电子数(如苯分子中的离域 键可表示为
键可表示为 ,则
,则 中的离域
中的离域 键可表示为
键可表示为(4)
 晶体有明显的金属性,是一种合金。
晶体有明显的金属性,是一种合金。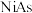 的晶体结构如图所示,六方晶胞底边长为
的晶体结构如图所示,六方晶胞底边长为 、高为
、高为 。晶胞中
。晶胞中 的分数坐标(
的分数坐标( ,
, ,
, )。
)。
 原子的配位数
原子的配位数 的分数坐标
的分数坐标 。
。
您最近一年使用:0次
名校
8 . 硒( )是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(
)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光( )效应以来,
)效应以来, 在发光材料、生物医学等领域引起广泛关注。一种含
在发光材料、生物医学等领域引起广泛关注。一种含 的新型
的新型 分子
分子 的合成路线如下:
的合成路线如下: 与S同族,基态硒原子价电子排布式为
与S同族,基态硒原子价电子排布式为_______ 。
(2) 的沸点低于
的沸点低于 ,其原因是
,其原因是_______ 。
(3)关于I~III三种反应物,下列说法正确的有_______ 。
A.I中仅有 键
键
B.I中的 键为非极性共价键
键为非极性共价键
C.II易溶于水
D.II中原子的杂化轨道类型只有 与
与
E.I~III含有的元素中,O电负性最大
(4)IV中具有孤对电子的原子有_______ 。
(5)硒的两种含氧酸的酸性强弱为
_______  (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠( )可减轻重金属铊引起的中毒。
)可减轻重金属铊引起的中毒。 的立体构型为
的立体构型为_______ 。
 )是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(
)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光( )效应以来,
)效应以来, 在发光材料、生物医学等领域引起广泛关注。一种含
在发光材料、生物医学等领域引起广泛关注。一种含 的新型
的新型 分子
分子 的合成路线如下:
的合成路线如下:
 与S同族,基态硒原子价电子排布式为
与S同族,基态硒原子价电子排布式为(2)
 的沸点低于
的沸点低于 ,其原因是
,其原因是(3)关于I~III三种反应物,下列说法正确的有
A.I中仅有
 键
键B.I中的
 键为非极性共价键
键为非极性共价键C.II易溶于水
D.II中原子的杂化轨道类型只有
 与
与
E.I~III含有的元素中,O电负性最大
(4)IV中具有孤对电子的原子有
(5)硒的两种含氧酸的酸性强弱为

 (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠( )可减轻重金属铊引起的中毒。
)可减轻重金属铊引起的中毒。 的立体构型为
的立体构型为
您最近一年使用:0次
2022-10-08更新
|
710次组卷
|
6卷引用:山东省乳山市银滩高级中学2021-2022学年高一6月月考化学试题
解题方法
9 . 硅电池、锂离子电池都是现代高性能电池的代表,高性能的电极材料与物质结构密切相关。
(1)LiFePO4因具有良好的结构稳定性而成为新一代正极材料,这与 的结构密切相关,
的结构密切相关, 的空间结构为
的空间结构为_______ 。P、O、S的电负性从大到小的顺序为_______ 。
(2)通常在电极材料表面进行“碳”包覆处理以增强其导电性。抗坏血酸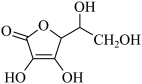 常被用作碳包覆的碳源,其易溶于水的原因是
常被用作碳包覆的碳源,其易溶于水的原因是_______ ,抗坏血酸中碳原子的杂化方式为_______ ,1 mol抗坏血酸中手性碳原子的数目为_______ 。
(3)目前最常用的电极材料有锂钴复合氧化物和石墨。
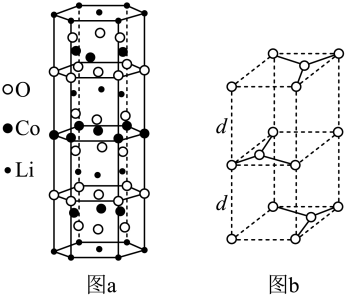
①锂钴复合氧化物中Li、Co、O分别形成了六边层状结构(图a),按照Li−O−Co−O−Li−O−Co−O−Li……顺序排列,则该化合物的化学式为_______ ,Co3+的价层电子排布式为_______ 。
②石墨晶胞(图b)层间距为d pm,C−C键长为a pm,石墨晶体的密度为ρ g·cm−3,列式表示阿伏加德罗常数为_______ mol−l。
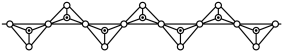
(4)硅酸盐中Si元素一般显+4价,如下图所示是一种无限长单键的多聚硅酸根离子的结构,其中“ ”表示Si原子,“o”表示氧原子,则该长链硅酸根离子的通式为
”表示Si原子,“o”表示氧原子,则该长链硅酸根离子的通式为_______ 。
(1)LiFePO4因具有良好的结构稳定性而成为新一代正极材料,这与
 的结构密切相关,
的结构密切相关, 的空间结构为
的空间结构为(2)通常在电极材料表面进行“碳”包覆处理以增强其导电性。抗坏血酸
 常被用作碳包覆的碳源,其易溶于水的原因是
常被用作碳包覆的碳源,其易溶于水的原因是(3)目前最常用的电极材料有锂钴复合氧化物和石墨。

①锂钴复合氧化物中Li、Co、O分别形成了六边层状结构(图a),按照Li−O−Co−O−Li−O−Co−O−Li……顺序排列,则该化合物的化学式为
②石墨晶胞(图b)层间距为d pm,C−C键长为a pm,石墨晶体的密度为ρ g·cm−3,列式表示阿伏加德罗常数为
(4)硅酸盐中Si元素一般显+4价,如下图所示是一种无限长单键的多聚硅酸根离子的结构,其中“
 ”表示Si原子,“o”表示氧原子,则该长链硅酸根离子的通式为
”表示Si原子,“o”表示氧原子,则该长链硅酸根离子的通式为
您最近一年使用:0次
10 . 铁、铜及其化合物在生产生活中有着广泛应用。回答下列问题:
(1)基态Fe原子核外电子的空间运动状态有_______ 种;试从结构角度解释 易被氧化为
易被氧化为 的原因
的原因_______ ; 是检验
是检验 的特征试剂,
的特征试剂,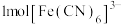 中含有
中含有_______ molσ键。
(2) 可形成
可形成 ,其中en代表
,其中en代表 。该化合物分子中,
。该化合物分子中, 的配位数为
的配位数为_______ ;VSEPR模型为四面体的非金属原子共有_______ 个;en中各元素的电负性由小到大的顺序为_______ 。
(3)一种由Cu、In,Te组成的晶体属四方晶系,晶胞参数和晶胞中各原子的投影位置如图所示,晶胞棱边夹角均为90°。
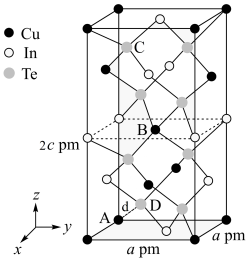
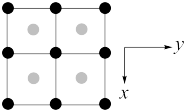
该晶体的化学式为_______ ;A点、B点原子的分数坐标分别为(0,0,0)、( ,
, ,
, ),则C点原子的分数坐标为
),则C点原子的分数坐标为_______ ;晶胞中A、D原子间距离d=_______ cm。
(1)基态Fe原子核外电子的空间运动状态有
 易被氧化为
易被氧化为 的原因
的原因 是检验
是检验 的特征试剂,
的特征试剂,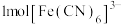 中含有
中含有(2)
 可形成
可形成 ,其中en代表
,其中en代表 。该化合物分子中,
。该化合物分子中, 的配位数为
的配位数为(3)一种由Cu、In,Te组成的晶体属四方晶系,晶胞参数和晶胞中各原子的投影位置如图所示,晶胞棱边夹角均为90°。


该晶体的化学式为
 ,
, ,
, ),则C点原子的分数坐标为
),则C点原子的分数坐标为
您最近一年使用:0次
2022-09-11更新
|
375次组卷
|
2卷引用:山东省临沂市2022-2023学年高三上学期开学摸底考试化学试题



