名校
解题方法
1 . 元素A、D、E、W、X、Y、Z基态原子,原子序数依次增大且分占前四周期,D的各能级电子数相等;E的核外电子有3种空间运动状态。W的价电子排布式为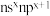 ,X的最高能级的单电子数是A的3倍,Y的最高价氧化物水化物酸性最强,Z与A中的单电子数(不为0)和最外层电子数均相同,但两者族序数不同。请用化学用语回答下列问题:
,X的最高能级的单电子数是A的3倍,Y的最高价氧化物水化物酸性最强,Z与A中的单电子数(不为0)和最外层电子数均相同,但两者族序数不同。请用化学用语回答下列问题:
(1)Z元素在周期表中的位置为:___________ ;位于周期表___________ 区。
(2)D、E、W元素第一电离能由大到小顺序为:___________ ;电负性由大到小顺序为:___________ 。
(3)比较键角:
___________  (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(4)实验测得:ZY属于共价化合物,气态ZY分子的相对分子质量为199,该分子中含有配位键,则气态ZY分子的结构式可能为___________ 。
(5)某物质晶胞结构如图所示。
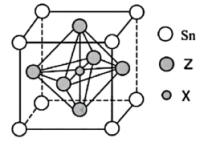
①该物质的化学式可以表示为___________ 。
②该晶胞中距离最近的 与Z原子的核间距为
与Z原子的核间距为 ,则该晶胞的密度为
,则该晶胞的密度为___________  (用含a、
(用含a、 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值,
表示阿伏加德罗常数的值, )。
)。
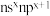 ,X的最高能级的单电子数是A的3倍,Y的最高价氧化物水化物酸性最强,Z与A中的单电子数(不为0)和最外层电子数均相同,但两者族序数不同。请用化学用语回答下列问题:
,X的最高能级的单电子数是A的3倍,Y的最高价氧化物水化物酸性最强,Z与A中的单电子数(不为0)和最外层电子数均相同,但两者族序数不同。请用化学用语回答下列问题:(1)Z元素在周期表中的位置为:
(2)D、E、W元素第一电离能由大到小顺序为:
(3)比较键角:

 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)(4)实验测得:ZY属于共价化合物,气态ZY分子的相对分子质量为199,该分子中含有配位键,则气态ZY分子的结构式可能为
(5)某物质晶胞结构如图所示。

①该物质的化学式可以表示为
②该晶胞中距离最近的
 与Z原子的核间距为
与Z原子的核间距为 ,则该晶胞的密度为
,则该晶胞的密度为 (用含a、
(用含a、 的代数式表示,
的代数式表示, 表示阿伏加德罗常数的值,
表示阿伏加德罗常数的值, )。
)。
您最近半年使用:0次
名校
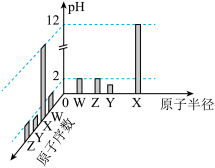
2 . 已知W、X、Y、Z均为短周期元素,常温下它们的最高价氧化物对应的水化物溶液(浓度均为 )的
)的 和原子半径、原子序数的关系如图所示。下列说法正确的是
和原子半径、原子序数的关系如图所示。下列说法正确的是
 )的
)的 和原子半径、原子序数的关系如图所示。下列说法正确的是
和原子半径、原子序数的关系如图所示。下列说法正确的是
A.电负性: | B.简单气态氢化物的热稳定性: |
C.离子半径: | D.化合物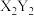 中含有极性共价键和非极性共价键 中含有极性共价键和非极性共价键 |
您最近半年使用:0次
名校
解题方法
3 . 前四周期元素W、X、Y、Z的原子序数依次增大且分属不同周期和族。X最高能级的电子数比电子层数多1,Y的最高价含氧酸为具有吸水性的弱酸,Z与W中均存在未成对电子,且两者未成对电子数和最外层电子数均相同。下列说法正确的是
A.电负性由大到小的顺序为: |
B.最高价氧化物的水化物的酸性: |
| C.第一电离能低于X的同周期元素有5种 |
| D.Z元素基态原子最高能层上有11种运动状态不同的电子 |
您最近半年使用:0次
2024-02-20更新
|
263次组卷
|
3卷引用:山东省青岛第五十八中学2023-2024学年高二上学期期末化学试卷
4 . 第ⅣA族元素中 是生物分子骨架的构成元素,
是生物分子骨架的构成元素, 、
、 可用作半导体材料。下列有关说法错误的是
可用作半导体材料。下列有关说法错误的是
 是生物分子骨架的构成元素,
是生物分子骨架的构成元素, 、
、 可用作半导体材料。下列有关说法错误的是
可用作半导体材料。下列有关说法错误的是| A.三种元素原子的次外层电子排布均是全充满状态 |
B.第一电离能: |
C. 与 与 中氢元素化合价不相同 中氢元素化合价不相同 |
D.原子半径 的原因是电子层数增加对半径的影响大于核电荷数增加的影响 的原因是电子层数增加对半径的影响大于核电荷数增加的影响 |
您最近半年使用:0次
5 . 2022年诺贝尔化学奖授予美国学者卡罗琳·贝尔托齐,丹麦学者莫滕·梅尔达尔,美国学者卡尔·巴里·沙普利斯,以表彰他们“对点击化学和生物正交化学的发展”的贡献。点击化学的代表反应为铜催化的叠氮一炔基环加成反应, 、
、 、
、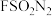 等均是点击化学中常用无机试剂。下列说法错误的是
等均是点击化学中常用无机试剂。下列说法错误的是
 、
、 、
、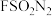 等均是点击化学中常用无机试剂。下列说法错误的是
等均是点击化学中常用无机试剂。下列说法错误的是A.基态 原子的最高能层符号为 原子的最高能层符号为 |
B.若将基态 原子的电子排布式写成 原子的电子排布式写成 ,则违反了能量最低原理 ,则违反了能量最低原理 |
C. 的电子式为 的电子式为 |
D.电负性: |
您最近半年使用:0次
名校
解题方法
6 . 《中华本草》中记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症等。下列叙述正确的是
| A.Zn的核外电子排布式为3d104s2 |
| B.ZnCO3中阴离子空间结构为平面正三角形 |
| C.ZnCO3中C的杂化方式为sp3 |
| D.电负性:Zn>C>O |
您最近半年使用:0次
2024-02-11更新
|
178次组卷
|
2卷引用:山东省菏泽市鄄城县第一中学2023-2024学年高二上学期1月期末化学试题
7 . 铁及其配合物在科研、生产中有着重要的应用。回答以下问题:
(1)写出Fe在元素周期表中的位置___________ 。
(2) 能与
能与 形成
形成 ,其中
,其中 电负性从大到小的顺序是
电负性从大到小的顺序是___________ , 离子的空间构型为
离子的空间构型为___________ 。
(3)邻二氮菲(phen, )能与
)能与 形成橙红色的配合物离子,可表示为
形成橙红色的配合物离子,可表示为 ,常用于
,常用于 定量检测。1mol该配合物离子中有
定量检测。1mol该配合物离子中有___________ mol配位键。某研究小组向反应后的溶液中滴加少量稀硫酸,溶液颜色变浅,简要说明原因:___________ 。
(4)配合物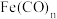 的中心原子价电子数与配体提供的电子数之和为18,一定条件下发生分解反应:
的中心原子价电子数与配体提供的电子数之和为18,一定条件下发生分解反应: 。
。
①分解反应过程中断裂的化学键只有配位键,形成的化学键是___________ 。
②写出配体CO的结构式___________ ,1mol该配合物中含有的 键数目为
键数目为___________ 。
(1)写出Fe在元素周期表中的位置
(2)
 能与
能与 形成
形成 ,其中
,其中 电负性从大到小的顺序是
电负性从大到小的顺序是 离子的空间构型为
离子的空间构型为(3)邻二氮菲(phen,
 )能与
)能与 形成橙红色的配合物离子,可表示为
形成橙红色的配合物离子,可表示为 ,常用于
,常用于 定量检测。1mol该配合物离子中有
定量检测。1mol该配合物离子中有(4)配合物
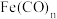 的中心原子价电子数与配体提供的电子数之和为18,一定条件下发生分解反应:
的中心原子价电子数与配体提供的电子数之和为18,一定条件下发生分解反应: 。
。①分解反应过程中断裂的化学键只有配位键,形成的化学键是
②写出配体CO的结构式
 键数目为
键数目为
您最近半年使用:0次
名校
8 . 根据要求回答下列问题:
(1)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。Zn、C、O电负性由大至小的顺序是_________ 。
(2)①O2- ②Al3+ ③Cl- ④Ca2+的半径由大到小排列为:________ (用序号表示)。
(3)下列属于氧原子激发态的轨道表示式的有___________ (填字母)。_________ ,位于在周期表______ 区(填s、p、d或ds)。
(5)基态Si原子中,电子占据的最高能层符号为________ 。
(6)基态S原子的原子核外电子有______ 种空间运动状态,其能量最高的电子电子云轮廓图为______ 形。
(7)由于Be与Al处于对角线位置,性质具有相似性,根据“对角线规则”,写出Be(OH)2与NaOH反应的化学方程式:________ 。
(1)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。Zn、C、O电负性由大至小的顺序是
(2)①O2- ②Al3+ ③Cl- ④Ca2+的半径由大到小排列为:
(3)下列属于氧原子激发态的轨道表示式的有
a.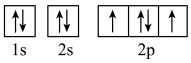 b.
b.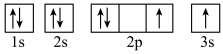
c.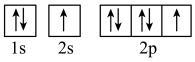 d.
d.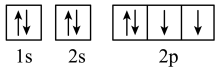
(5)基态Si原子中,电子占据的最高能层符号为
(6)基态S原子的原子核外电子有
(7)由于Be与Al处于对角线位置,性质具有相似性,根据“对角线规则”,写出Be(OH)2与NaOH反应的化学方程式:
您最近半年使用:0次
2024-02-07更新
|
312次组卷
|
3卷引用:山东省济南市历城第二中学2023-2024学年高二上学期期末化学模拟试题
名校
9 . 下列有关物质的结构与性质的说法错误的是
A.甘油酸(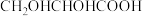 )中含有两个手性碳原子,是手性分子 )中含有两个手性碳原子,是手性分子 |
B.已知: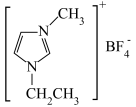 常温下呈液态,推测其是离子液体 常温下呈液态,推测其是离子液体 |
| C.氟的电负性大于氯的电负性,导致三氟乙酸的酸性大于三氯乙酸的酸性 |
| D.冠醚利用不同大小的空穴适配不同大小的碱金属离子进行“分子识别” |
您最近半年使用:0次
2024-02-04更新
|
110次组卷
|
2卷引用:山东省德州市齐河县第一中学2023-2024学年高二下学期4月月考化学试题
10 . 铬是一种重要的元素,在合金、电镀、鞣制领域都有重要的应用, 的配位能力很强,可以形成多种配离子。
的配位能力很强,可以形成多种配离子。
(1)基态Cr原子价层电子的轨道表达式为__________ ,同周期元素的基态原子最外层电子数与Cr相同的元素有__________ 种。
(2) 是最重要的铬(Ⅲ)盐之一,阴离子
是最重要的铬(Ⅲ)盐之一,阴离子 的空间构型为
的空间构型为__________ ,基态S原子核外电子中成对电子数和未成对电子数之比为__________ 。
(3)NH3、H2O、 都是常见的配体,以上配体中所含元素的电负性由大到小的顺序是
都是常见的配体,以上配体中所含元素的电负性由大到小的顺序是____________________ 。
(4) 中
中 键的数目为
键的数目为__________ ,基态N原子电子占据最高能级的电子云轮廓图为__________ 形。
(5)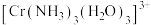 中配体
中配体 的杂化类型是
的杂化类型是__________ , 的键角
的键角__________  的键角(填“大于”、“小于”或“等于”),判断依据是
的键角(填“大于”、“小于”或“等于”),判断依据是______________________________ 。
 的配位能力很强,可以形成多种配离子。
的配位能力很强,可以形成多种配离子。(1)基态Cr原子价层电子的轨道表达式为
(2)
 是最重要的铬(Ⅲ)盐之一,阴离子
是最重要的铬(Ⅲ)盐之一,阴离子 的空间构型为
的空间构型为(3)NH3、H2O、
 都是常见的配体,以上配体中所含元素的电负性由大到小的顺序是
都是常见的配体,以上配体中所含元素的电负性由大到小的顺序是(4)
 中
中 键的数目为
键的数目为(5)
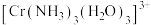 中配体
中配体 的杂化类型是
的杂化类型是 的键角
的键角 的键角(填“大于”、“小于”或“等于”),判断依据是
的键角(填“大于”、“小于”或“等于”),判断依据是
您最近半年使用:0次
2024-02-01更新
|
261次组卷
|
2卷引用:山东省德州市2023-2024学年高二上学期期末考试化学试题



