砷元素(As)广泛分布于自然界中,土壤、水体、矿物和生物体内都含有微量的砷。工业上提取砷的某步反应如下:

(1)砷元素在周期表中的位置是___________ 。
(2)沸点:AsH3___________ NH3,原因是___________ 。
A.> B.<
(3)关于I~Ⅳ四种物质的说法正确的是___________。
(4)已知H3AsO3为三元弱酸,则分子中As原子存在___________ 对孤电子对,AsO 的空间构型为
的空间构型为___________ 。
A.正四面体 B.三角锥形 C.角形
(5)溶解于水中的H3AsO4存在如下平衡:H3AsO4 H2AsO
H2AsO +H+,H2AsO
+H+,H2AsO
 HAsO
HAsO +H+,HAsO
+H+,HAsO
 AsO
AsO +H+。目前常用吸附法消除水中的砷,已知pH越大,吸附剂表面带的负电荷越多。分析吸附剂对砷的吸附量随pH升高而下降的原因
+H+。目前常用吸附法消除水中的砷,已知pH越大,吸附剂表面带的负电荷越多。分析吸附剂对砷的吸附量随pH升高而下降的原因___________ 。
(6)砷和镍(Ni)形成某种晶体的晶胞如图1所示,图2为该晶胞的俯视投影图。
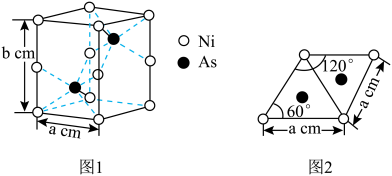
该晶胞中含有___________ 个Ni原子。该晶体的密度 ρ =___________ g·cm-3。(设NA为阿伏加德罗常数,该晶体的摩尔质量为M g·mol-1,用含 a、b、M和NA的代数式表示。)

(1)砷元素在周期表中的位置是
(2)沸点:AsH3
A.> B.<
(3)关于I~Ⅳ四种物质的说法正确的是___________。
| A.I中仅有σ键 | B.Ⅱ中部分元素的第一电离能: (O)> (O)> (S) (S) |
| C.Ⅲ中含有的元素中砷的电负性最大 | D.Ⅳ中含有的化学键为离子键、共价键 |
(4)已知H3AsO3为三元弱酸,则分子中As原子存在
 的空间构型为
的空间构型为A.正四面体 B.三角锥形 C.角形
(5)溶解于水中的H3AsO4存在如下平衡:H3AsO4
 H2AsO
H2AsO +H+,H2AsO
+H+,H2AsO
 HAsO
HAsO +H+,HAsO
+H+,HAsO
 AsO
AsO +H+。目前常用吸附法消除水中的砷,已知pH越大,吸附剂表面带的负电荷越多。分析吸附剂对砷的吸附量随pH升高而下降的原因
+H+。目前常用吸附法消除水中的砷,已知pH越大,吸附剂表面带的负电荷越多。分析吸附剂对砷的吸附量随pH升高而下降的原因(6)砷和镍(Ni)形成某种晶体的晶胞如图1所示,图2为该晶胞的俯视投影图。

该晶胞中含有
更新时间:2024-03-28 18:14:19
|
相似题推荐
解答题-结构与性质
|
较易
(0.85)
【推荐1】磷及其化合物在工农业生产中具有重要用途。如图所示为提纯白磷样品(含惰性杂质)的工艺流程。回答下列问题:
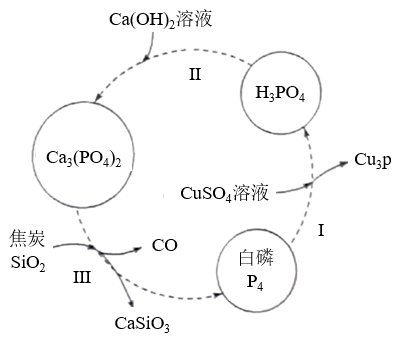
(1)过程III的化学方程式为________ 。
(2)基态Cu原子价层电子排布式为_______ ,在第四周期过渡金属中,基态原子未成对电子数最多的元素是________ (填元素符号)。非金属元素C、O、P、S的电负性由大到小的顺序为___________ 。
(3)元素铜与镍的第二电离能分别为ICu=1958kJ·mol-1、INi=1753kJ·mol-1,ICu>INi的原因是_____ 。
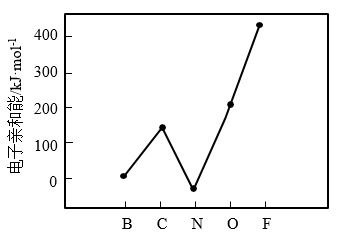
(4)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图所示,氮元素的E1呈现异常的原因是_____ 。

(1)过程III的化学方程式为
(2)基态Cu原子价层电子排布式为
(3)元素铜与镍的第二电离能分别为ICu=1958kJ·mol-1、INi=1753kJ·mol-1,ICu>INi的原因是
(4)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图所示,氮元素的E1呈现异常的原因是

您最近半年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
【推荐2】I.铁镁合金是一种性能优异的储氢材料。关于铁镁两种元素,请回答下列问题:
(1)同周期元素中,第一电离能小于镁的元素有_______ 种。
(2)基态Fe原子的简化电子排布式为_______ ,空间运动状态有_______ 种,Fe位于元周期表的_______ 区,基态原子的电子有_______ 种伸展方向。
(3)与Fe元素同周期,基态原子有2个未成对电子的金属元素有_______ 种,下列状态的铁中,电离最外层一个电子所需能量最大的是_______ (填标号)。
a.[Ar] b.[Ar]
b.[Ar]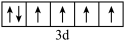
c.[Ar] d.[Ar]
d.[Ar]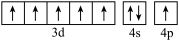
(4)试从结构角度解释 易被氧化为
易被氧化为
_______ 。
(5)对于呋喃: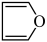 和吡咯:
和吡咯: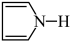 )所含的元素中,电负性最大的是
)所含的元素中,电负性最大的是_______ ,最小的是_______ ;第一电离能最大的是_______ 。
Ⅱ. 在食品、医药、电子工业中用途广泛。回答下列问题:
在食品、医药、电子工业中用途广泛。回答下列问题:
(6) 可做净水剂,其理由是
可做净水剂,其理由是_______ (用离子方程式表示)。
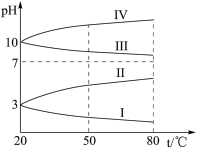
(7)下图是0.1mol/L电解质溶液的pH随温度变化的图像。其中符合0.1mol/L 溶液的是
溶液的是_______ (填罗马数字)。
(8)20℃时,0.1mol/L 溶液中,
溶液中, =
=_______ mol/L(写出准确数值)。
Ⅲ、某同学用酸性KMnO4溶液测定绿矾产品中Fe2+含量:请回答下列问题:
反应原理为: (Mn2+在溶液中为无色)
(Mn2+在溶液中为无色)
a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点
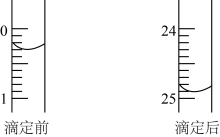
(9)若甲学生在实验过程中,记录滴定前后滴定管内液面读数如图所示,则此时消耗标准溶液的体积为_______ mL。
(10)此滴定实验达到终点的颜色变化为_______ 。
(11)重复滴定4次,每次消耗酸性KMnO4标准溶液的体积如表所示:
计算上述样品中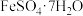 的质量分数为
的质量分数为_______ 。( ,小数点后保留一位)
,小数点后保留一位)
(12)若滴定前平视读数,滴定终点时仰视读数,则所测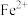 含量:
含量:_______ 。(填“无影响”、“偏高”或“偏低”)。
(1)同周期元素中,第一电离能小于镁的元素有
(2)基态Fe原子的简化电子排布式为
(3)与Fe元素同周期,基态原子有2个未成对电子的金属元素有
a.[Ar]
 b.[Ar]
b.[Ar]
c.[Ar]
 d.[Ar]
d.[Ar]
(4)试从结构角度解释
 易被氧化为
易被氧化为
(5)对于呋喃:
 和吡咯:
和吡咯: )所含的元素中,电负性最大的是
)所含的元素中,电负性最大的是Ⅱ.
 在食品、医药、电子工业中用途广泛。回答下列问题:
在食品、医药、电子工业中用途广泛。回答下列问题:(6)
 可做净水剂,其理由是
可做净水剂,其理由是(7)下图是0.1mol/L电解质溶液的pH随温度变化的图像。其中符合0.1mol/L
 溶液的是
溶液的是

(8)20℃时,0.1mol/L
 溶液中,
溶液中, =
=Ⅲ、某同学用酸性KMnO4溶液测定绿矾产品中Fe2+含量:请回答下列问题:
反应原理为:
 (Mn2+在溶液中为无色)
(Mn2+在溶液中为无色)a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点
(9)若甲学生在实验过程中,记录滴定前后滴定管内液面读数如图所示,则此时消耗标准溶液的体积为
(10)此滴定实验达到终点的颜色变化为
(11)重复滴定4次,每次消耗酸性KMnO4标准溶液的体积如表所示:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| V(KMnO4溶液)/mL | 17.10 | 19.98 | 20.00 | 20.02 |
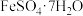 的质量分数为
的质量分数为 ,小数点后保留一位)
,小数点后保留一位)(12)若滴定前平视读数,滴定终点时仰视读数,则所测
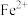 含量:
含量:
您最近半年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐3】尿素[ ]是一种重要的工业原料,在160℃下分解生成异氰酸和氨气,化学方程式为
]是一种重要的工业原料,在160℃下分解生成异氰酸和氨气,化学方程式为 。回答下列问题:
。回答下列问题:
(1)上述反应所涉及的各元素中,原子半径最大的是___________ (填元素符号),其原子核外电子共占据___________ 个原子轨道。
(2)上述元素中有三种元素处于同周期,则:
①最高价氧化物对应水化物的酸性最强的是___________ (填化学式)。
②元素的第一电离能由大到小的顺序是___________ (填元素符号,下同)。
③元素的电负性由大到小的顺序是___________ 。
(3)氰酸有两种结构,一种分子内含有三键,称为氰酸,另一种分子内不含三键,称为异氰酸,且两种结构中所有原子最外层均已达到稳定结构,分子中也不含环状结构。写出氰酸和异氰酸的结构式:___________ 、___________ 。
 ]是一种重要的工业原料,在160℃下分解生成异氰酸和氨气,化学方程式为
]是一种重要的工业原料,在160℃下分解生成异氰酸和氨气,化学方程式为 。回答下列问题:
。回答下列问题:(1)上述反应所涉及的各元素中,原子半径最大的是
(2)上述元素中有三种元素处于同周期,则:
①最高价氧化物对应水化物的酸性最强的是
②元素的第一电离能由大到小的顺序是
③元素的电负性由大到小的顺序是
(3)氰酸有两种结构,一种分子内含有三键,称为氰酸,另一种分子内不含三键,称为异氰酸,且两种结构中所有原子最外层均已达到稳定结构,分子中也不含环状结构。写出氰酸和异氰酸的结构式:
您最近半年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐1】太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置。
Ⅰ.第一代电池的光电转换材料是单晶硅。某单晶硅制备工艺中涉及的主要物质转化如下:

(1)下列事实能作为“非金属性C比Si强”的证据的是___________ (填字母)。
a.ⅰ中,C做还原剂
b.碳酸的酸性强于硅酸
c.碳酸的热稳定性弱于硅酸
(2)ⅱ中,1mol Si与3mol HCl反应转移4mol电子。
①该反应的化学方程式为___________ 。
② 中,H的化合价为
中,H的化合价为___________ ,由此推测Si的电负性比H的___________ (填“大”或“小”)。
(3)ⅲ中,利用沸点差异,可直接实现高纯硅与 的分离,从晶体类型角度解释其原因:
的分离,从晶体类型角度解释其原因:___________ 。
Ⅱ.第二代电池的光电转换材料是一种无机物薄膜,其光电转化率高于单晶硅。科学家在元素周期表中Si的附近寻找到元素A和D,并制成化合物AD的薄膜,其晶体结构类似单晶硅。Si、A、D在元素周期表中的位置关系如图所示。
(4)基态A原子核外电子排布式为___________ 。
(5)D的第一电离能比Se的大,从原子结构角度说明理由:___________ 。
Ⅰ.第一代电池的光电转换材料是单晶硅。某单晶硅制备工艺中涉及的主要物质转化如下:

(1)下列事实能作为“非金属性C比Si强”的证据的是
a.ⅰ中,C做还原剂
b.碳酸的酸性强于硅酸
c.碳酸的热稳定性弱于硅酸
(2)ⅱ中,1mol Si与3mol HCl反应转移4mol电子。
①该反应的化学方程式为
②
 中,H的化合价为
中,H的化合价为(3)ⅲ中,利用沸点差异,可直接实现高纯硅与
 的分离,从晶体类型角度解释其原因:
的分离,从晶体类型角度解释其原因:Ⅱ.第二代电池的光电转换材料是一种无机物薄膜,其光电转化率高于单晶硅。科学家在元素周期表中Si的附近寻找到元素A和D,并制成化合物AD的薄膜,其晶体结构类似单晶硅。Si、A、D在元素周期表中的位置关系如图所示。
| Si | ||
| A | D |
(4)基态A原子核外电子排布式为
(5)D的第一电离能比Se的大,从原子结构角度说明理由:
您最近半年使用:0次
解答题-无机推断题
|
较易
(0.85)
【推荐2】图表为元素周期表的一部分,请参照元素①~⑪在表中的位置,回答下列问题:
(1)元素②在周期表中的位置是___________ ,属于元素周期表的___________ 区元素。
(2)基态④原子有___________ 种运动状态的电子。
(3)基态⑨原子价电子排布式是___________ ,元素③⑩电负性较大的是___________ (用元素符号表示)。
(4)基态⑧原子中,电子占据的最高能级符号为___________ ,该能级具有的原子轨道数为___________ 。
(5)过渡元素的金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为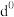 或
或 排布时,无颜色,为
排布时,无颜色,为 ~
~ 排布时,有颜色,如
排布时,有颜色,如 显粉红色。据此判断,
显粉红色。据此判断,
___________ (填“无”或“有”)颜色。
① | |||||||||||||||||
② | ③ | ④ | |||||||||||||||
⑤ | ⑥ | ⑦ | |||||||||||||||
⑧ | ⑨ | ⑩ | ⑪ | ||||||||||||||
(2)基态④原子有
(3)基态⑨原子价电子排布式是
(4)基态⑧原子中,电子占据的最高能级符号为
(5)过渡元素的金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为
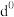 或
或 排布时,无颜色,为
排布时,无颜色,为 ~
~ 排布时,有颜色,如
排布时,有颜色,如 显粉红色。据此判断,
显粉红色。据此判断,
您最近半年使用:0次
【推荐3】现有位于元素周期表前四周期的A、B、C、D、E、F、G七种非零族元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
(1)由A、C形成的18电子分子的电子式为___________ 。
(2)D元素的基态原子核外共有________ 种不同空间运动状态的电子,B元素基态原子中能量最高的电子所占据的原子轨道呈________ 形。B、C、D三种元素电负性由大到小的顺序为________ (填元素符号)。
(3)某同学推断E元素基态原子的核外电子轨道表示式为 。该同学所画的电子轨道表示式违背了
。该同学所画的电子轨道表示式违背了______ ,该元素的第三电离能I3远远大于其第二电离能I2,其原因是_______ 。
(4)D、E、F三种元素的简单离子半径由大到小的顺序是________ (用离子符号表示)。
(5)检验G元素的方法是______ ,请用原子结构的知识解释其原理:_______ 。
| A | 在周期表的所有元素中原子半径最小 |
| B | 基态原子中有两个未成对电子 |
| C | 基态原子在同周期中未成对电子数最多 |
| D | 基态原子中有两个未成对电子 |
| E | 基态原子中没有未成对电子 |
| F | 同周期元素中电负性最大 |
| G | 同周期元素中第一电离能最小 |
(2)D元素的基态原子核外共有
(3)某同学推断E元素基态原子的核外电子轨道表示式为
 。该同学所画的电子轨道表示式违背了
。该同学所画的电子轨道表示式违背了(4)D、E、F三种元素的简单离子半径由大到小的顺序是
(5)检验G元素的方法是
您最近半年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐1】I.磷酸是一种重要的化工原料,是生产磷肥的原料,也是食品添加剂之一。
(1)工业上可以用磷单质与硝酸作用得到纯的磷酸(熔点 )。
)。 的VSEPR模型是
的VSEPR模型是_______ (填名称)。磷酸易形成过饱和溶液,难以结晶,可向其过饱和溶液中加入_______ 促进其结晶,但是所制得的磷酸中仍含有少量的水极难除去,其可能的原因是_______ 。
Ⅱ.研究小组以无水甲苯为溶剂, (易水解)和
(易水解)和 (叠氮化钠)为反应物制备纳米球状红磷。
(叠氮化钠)为反应物制备纳米球状红磷。
(2)甲苯干燥和收集的回流装置如图1所示(夹持及加热装置略)。以二苯甲酮为指示剂,无水时体系呈蓝色。
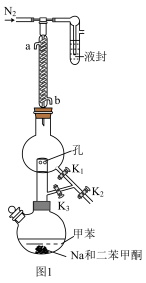
①金属 的作用是
的作用是_______ 。
②回流过程中,除水时打开的活塞是_______ ;体系变蓝后,改变开关状态收集甲苯。
(3)纳米球状红磷的制备装置如图2所示(夹持、搅拌、加热装置已略)。

①在氩气保护下,反应物在装置A中混匀后转入装置B,于 加热12小时,反应物完全反应,其化学方程式为
加热12小时,反应物完全反应,其化学方程式为_______ ;用氩气赶走空气的目的是_______ 。
②经冷却、离心分离和洗涤得到产品,洗涤时先后使用乙醇和水,依次洗去的物质是_______ 、_______ 。
(1)工业上可以用磷单质与硝酸作用得到纯的磷酸(熔点
 )。
)。 的VSEPR模型是
的VSEPR模型是Ⅱ.研究小组以无水甲苯为溶剂,
 (易水解)和
(易水解)和 (叠氮化钠)为反应物制备纳米球状红磷。
(叠氮化钠)为反应物制备纳米球状红磷。(2)甲苯干燥和收集的回流装置如图1所示(夹持及加热装置略)。以二苯甲酮为指示剂,无水时体系呈蓝色。

①金属
 的作用是
的作用是②回流过程中,除水时打开的活塞是
(3)纳米球状红磷的制备装置如图2所示(夹持、搅拌、加热装置已略)。

①在氩气保护下,反应物在装置A中混匀后转入装置B,于
 加热12小时,反应物完全反应,其化学方程式为
加热12小时,反应物完全反应,其化学方程式为②经冷却、离心分离和洗涤得到产品,洗涤时先后使用乙醇和水,依次洗去的物质是
您最近半年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐2】过渡金属元素在日常生活中有广泛的应用。
(1)金属钒在材料科学上有重要作用,被称为“合金的维生素”,基态钒原子的价层电子的排布式为________ ;基态 Mn原子核外有________ 种运动状态不同的电子,M层的电子云有________ 种不同的伸展方向。
(2)第四周期元素的第一电离能随原子序数增大,总趋势是逐渐增大的,但Ga的第一电离能明显低于Zn,原因是________ 。
(3)NO 与钴盐形成的配离子[Co(NO2)6]3−可用于检验 K+的存在。与NO
与钴盐形成的配离子[Co(NO2)6]3−可用于检验 K+的存在。与NO 互为等电子体的微粒
互为等电子体的微粒________ (写出一种),K3[Co(NO2)6]中存在的作用力有_______ 。
a.σ键 b.π键 c.配位键 d.离子键 e.范德华力
(4)锰的一种配合物的化学式为 Mn(BH4)2(THF)3,BH 的空间构型为
的空间构型为_______ 。
(5)FeO 是离子晶体,其晶格能可通过图中的 Born—Haber 循环计算得到。
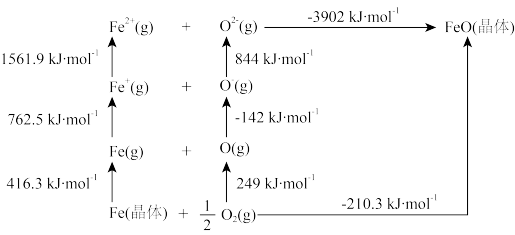
可知,O=O的键能为________ kJ•mol-1,FeO晶格能为________ kJ•mol-1。
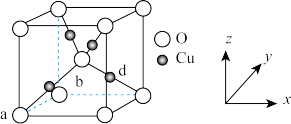
(6)铜与氧可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(1/2,1/2,1/2),则 d 点的坐标参数为________ ,已知该晶体的密度为ρg•cm-3,NA是阿伏加 德罗常数的值,则晶胞参数为________ pm。(列出计算式即可)
(1)金属钒在材料科学上有重要作用,被称为“合金的维生素”,基态钒原子的价层电子的排布式为
(2)第四周期元素的第一电离能随原子序数增大,总趋势是逐渐增大的,但Ga的第一电离能明显低于Zn,原因是
(3)NO
 与钴盐形成的配离子[Co(NO2)6]3−可用于检验 K+的存在。与NO
与钴盐形成的配离子[Co(NO2)6]3−可用于检验 K+的存在。与NO 互为等电子体的微粒
互为等电子体的微粒a.σ键 b.π键 c.配位键 d.离子键 e.范德华力
(4)锰的一种配合物的化学式为 Mn(BH4)2(THF)3,BH
 的空间构型为
的空间构型为(5)FeO 是离子晶体,其晶格能可通过图中的 Born—Haber 循环计算得到。

可知,O=O的键能为
(6)铜与氧可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(1/2,1/2,1/2),则 d 点的坐标参数为

您最近半年使用:0次
解答题-无机推断题
|
较易
(0.85)
解题方法
【推荐3】下表为长式周期表的一部分,编号代表对应元素。
回答下列问题:
(1)基态原子⑨核外电子排布式为____ ,核外电子总共有___ 种运动状态,电子占据的能最量高轨道的形状为__ 。
(2)在标号的主族元素中,第一电离能最小的是__ (填元素符号,下同),电负性最大的是__ 。
(3)表中元素⑪三价离子的价电子轨道表示式为____ ,该元素属于____ 区元素。
(4)④、⑧元素的简单氢化物为NH3、PH3,请对比沸点:NH3______ PH3,水溶性:NH3_______ PH3(填“<”、“>”或“=”)。
(5)由元素①⑤⑨可组成化合物HClO,O原子的杂化轨道类型为______ 。
(6)元素①⑦能形成阴离子[AlH4]-,其空间构型为______ 。
| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ||||||||||||||
| ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||||||||||||
| ⑪ |
(1)基态原子⑨核外电子排布式为
(2)在标号的主族元素中,第一电离能最小的是
(3)表中元素⑪三价离子的价电子轨道表示式为
(4)④、⑧元素的简单氢化物为NH3、PH3,请对比沸点:NH3
(5)由元素①⑤⑨可组成化合物HClO,O原子的杂化轨道类型为
(6)元素①⑦能形成阴离子[AlH4]-,其空间构型为
您最近半年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
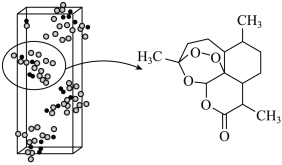
【推荐1】青蒿素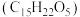 是治疗疟疾的有效药物,白色针状晶体,溶于乙醇和乙醚,对热不稳定。青蒿素晶胞(长方体,含4个青蒿素分子)及分子结构如下图所示。
是治疗疟疾的有效药物,白色针状晶体,溶于乙醇和乙醚,对热不稳定。青蒿素晶胞(长方体,含4个青蒿素分子)及分子结构如下图所示。
(1)提取青蒿素:在浸取、蒸馏过程中,发现用沸点比乙醇低的乙醚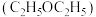 提取,效果更好。
提取,效果更好。
①乙醚沸点低于乙醇,原因是___________ 。
②用乙醚提取效果更好,原因是___________ 。
(2)确定结构
①测量晶胞中各处电子云密度大小,可确定原子的位置、种类。比较青蒿素分子中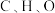 的原子核附近电子云密度大小:
的原子核附近电子云密度大小:___________ 。
②图中晶胞的棱长分别为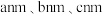 ,晶体的密度为
,晶体的密度为___________  。(用
。(用 表示阿伏加德罗常数;
表示阿伏加德罗常数; ;青蒿素的相对分子质量为282)
;青蒿素的相对分子质量为282)
③能确定晶体中哪些原子间存在化学键、并能确定键长和键角,从而得出分子空间结构的一种方法是___________ 。
a.质谱法 b.X射线衍射 c.核磁共振氢谱 d.红外光谱
(3)修饰结构,提高疗效:一定条件下,用 将青蒿素选择性还原生成双氢青蒿素。
将青蒿素选择性还原生成双氢青蒿素。
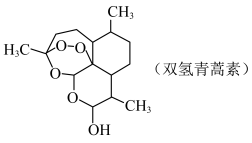
①双氢青蒿素分子中碳原子的杂化方式为___________ 。
② 的空间结构为
的空间结构为___________ ,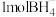 中有
中有___________  配位键。
配位键。
③比较水溶性:双氢青蒿素___________ (填“ ”)青蒿素。
”)青蒿素。
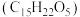 是治疗疟疾的有效药物,白色针状晶体,溶于乙醇和乙醚,对热不稳定。青蒿素晶胞(长方体,含4个青蒿素分子)及分子结构如下图所示。
是治疗疟疾的有效药物,白色针状晶体,溶于乙醇和乙醚,对热不稳定。青蒿素晶胞(长方体,含4个青蒿素分子)及分子结构如下图所示。
(1)提取青蒿素:在浸取、蒸馏过程中,发现用沸点比乙醇低的乙醚
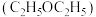 提取,效果更好。
提取,效果更好。①乙醚沸点低于乙醇,原因是
②用乙醚提取效果更好,原因是
(2)确定结构
①测量晶胞中各处电子云密度大小,可确定原子的位置、种类。比较青蒿素分子中
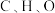 的原子核附近电子云密度大小:
的原子核附近电子云密度大小:②图中晶胞的棱长分别为
 ,晶体的密度为
,晶体的密度为 。(用
。(用 表示阿伏加德罗常数;
表示阿伏加德罗常数; ;青蒿素的相对分子质量为282)
;青蒿素的相对分子质量为282)③能确定晶体中哪些原子间存在化学键、并能确定键长和键角,从而得出分子空间结构的一种方法是
a.质谱法 b.X射线衍射 c.核磁共振氢谱 d.红外光谱
(3)修饰结构,提高疗效:一定条件下,用
 将青蒿素选择性还原生成双氢青蒿素。
将青蒿素选择性还原生成双氢青蒿素。
①双氢青蒿素分子中碳原子的杂化方式为
②
 的空间结构为
的空间结构为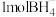 中有
中有 配位键。
配位键。③比较水溶性:双氢青蒿素
 ”)青蒿素。
”)青蒿素。
您最近半年使用:0次
【推荐2】锰酸锂( )是锂电池的正极材料,有望取代
)是锂电池的正极材料,有望取代 。一种以废旧电池正极材料(主要成分为
。一种以废旧电池正极材料(主要成分为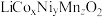 ,其中Co为+3价,还含少量铝箔、炭黑和有机黏合剂)为原料制备
,其中Co为+3价,还含少量铝箔、炭黑和有机黏合剂)为原料制备 的流程如下:
的流程如下:
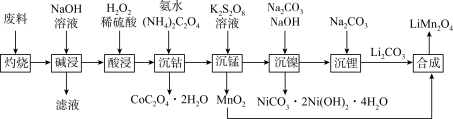
回答下列问题:
(1)Ni位于元素周期表中___________ 区。
(2) 的结构为:
的结构为: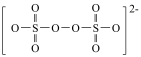 ,用“□”圈出
,用“□”圈出 中体现强氧化性的基团
中体现强氧化性的基团___________ 。
(3)“灼烧”的目的是除去___________ 、___________ 。
(4)根据“酸浸”前后物质价态的变化,推测双氧水发生反应的产物是___________ 。
(5)“沉锰”过程中,溶液先变为紫红色,一段时间后紫红色褪去。已知:加入 溶液之前,锰以
溶液之前,锰以 形式存在且溶液为弱酸性。则溶液变为紫红色的原因是
形式存在且溶液为弱酸性。则溶液变为紫红色的原因是___________ (用离子方程式表示)。由流程推测,“紫红色褪去”后,还可观察到的实验现象是___________ 。
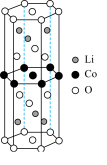
(6) 材料在脱锂过程中形成的某种晶体为六方晶系,结构如图。晶胞Li、Co、O的个数比为
材料在脱锂过程中形成的某种晶体为六方晶系,结构如图。晶胞Li、Co、O的个数比为___________ 。
 )是锂电池的正极材料,有望取代
)是锂电池的正极材料,有望取代 。一种以废旧电池正极材料(主要成分为
。一种以废旧电池正极材料(主要成分为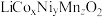 ,其中Co为+3价,还含少量铝箔、炭黑和有机黏合剂)为原料制备
,其中Co为+3价,还含少量铝箔、炭黑和有机黏合剂)为原料制备 的流程如下:
的流程如下:
回答下列问题:
(1)Ni位于元素周期表中
(2)
 的结构为:
的结构为: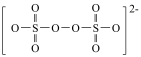 ,用“□”圈出
,用“□”圈出 中体现强氧化性的基团
中体现强氧化性的基团(3)“灼烧”的目的是除去
(4)根据“酸浸”前后物质价态的变化,推测双氧水发生反应的产物是
(5)“沉锰”过程中,溶液先变为紫红色,一段时间后紫红色褪去。已知:加入
 溶液之前,锰以
溶液之前,锰以 形式存在且溶液为弱酸性。则溶液变为紫红色的原因是
形式存在且溶液为弱酸性。则溶液变为紫红色的原因是(6)
 材料在脱锂过程中形成的某种晶体为六方晶系,结构如图。晶胞Li、Co、O的个数比为
材料在脱锂过程中形成的某种晶体为六方晶系,结构如图。晶胞Li、Co、O的个数比为
您最近半年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐3】硅烷广泛应用在现代高科技领域。制备硅烷的反应为:SiF4+NaAlH4=SiH4+NaAlF4.
(1)①基态硅原子的价层电子轨道表示式为_____ ,基态硅原子的电子有_____ 种空间运动状态。
②SiF4中,硅的化合价为+4价。硅显正化合价的原因是_____ 。
③下列说法正确的是_____ (填字母)。
a.SiH4的稳定性比CH4的差
b.SiH4中4个Si-H的键长相同,H-Si-H的键角为90°
c.SiH4中硅原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个Si-Hσ键
④SiF4的沸点(-86℃)高于SiH4的沸点(-112℃),原因是_____ 。
⑤键角:SiF4_____ SiH4,原因_____ 。
(2)NaAlH4的晶胞结构如图所示,晶胞的体积为a2b×10-21cm3。
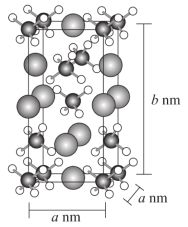
①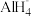 的VSEPR模型名称为
的VSEPR模型名称为_____ 。
②用NA表示阿伏加德罗常数的值。NaAlH4晶体密度为_____ g•cm-3(用含a、b、NA的代数式表示)。
③NaAlH4是一种具有应用潜能的储氢材料,其释氢过程可用化学方程式表示为:3NaAlH4═Na3AlH6+2Al+3H2↑。掺杂22Ti替换晶体中部分Al,更利于NaAlH4中H的解离,使体系更容易释放氢。从结构的角度推测其可能的原因:_____ 。
(1)①基态硅原子的价层电子轨道表示式为
②SiF4中,硅的化合价为+4价。硅显正化合价的原因是
③下列说法正确的是
a.SiH4的稳定性比CH4的差
b.SiH4中4个Si-H的键长相同,H-Si-H的键角为90°
c.SiH4中硅原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个Si-Hσ键
④SiF4的沸点(-86℃)高于SiH4的沸点(-112℃),原因是
⑤键角:SiF4
(2)NaAlH4的晶胞结构如图所示,晶胞的体积为a2b×10-21cm3。

①
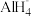 的VSEPR模型名称为
的VSEPR模型名称为②用NA表示阿伏加德罗常数的值。NaAlH4晶体密度为
③NaAlH4是一种具有应用潜能的储氢材料,其释氢过程可用化学方程式表示为:3NaAlH4═Na3AlH6+2Al+3H2↑。掺杂22Ti替换晶体中部分Al,更利于NaAlH4中H的解离,使体系更容易释放氢。从结构的角度推测其可能的原因:
您最近半年使用:0次



