名校
1 . 工业上用C还原 可得半导体材料
可得半导体材料 和
和 。下列说法正确的是
。下列说法正确的是
 可得半导体材料
可得半导体材料 和
和 。下列说法正确的是
。下列说法正确的是A.原子半径大小: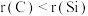 |
B.键能大小: |
C.电负性大小: |
D.酸性强弱: |
您最近半年使用:0次
名校
2 . 工业上以CO2和NH3为原料合成尿素,在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g) H2NCOONH4(s)(氨基甲酸铵) ΔH1=-272kJ·mol -1
H2NCOONH4(s)(氨基甲酸铵) ΔH1=-272kJ·mol -1
反应Ⅱ:H2NCOONH4(s) CO(NH2)2(s)+H2O(g) ΔH2=+138kJ·mol-1;
CO(NH2)2(s)+H2O(g) ΔH2=+138kJ·mol-1;
总反应Ⅲ:2NH3(g)+CO2(g) CO(NH2)2(s)+H2O(g) ∆H3
CO(NH2)2(s)+H2O(g) ∆H3
(1)反应Ⅰ的熵变ΔS___________  填“
填“ ”“
”“ ”或“
”或“ ”
” 。反应Ⅲ的
。反应Ⅲ的 H3=
H3=___________ ,反应Ⅲ自发进行的条件是___________ (填“低温”、“高温”、“任何温度”)。
(2)下列关于尿素合成的说法正确的是___________。
(3)1mol CO(NH2)2(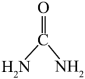 )中含有
)中含有___________ molπ键。NH 离子的VSEPR模型是
离子的VSEPR模型是___________ ,空间构型是___________ 。
(4)对于尿素分子中N、O两种基态原子,下列说法正确的是___________。
反应Ⅰ:2NH3(g)+CO2(g)
 H2NCOONH4(s)(氨基甲酸铵) ΔH1=-272kJ·mol -1
H2NCOONH4(s)(氨基甲酸铵) ΔH1=-272kJ·mol -1反应Ⅱ:H2NCOONH4(s)
 CO(NH2)2(s)+H2O(g) ΔH2=+138kJ·mol-1;
CO(NH2)2(s)+H2O(g) ΔH2=+138kJ·mol-1;总反应Ⅲ:2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g) ∆H3
CO(NH2)2(s)+H2O(g) ∆H3(1)反应Ⅰ的熵变ΔS
 填“
填“ ”“
”“ ”或“
”或“ ”
” 。反应Ⅲ的
。反应Ⅲ的 H3=
H3=(2)下列关于尿素合成的说法正确的是___________。
| A.及时分离出尿素可促使反应Ⅱ向正反应方向移动 |
| B.从合成塔出来的混合气体分离出水蒸气后其余气体可以循环使用 |
| C.保持容积不变,充入惰性气体增大压强,可提高总反应Ⅲ的反应速率 |
| D.保持压强不变,降低氨碳比[n(NH3)/n(CO2)]可提高反应Ⅰ中NH3的平衡转化率 |
 )中含有
)中含有 离子的VSEPR模型是
离子的VSEPR模型是(4)对于尿素分子中N、O两种基态原子,下列说法正确的是___________。
| A.N的半径较小 | B.N的未成对电子数较多 |
| C.N的电负性较大 | D.N的第一电离能较高 |
您最近半年使用:0次
名校
3 . 下列关于物质结构和性质的说法正确的是
A.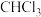 的球棍模型为 的球棍模型为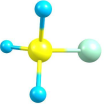 |
B.二氯化二硫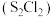 的电子式为 的电子式为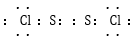 |
C. 的 的 模型与空间结构名称均为正四面体形 模型与空间结构名称均为正四面体形 |
D.酸性: |
您最近半年使用:0次
名校
解题方法
4 . 我国科学家首次在实验室实现从 到淀粉的全合成,其合成路线如图所示:
到淀粉的全合成,其合成路线如图所示:
 到淀粉的全合成,其合成路线如图所示:
到淀粉的全合成,其合成路线如图所示: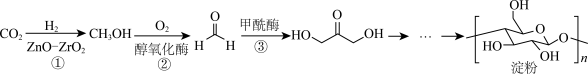
A.电负性: |
| B.人工合成淀粉为“碳中和”提供了新途径 |
C. 分子中的碳原子杂化方式各不相同 分子中的碳原子杂化方式各不相同 |
D.甲醇分子中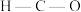 键角大于甲醛分子中 键角大于甲醛分子中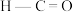 键角 键角 |
您最近半年使用:0次
解题方法
5 . X、Y、Z、W、Q为原子半径依次增大的短周期主族元素,基态Y原子核外电子排布的L层中只有两对成对电子,基态W原子核外s能级和p能级电子数相等,基态Z原子核外电子的空间运动状态数比基态W原子多2。下列说法一定正确的是
| A.第一电离能:W>Z>Q |
| B.Q与X形成的化合物一定是离子化合物 |
| C.工业上通过电解W和Y形成的化合物来制得W单质 |
| D.元素电负性:X>Y>Z |
您最近半年使用:0次
6 . 某元素基态原子的电子排布式为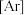
 。下列描述中,正确的是
。下列描述中,正确的是
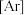
 。下列描述中,正确的是
。下列描述中,正确的是| A.该元素的电负性比溴元素的电负性大 |
| B.该元素位于元素周期表VA族 |
| C.4p能级上的3个电子能量相等,但自旋状态不同 |
| D.该元素的原子有5个价电子 |
您最近半年使用:0次
解题方法
7 . 某离子液体结构如图所示。W、X、Y、Z原子序数依次增大,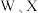 和
和 的原子序数之和为
的原子序数之和为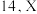 和
和 基态原子的核外未成对电子数之和为
基态原子的核外未成对电子数之和为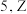 是第四周期元素。下列说法不正确的是
是第四周期元素。下列说法不正确的是
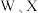 和
和 的原子序数之和为
的原子序数之和为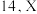 和
和 基态原子的核外未成对电子数之和为
基态原子的核外未成对电子数之和为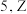 是第四周期元素。下列说法不正确的是
是第四周期元素。下列说法不正确的是
A.该物质的熔点低于 |
B.电负性: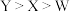 |
| C.W、Y、Z可形成既含离子键又含共价键的化合物 |
| D.已知阳离子环与苯环的结构相似,则环上的两个Y原子的杂化方式不同 |
您最近半年使用:0次
解题方法
8 . 某多孔储氢材料前驱体结构如图,M、W、X、Y、Z五种元素原子序数依次增大,基态Z原子的电子填充了3个能级,其中有2个未成对电子。下列说法正确的是

| A.氢化物沸点:X>Y | B.电负性:W<X<Y<Z |
| C.第一电离能:W<X<Y<Z | D.原子半径:M<X<Y<Z |
您最近半年使用:0次
解题方法
9 . 钛、钒、铬、铁、镍、铜等过渡金属及其化合物在工业上有重要用途。
(1)钛铁合金具有放氢温度低、价格适中等优点,是钛系储氢合金的代表。
①基态 原子价层电子排布式为
原子价层电子排布式为___________ 。
②基态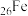 原子核外电子的运动状态有
原子核外电子的运动状态有___________ 种。
(2)Ti的四卤化物熔点如下表所示,自 至
至 熔点依次升高,原因是
熔点依次升高,原因是___________ 。
(3)制备 的反应为
的反应为 。
。
①上述化学方程式中非金属元素电负性由小到大的顺序为___________ (用元素符号表示)。
② 分子中所有原子均满足8电子稳定结构,
分子中所有原子均满足8电子稳定结构, 分子中π键和σ键的个数比为
分子中π键和σ键的个数比为___________ ,中心原子的杂化方式为___________ 。
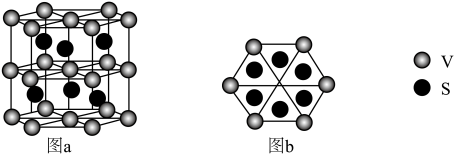
(4)一种钒的硫化物的晶体结构(图a)及其俯视图(图b)如图所示:___________ 。
②该钒的硫化物的晶体中,与每V原子最近且等距S原子的个数是___________ 。
③能准确证明该钒的硫化物是晶体的最可靠的科学方法是___________ 。
(1)钛铁合金具有放氢温度低、价格适中等优点,是钛系储氢合金的代表。
①基态
 原子价层电子排布式为
原子价层电子排布式为②基态
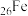 原子核外电子的运动状态有
原子核外电子的运动状态有(2)Ti的四卤化物熔点如下表所示,自
 至
至 熔点依次升高,原因是
熔点依次升高,原因是| 化合物 |  |  |  |
| 熔点/℃ | -24.12 | 38.3 | 155 |
(3)制备
 的反应为
的反应为 。
。①上述化学方程式中非金属元素电负性由小到大的顺序为
②
 分子中所有原子均满足8电子稳定结构,
分子中所有原子均满足8电子稳定结构, 分子中π键和σ键的个数比为
分子中π键和σ键的个数比为(4)一种钒的硫化物的晶体结构(图a)及其俯视图(图b)如图所示:
②该钒的硫化物的晶体中,与每V原子最近且等距S原子的个数是
③能准确证明该钒的硫化物是晶体的最可靠的科学方法是
您最近半年使用:0次
解题方法
10 . 氨硼烷 含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。氨硼烷在催化剂作用下水解放出氢气:
含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。氨硼烷在催化剂作用下水解放出氢气: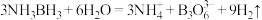 ,
, 的结构如图。下列说法正确的是
的结构如图。下列说法正确的是
 含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。氨硼烷在催化剂作用下水解放出氢气:
含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。氨硼烷在催化剂作用下水解放出氢气: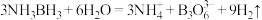 ,
, 的结构如图。下列说法正确的是
的结构如图。下列说法正确的是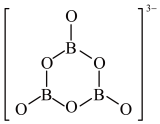
| A.基态B原子电子占据最高能级的电子云轮廓图为球形 |
| B.第一电离能:O>N>B |
| C.原子半径:N>B>H |
D. 中各原子均在同一平面内 中各原子均在同一平面内 |
您最近半年使用:0次



