1 . 下列关于元素或物质性质的比较中,不正确 的是
A.稳定性: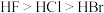 | B.第一电离能: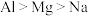 |
C.酸性: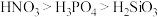 | D.电负性: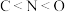 |
您最近半年使用:0次
解题方法
2 . 现有10种元素,其中X、Y、Z、A、E为短周期主族元素,原子序数依次增大;M、R、Q为第4周期元素。X元素原子的核外电子只有一种自旋取向;Y的基态原子核外2个能级上有电子,且每个能级上的电子数相等;Z原子核外有6种运动状态不同的电子。A元素原子核外s能级上的电子总数与p能级上的电子总数相等,但第一电离能都低于同周期相邻元素;E元素原子半径在同周期元素中最大;M是第四周期最外层只有一个电子的元素中原子序数最大的。R的3价阳离子遇KSCN溶液显红色。Q是ds区元素,基态原子核外7个能级上的电子均充满。请根据相关信息回答问题。
(1)Y、Z、A、E四种元素电负性由大到小的顺序:___________ (填元素符号)。Y、Z、A、E四种元素原子半径由大到小的顺序:___________ (填元素符号)。
(2)R元素的基态原子的电子排布式___________ ,占据最高能级电子的电子云轮廓图为___________ 形。Q在周期表中位于第四周期第___________ 族。
(3)X与Z形成的化合物的相对分子质量是26,其分子中σ键与π键的数目之比为___________ 。
(4)Y的氧化物与E的氢氧化物发生化学反应的离子方程式:___________ 。
(5)E在火焰上灼烧产生的黄光是一种___________ 光谱(填“发射”“吸收”)。
(6)从结构角度看,R2+易被氧化成R3+的原因是___________ 。
(7)过渡元素的金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为d0或d10排布时,无颜色,为d1~d9排布时,有颜色,如[R(H2O)6]3+显棕黄色。据此判断,[Q(H2O)4]2+___________ (填“无”或“有”)颜色。
(1)Y、Z、A、E四种元素电负性由大到小的顺序:
(2)R元素的基态原子的电子排布式
(3)X与Z形成的化合物的相对分子质量是26,其分子中σ键与π键的数目之比为
(4)Y的氧化物与E的氢氧化物发生化学反应的离子方程式:
(5)E在火焰上灼烧产生的黄光是一种
(6)从结构角度看,R2+易被氧化成R3+的原因是
(7)过渡元素的金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为d0或d10排布时,无颜色,为d1~d9排布时,有颜色,如[R(H2O)6]3+显棕黄色。据此判断,[Q(H2O)4]2+
您最近半年使用:0次
3 . 回答下列问题:
(1)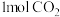 中含有的
中含有的 键数目为
键数目为___________ , 键数目为
键数目为___________ 。
(2)已知CO和 与
与 结构相似,CO分子内
结构相似,CO分子内 键与
键与 键个数之比为
键个数之比为___________ 。 分子中
分子中 键与
键与 键数目之比为
键数目之比为___________ 。
(3)肼 分子可视为
分子可视为 分子中的一个氢原子被
分子中的一个氢原子被 (氨基)取代形成的另一种氮的氢化物。肼可用作火箭燃料,燃烧时发生的反应:
(氨基)取代形成的另一种氮的氢化物。肼可用作火箭燃料,燃烧时发生的反应:
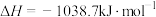 ,若该反应中有
,若该反应中有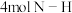 键断裂,则形成的
键断裂,则形成的 键有
键有___________ mol。
(4)Co基态原子核外电子排布式为___________ ; 的价电子轨道表示式为
的价电子轨道表示式为___________ ; 核外电子未成对电子数为
核外电子未成对电子数为___________ 。
(5) 、
、 、
、 、
、 分子中共价键的极性由强到弱的顺序是
分子中共价键的极性由强到弱的顺序是___________ 。
(1)
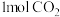 中含有的
中含有的 键数目为
键数目为 键数目为
键数目为(2)已知CO和
 与
与 结构相似,CO分子内
结构相似,CO分子内 键与
键与 键个数之比为
键个数之比为 分子中
分子中 键与
键与 键数目之比为
键数目之比为(3)肼
 分子可视为
分子可视为 分子中的一个氢原子被
分子中的一个氢原子被 (氨基)取代形成的另一种氮的氢化物。肼可用作火箭燃料,燃烧时发生的反应:
(氨基)取代形成的另一种氮的氢化物。肼可用作火箭燃料,燃烧时发生的反应:
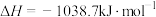 ,若该反应中有
,若该反应中有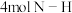 键断裂,则形成的
键断裂,则形成的 键有
键有(4)Co基态原子核外电子排布式为
 的价电子轨道表示式为
的价电子轨道表示式为 核外电子未成对电子数为
核外电子未成对电子数为(5)
 、
、 、
、 、
、 分子中共价键的极性由强到弱的顺序是
分子中共价键的极性由强到弱的顺序是
您最近半年使用:0次
4 . 消毒液的主要成分为NaClO,现按要求回答下列问题:
(1)消毒液的组成元素中,基态O原子的价电子排布式是___________ ,基态Cl原子未成对电子数为___________ 个。
(2)医用酒精主要成分为C2H5OH,其分子中碳原子的杂化方式为___________ ,组成元素电负性大小顺序为___________ ,1mol C2H5OH分子中含有σ键数目为___________ 。
(3)干冰升华时克服的作用力是___________。
(4)H2O2也可以做消毒液,其电子式为___________ ,利用所学试着解释为什么H2O2难溶于CS2?___________
(1)消毒液的组成元素中,基态O原子的价电子排布式是
(2)医用酒精主要成分为C2H5OH,其分子中碳原子的杂化方式为
(3)干冰升华时克服的作用力是___________。
| A.离子键 | B.共价键 | C.氢键 | D.范德华力 |
您最近半年使用:0次
名校
解题方法
5 . 元素周期表有多种形式。如图分别是两种不同形式元素周期表的局部区域。_______ (选填“金属性”或“非金属性”)越大。
②根据图甲中的信息判断,下列物质中含有离子键的是_______ 。
A.AlF3 B.AlCl3 C.Al2O3 D.Al2S3
(2)①图乙所示第二周期元素中,某一元素的该性质反常偏高,原因是_______ 。
②若将下列元素在图乙中排列,位置最低的元素是_______ 。
A.Na B.K C.Mg D.Ca
(3)图丙表示含义的是元素_______ 。
(4)①图中能正确表示基态N原子轨道表示式的是_______ 。_______ 。
A.能量最低原理 B.泡利原理 C.洪特规则
③基态N原子核外电子共有_______ 种不同的运动状态。
(5)同压下,部分氟化物的熔点见表:
①NaF、MgF2的熔点存在差异的原因是________ 。
②SiF4的熔点明显低于NaF、MgF2,原因是________ 。
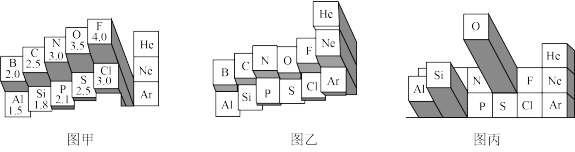
②根据图甲中的信息判断,下列物质中含有离子键的是
A.AlF3 B.AlCl3 C.Al2O3 D.Al2S3
(2)①图乙所示第二周期元素中,某一元素的该性质反常偏高,原因是
②若将下列元素在图乙中排列,位置最低的元素是
A.Na B.K C.Mg D.Ca
(3)图丙表示含义的是元素
| A.原子半径 | B.第一电离能 | C.电负性 | D.在地壳中的含量 |
(4)①图中能正确表示基态N原子轨道表示式的是
A.  B.
B.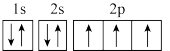
A.能量最低原理 B.泡利原理 C.洪特规则
③基态N原子核外电子共有
(5)同压下,部分氟化物的熔点见表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/℃ | 1266 | 1534 | 183 |
②SiF4的熔点明显低于NaF、MgF2,原因是
您最近半年使用:0次
名校
解题方法
6 . 铁和硒都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用。乙烷硒啉(Ethaselen)是一种抗癌新药,其结构如下:
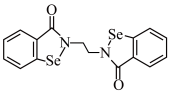
(1)基态Se原子的核外电子排布式为[Ar]_______ ,其核外有_______ 种不同能量的电子;该新药分子中的H被1个Cl取代,其可能的产物有_______ 种。
(2)在对电子运动状态的描述中,确定1个“轨道”的方面包括_______。
①电子层 ②电子云形状 ③电子云的伸展方向 ④电子的自旋
(3)比较键角大小:气态SeO3分子_______  离子(填“>”“<”或“=”)。
离子(填“>”“<”或“=”)。
(4)过渡元素离子一般能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+中提供电子对形成配位键的原子或离子是_______ 。
(5)富马酸亚铁FeC4H2O4是一种补铁剂。富马酸分子的结构模型如下图所示:

富马酸分子中σ键与π键的数目比为___ ,富马酸亚铁中各元素的电负性由大到小的顺序为___

(1)基态Se原子的核外电子排布式为[Ar]
(2)在对电子运动状态的描述中,确定1个“轨道”的方面包括_______。
①电子层 ②电子云形状 ③电子云的伸展方向 ④电子的自旋
| A.①②③④ | B.①②③ | C.①② | D.① |
 离子(填“>”“<”或“=”)。
离子(填“>”“<”或“=”)。(4)过渡元素离子一般能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+中提供电子对形成配位键的原子或离子是
(5)富马酸亚铁FeC4H2O4是一种补铁剂。富马酸分子的结构模型如下图所示:

富马酸分子中σ键与π键的数目比为
您最近半年使用:0次
名校
解题方法
7 . 新冠肺炎疫情防控,消毒用品必不可少。试回答下列问题:
(1)过氧乙酸(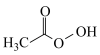 )也是一种常用消毒剂。在过氧乙酸中碳原子的杂化方式有
)也是一种常用消毒剂。在过氧乙酸中碳原子的杂化方式有___________ ,分子中 键和
键和 键的个数比为
键的个数比为___________ 。
(2)生活中常用的手消毒凝胶,其主要有效成分是三氮羟基二苯醚和乙醇,其中三氯羟基二苯醚是一种广谱抗菌剂,高效、安全。三氯羟基二苯醚的结构简式如图所示。

①组成三氯羟基二苯醚的四种元素H、C、O、Cl的电负性从大到小的顺序为___________ ;基态氯原子的价电子排布图为___________ ,最高能级的原子轨道电子云轮廓图形状为___________ 。
②三氯羟基二苯醚的熔点:55~57℃,沸点:120℃,常态为白色或灰白色晶状粉末,稍有酚臭味,不溶于水,易溶于碱液和有机溶剂,三氯羟基二苯醚属于___________ 晶体。
③乙醇与甲醚 的分子式相同,但二者的沸点分别为78.4℃、-24.8℃,乙醇沸点高于甲醚的原因是
的分子式相同,但二者的沸点分别为78.4℃、-24.8℃,乙醇沸点高于甲醚的原因是___________ 。
(3)Na、K等活泼金属在 中燃烧得到的
中燃烧得到的 、
、 具有强氧化性,也常做消毒剂。已知
具有强氧化性,也常做消毒剂。已知 的晶胞如图所示:
的晶胞如图所示:
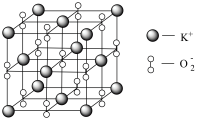
设阿伏加德罗常数的值为 ,晶胞的参数为a nm。晶胞的密度为
,晶胞的参数为a nm。晶胞的密度为___________  (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
(1)过氧乙酸(
 )也是一种常用消毒剂。在过氧乙酸中碳原子的杂化方式有
)也是一种常用消毒剂。在过氧乙酸中碳原子的杂化方式有 键和
键和 键的个数比为
键的个数比为(2)生活中常用的手消毒凝胶,其主要有效成分是三氮羟基二苯醚和乙醇,其中三氯羟基二苯醚是一种广谱抗菌剂,高效、安全。三氯羟基二苯醚的结构简式如图所示。

①组成三氯羟基二苯醚的四种元素H、C、O、Cl的电负性从大到小的顺序为
②三氯羟基二苯醚的熔点:55~57℃,沸点:120℃,常态为白色或灰白色晶状粉末,稍有酚臭味,不溶于水,易溶于碱液和有机溶剂,三氯羟基二苯醚属于
③乙醇与甲醚
 的分子式相同,但二者的沸点分别为78.4℃、-24.8℃,乙醇沸点高于甲醚的原因是
的分子式相同,但二者的沸点分别为78.4℃、-24.8℃,乙醇沸点高于甲醚的原因是(3)Na、K等活泼金属在
 中燃烧得到的
中燃烧得到的 、
、 具有强氧化性,也常做消毒剂。已知
具有强氧化性,也常做消毒剂。已知 的晶胞如图所示:
的晶胞如图所示:
设阿伏加德罗常数的值为
 ,晶胞的参数为a nm。晶胞的密度为
,晶胞的参数为a nm。晶胞的密度为 (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
您最近半年使用:0次
名校
8 . 光学性能优良的高分子材料聚础酸异山梨醇酯可由如下反应制备。
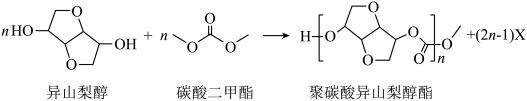
下列说法错误的是
| A.涉及元素的电负性:H<C<O | B.异山梨醇分子中有4个手性碳 |
| C.反应式中化合物X为甲醇 | D.异山梨醇中所有碳原子共平面 |
您最近半年使用:0次
9 . 现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大。基态A元素原子的价电子排布式为 ;C元素为最活泼的非金属元素;D元素原子核外有三个电子层,最外层电子数是核外电子总数的
;C元素为最活泼的非金属元素;D元素原子核外有三个电子层,最外层电子数是核外电子总数的 ;E元素正三价离子的3d轨道为半充满状态;F元素基态的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
;E元素正三价离子的3d轨道为半充满状态;F元素基态的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
(1)A元素的第一电离能
(2)基态D元素原子的价电子排布式为
(3)基态C元素原子的电子排布图为
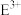 的离子符号为
的离子符号为(4)F元素位于元素周期表的
(5)G元素可能的性质是______(填字母)。
| A.其单质可作为半导体材料 | B.其电负性大于磷 |
| C.其原子半径大于锗 | D.其第一电离能小于硒 |
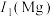
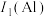 ,其原因是
,其原因是
您最近半年使用:0次
2024-03-26更新
|
60次组卷
|
2卷引用:山东省枣庄薛城实验中学等校2023-2023学年高二上学期12月大联考化学试题
解题方法
10 . 如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述,正确的是
| X | |||
| W | Y | R | |
| Z |
| A.W元素的第一电离能小于Y元素的第一电离能 |
| B.Y、Z的阴离子电子层结构都与R原子的相同 |
| C.p能级未成对电子最多的是W元素 |
| D.X元素是电负性最大的元素 |
您最近半年使用:0次
2024-03-26更新
|
25次组卷
|
2卷引用:山东省枣庄薛城实验中学等校2023-2023学年高二上学期12月大联考化学试题



