解题方法
1 . 石灰氮( )是一种新型氮肥,与土壤中的
)是一种新型氮肥,与土壤中的 反应生成氰胺(
反应生成氰胺( ),氰胺可进一步转化为尿素[
),氰胺可进一步转化为尿素[ ]。下列说法正确的是
]。下列说法正确的是
 )是一种新型氮肥,与土壤中的
)是一种新型氮肥,与土壤中的 反应生成氰胺(
反应生成氰胺( ),氰胺可进一步转化为尿素[
),氰胺可进一步转化为尿素[ ]。下列说法正确的是
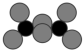
]。下列说法正确的是A. 和 和 空间构型相同,键角: 空间构型相同,键角: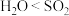 |
B. 为非极性分子 为非极性分子 |
C.中子数为20的钙原子可表示为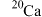 |
D. 分子中各元素的电负性大小关系为 分子中各元素的电负性大小关系为 |
您最近半年使用:0次
名校
解题方法
2 . 含硒(Se)化合物在材料药物领域有重要应用。
(1)Se与S同族,基态Se原子的简化电子排布式为___________ ,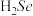 的沸点高于
的沸点高于 ,原因是
,原因是___________ 。
(2)一种含硒的新型 (聚集诱导发光)分子Ⅳ的合成路线如下,下列关于路线中I~Ⅳ的说法正确的有___________。
(聚集诱导发光)分子Ⅳ的合成路线如下,下列关于路线中I~Ⅳ的说法正确的有___________。
(3)硒的两种含氧酸的酸性强弱为
___________  (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠 可减轻重金属铊(
可减轻重金属铊( )引起的中毒,
)引起的中毒, 的空间结构为
的空间结构为___________ 。
(4)铊( )与
)与 同族,第一电离能
同族,第一电离能
___________  (填“>”或“<”)。
(填“>”或“<”)。
(5)根据下表中元素的电负性数值判断, 为
为___________ (填“离子化合物”或“共价化合物”,下同), 为
为___________ 。
(6)气态 通常以二聚体
通常以二聚体 的形式存在,其空间结构如图a所示,二聚体中
的形式存在,其空间结构如图a所示,二聚体中 的轨道杂化类型为
的轨道杂化类型为___________ 。 结构如图b所示,若晶胞参数(立方体棱长)为
结构如图b所示,若晶胞参数(立方体棱长)为 ,则晶体密度
,则晶体密度
___________  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
(1)Se与S同族,基态Se原子的简化电子排布式为
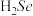 的沸点高于
的沸点高于 ,原因是
,原因是(2)一种含硒的新型
 (聚集诱导发光)分子Ⅳ的合成路线如下,下列关于路线中I~Ⅳ的说法正确的有___________。
(聚集诱导发光)分子Ⅳ的合成路线如下,下列关于路线中I~Ⅳ的说法正确的有___________。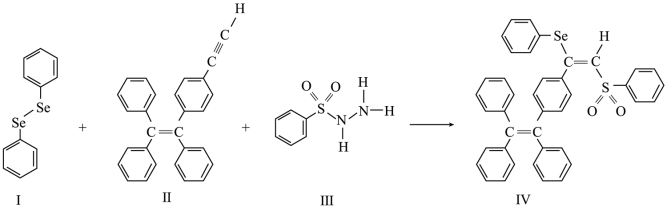
A.Ⅰ中含有两种元素, 键为非极性键 键为非极性键 |
B.Ⅱ中C原子的杂化轨道类型有 与 与 |
| C.Ⅲ中含有的元素中,O的电负性最大 |
D.Ⅳ中 原子的杂化轨道类型为 原子的杂化轨道类型为 |
(3)硒的两种含氧酸的酸性强弱为

 (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠 可减轻重金属铊(
可减轻重金属铊( )引起的中毒,
)引起的中毒, 的空间结构为
的空间结构为(4)铊(
 )与
)与 同族,第一电离能
同族,第一电离能
 (填“>”或“<”)。
(填“>”或“<”)。(5)根据下表中元素的电负性数值判断,
 为
为 为
为| 元素 | F |  |  |
| 电负性 | 4.0 | 1.5 | 3.0 |
(6)气态
 通常以二聚体
通常以二聚体 的形式存在,其空间结构如图a所示,二聚体中
的形式存在,其空间结构如图a所示,二聚体中 的轨道杂化类型为
的轨道杂化类型为 结构如图b所示,若晶胞参数(立方体棱长)为
结构如图b所示,若晶胞参数(立方体棱长)为 ,则晶体密度
,则晶体密度
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
|
|
| 图a | 图b |
您最近半年使用:0次
解题方法
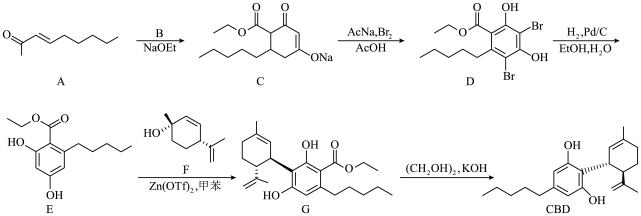
3 . 大麻二酚(CBD)具有降血糖、抗肿瘤、抗焦虑等多种生物活性。以下是CBD在医药工业上的一种合成路线,回答下列问题。___________ 。
(2)B的结构为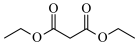 ,其化学名称是
,其化学名称是___________ ;D中含氧官能团的名称是___________ 。
(3)写出由E生成G的化学方程式___________ ,该反应类型为___________ 。
(4)已知X和A具有不同的官能团,其相对分子质量比A小14,同时满足如下条件的X的同分异构体Y共有___________ 种。(不考虑立体异构)
①1molY能与2mol[Ag(NH3)2]OH反应;②含有六元碳环。
满足上述条件的同分异构体中,只含有一个手性碳原子的Z是___________ (写出结构简式)。
(5)已知:R-CN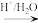 R-COOH.设计以Z与HCN为原料合成
R-COOH.设计以Z与HCN为原料合成 的路线(用流程图表示,其他无机试剂自选):
的路线(用流程图表示,其他无机试剂自选):___________ 。
(2)B的结构为
 ,其化学名称是
,其化学名称是(3)写出由E生成G的化学方程式
(4)已知X和A具有不同的官能团,其相对分子质量比A小14,同时满足如下条件的X的同分异构体Y共有
①1molY能与2mol[Ag(NH3)2]OH反应;②含有六元碳环。
满足上述条件的同分异构体中,只含有一个手性碳原子的Z是
(5)已知:R-CN
 R-COOH.设计以Z与HCN为原料合成
R-COOH.设计以Z与HCN为原料合成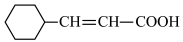 的路线(用流程图表示,其他无机试剂自选):
的路线(用流程图表示,其他无机试剂自选):
您最近半年使用:0次
4 . 短周期元素可形成许多结构和性质不同的化合物,回答下列问题:

(1) 是一种甲基化试剂,能发生水解反应
是一种甲基化试剂,能发生水解反应 ;
; 的水解产物为
的水解产物为_____ (填化学式)。
(2) 是共价化合物,可以形成二聚体和多聚体
是共价化合物,可以形成二聚体和多聚体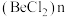 ,二聚体中
,二聚体中 的杂化方式为
的杂化方式为 ,二聚体的结构式为
,二聚体的结构式为_____ 。
(3)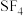 分子的电子对空间构型为三角双锥,排布方式有两种,结构如图。根据价层电子对互斥理论中:“孤电子对一成键电子对”分布在互成
分子的电子对空间构型为三角双锥,排布方式有两种,结构如图。根据价层电子对互斥理论中:“孤电子对一成键电子对”分布在互成 的方向上时斥力最大,判断
的方向上时斥力最大,判断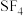 应采用结构
应采用结构_____ (填“a”或“b”)。
(4) 在水溶液中显蓝色,加入过量的氨水后变为深蓝色,原因是生成了
在水溶液中显蓝色,加入过量的氨水后变为深蓝色,原因是生成了_____ (填化学式),比较它与 的稳定性并说明理由
的稳定性并说明理由_____ 。
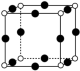
(5)在超高压下,金属钠和氦可形成化合物。结构中的钠离子按简单立方排布,形成 立方体空隙如图,电子对
立方体空隙如图,电子对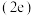 和氦原子交替分布填充在立方体的中心。若将氦原子放在晶胞顶点,则电子对
和氦原子交替分布填充在立方体的中心。若将氦原子放在晶胞顶点,则电子对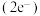 在该晶胞中的所有分数坐标除了
在该晶胞中的所有分数坐标除了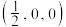 、
、 ,还有
,还有_____ ;若晶体的密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,晶胞的边长
,晶胞的边长
_____  (用含
(用含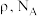 的代数式表示)。
的代数式表示)。


(1)
 是一种甲基化试剂,能发生水解反应
是一种甲基化试剂,能发生水解反应 ;
; 的水解产物为
的水解产物为(2)
 是共价化合物,可以形成二聚体和多聚体
是共价化合物,可以形成二聚体和多聚体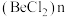 ,二聚体中
,二聚体中 的杂化方式为
的杂化方式为 ,二聚体的结构式为
,二聚体的结构式为(3)
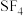 分子的电子对空间构型为三角双锥,排布方式有两种,结构如图。根据价层电子对互斥理论中:“孤电子对一成键电子对”分布在互成
分子的电子对空间构型为三角双锥,排布方式有两种,结构如图。根据价层电子对互斥理论中:“孤电子对一成键电子对”分布在互成 的方向上时斥力最大,判断
的方向上时斥力最大,判断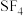 应采用结构
应采用结构(4)
 在水溶液中显蓝色,加入过量的氨水后变为深蓝色,原因是生成了
在水溶液中显蓝色,加入过量的氨水后变为深蓝色,原因是生成了 的稳定性并说明理由
的稳定性并说明理由(5)在超高压下,金属钠和氦可形成化合物。结构中的钠离子按简单立方排布,形成
 立方体空隙如图,电子对
立方体空隙如图,电子对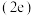 和氦原子交替分布填充在立方体的中心。若将氦原子放在晶胞顶点,则电子对
和氦原子交替分布填充在立方体的中心。若将氦原子放在晶胞顶点,则电子对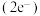 在该晶胞中的所有分数坐标除了
在该晶胞中的所有分数坐标除了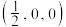 、
、 ,还有
,还有 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,晶胞的边长
,晶胞的边长
 (用含
(用含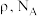 的代数式表示)。
的代数式表示)。
您最近半年使用:0次
5 . 褪黑素是迄今发现的最强的内源性自由基清除剂。褪黑素的基本功能就是参与抗氧化系统,防止细胞产生氧化损伤,在这方面,它的功效超过了已知的所有体内物质。某研究小组以乙炔为原料,设计合成褪黑素,合成路线如下(部分反应条件已省略):

已知:无水乙酸钠在碱石灰作用下发生反应:
回答下列问题:
(1)B→C的反应类型为___________ ,C中含氧官能团的名称为___________ ,C分子是否为手性分子:___________ (填“是”或“否”)。
(2)已知: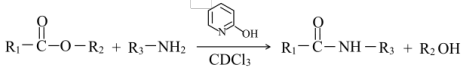 ,通常用酯基和氨基生成酰胺基,不用羧基和氨基直接反应,结合成键元素间
,通常用酯基和氨基生成酰胺基,不用羧基和氨基直接反应,结合成键元素间电负性差值大小 解释原因___________ 。
(3)E→F过程中,反应i的化学方程式为:___________ 。
(4)J的结构简式为___________ ,其中氮原子的杂化轨道类型为___________ 。
(5)写出符合下列条件的H的一种同分异构体(不考虑立体异构)的结构简式___________ 。
i.含有3个六元环,其中1个是苯环;
ii.含有 结构,不含
结构,不含 键;
键;
iii.含有4种不同化学环境的氢原子。
(6)综合上述信息并结合所学知识,在下图方框中填写合适的物质(写结构简式)。①________ ;②_________ ;③___________ 。


已知:无水乙酸钠在碱石灰作用下发生反应:

回答下列问题:
(1)B→C的反应类型为
(2)已知:
 ,通常用酯基和氨基生成酰胺基,不用羧基和氨基直接反应,结合成键元素间
,通常用酯基和氨基生成酰胺基,不用羧基和氨基直接反应,结合成键元素间| 元素 | H | C | O |
| 电负性 | 2.1 | 2.5 | 3.5 |
(3)E→F过程中,反应i的化学方程式为:
(4)J的结构简式为
(5)写出符合下列条件的H的一种同分异构体(不考虑立体异构)的结构简式
i.含有3个六元环,其中1个是苯环;
ii.含有
 结构,不含
结构,不含 键;
键;iii.含有4种不同化学环境的氢原子。
(6)综合上述信息并结合所学知识,在下图方框中填写合适的物质(写结构简式)。①

您最近半年使用:0次
名校
解题方法
6 . X、Y、Z、M、Q、R是元素周期表中前四周期元素,且原子序数依次增大,其相关信息如表所示:
回答下列问题。
(1)X与Q的电负性大小顺序为___________ (用元素符号表示)。
(2)Y元素基态原子的简化电子排布式为___________ ;R元素基态原子的价层电子轨道表示式为___________ 。
(3)R元素可形成 和
和 ,其中较稳定的是
,其中较稳定的是 ,原因是
,原因是___________ 。
(4)Y、Z的电负性较大的是___________ (填元素符号)。
(5)与M元素成对角线规则关系的某短周期元素T的最高价氧化物的水化物具有两性,写出该两性物质与Z元素的最高价氧化物对应的水化物反应的离子方程式:___________ 。
| 元素 | 相关信息 |
| X | 原子核外有6种不同运动状态的电子 |
| Y | 基态原子中s电子总数与p电子总数相等 |
| Z | 原子半径在同周期主族元素中最大 |
| M | 逐级电离能(单位: )依次为578、1817、2745、11575、14830、18376、23293 )依次为578、1817、2745、11575、14830、18376、23293 |
| Q | 基态原子的核外电子占据5个能级,且最外层p轨道上有2个电子的自旋方向与其他电子的自旋方向相反 |
| R | 基态原子3d能级上有6个电子 |
(1)X与Q的电负性大小顺序为
(2)Y元素基态原子的简化电子排布式为
(3)R元素可形成
 和
和 ,其中较稳定的是
,其中较稳定的是 ,原因是
,原因是(4)Y、Z的电负性较大的是
(5)与M元素成对角线规则关系的某短周期元素T的最高价氧化物的水化物具有两性,写出该两性物质与Z元素的最高价氧化物对应的水化物反应的离子方程式:
您最近半年使用:0次
解题方法
7 . 含硼物质在生产生活中有着广泛应用。回答下列问题:
(1)基态硼原子的价电子轨道表示式是___________ ,最高能量的原子轨道的空间形状是___________ 。
(2)BN可以水解成硼酸(H3BO3)和NH3,B、N、O中,第一电离能最大的元素是___________ 。人工合成的一种BN晶体硬度已超过金刚石,是一种超硬材料,常用作刀具材料和磨料。可预测该BN晶体属于___________ 晶体。用___________ 法可以测得该晶体的结构,其中B的化合价为___________ ,请解释原因:___________ 。
(3)N-甲基咪唑的结构为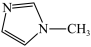 ,它的某种衍生物与NaBF4形成的离子化合物
,它的某种衍生物与NaBF4形成的离子化合物 是离子液体。离子液体是在室温和接近室温时呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。
是离子液体。离子液体是在室温和接近室温时呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。
①0.3 mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ热量,其热化学方程式为___________ ;
②氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一、以NaBH4为硼源、某配合物为氨源可用于制备氨硼烷。为测定该配合物的结构,取2.32 g配合物进行如下实验:用重量法分析金属元素,测得镍元素的质量为0.59 g;在碱性条件下加热蒸出NH3,用滴定法测出其物质的量为0.06 mol;滴加过量硝酸银溶液,有白色沉淀生成,加热,沉淀没有增加;用摩尔法分析含量,测得氯元素质量为0.71 g。
I.该配合物中镍离子的基态电子排布式为___________ 。
Ⅱ.该配合物的结构简式为___________ 。
(1)基态硼原子的价电子轨道表示式是
(2)BN可以水解成硼酸(H3BO3)和NH3,B、N、O中,第一电离能最大的元素是
(3)N-甲基咪唑的结构为
 ,它的某种衍生物与NaBF4形成的离子化合物
,它的某种衍生物与NaBF4形成的离子化合物 是离子液体。离子液体是在室温和接近室温时呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。
是离子液体。离子液体是在室温和接近室温时呈液态的盐类物质,由于其具有良好的化学稳定性,较低的熔点和良好的溶解性,应用越来越广泛。①1mol离子化合物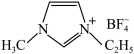 中,阿伏加德罗常数的值为NA,则根据价电子对互斥(VSEPR)理论,杂化方式为sp3的原子共有
中,阿伏加德罗常数的值为NA,则根据价电子对互斥(VSEPR)理论,杂化方式为sp3的原子共有 的电子式为
的电子式为
②离子化合物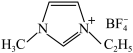 熔点低的原因是
熔点低的原因是
①0.3 mol气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ热量,其热化学方程式为
②氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一、以NaBH4为硼源、某配合物为氨源可用于制备氨硼烷。为测定该配合物的结构,取2.32 g配合物进行如下实验:用重量法分析金属元素,测得镍元素的质量为0.59 g;在碱性条件下加热蒸出NH3,用滴定法测出其物质的量为0.06 mol;滴加过量硝酸银溶液,有白色沉淀生成,加热,沉淀没有增加;用摩尔法分析含量,测得氯元素质量为0.71 g。
I.该配合物中镍离子的基态电子排布式为
Ⅱ.该配合物的结构简式为
您最近半年使用:0次
名校
解题方法
8 . 现有六种元素A、B、C、D、E,其中A、B、C、D、E为短周期主族元素,F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
(1)画出A元素基态原子的核外电子排布图___________ 。
(2)B元素的电负性___________ (填“大于”“小于”或“等于”)C元素的电负性。
(3)C与D形成的化合物所含有的化学键类型为___________ 。
(4)E基态原子中能量最高的电子,其电子云在空间有___________ 个方向。
(5)基态 核外电子排布式为
核外电子排布式为___________ ,过量单质F与B的最高价氧化物对应的水化物的稀溶液完全反应生成BC气体,该反应的离子方程式为___________ 。
| A元素形成的物质种类繁多,其形成的一种固体单质工业上常用作切割工具 |
B元素原子的核外 电子数比 电子数比 电子数少1 电子数少1 |
C元素基态原子 轨道有两个未成对电子 轨道有两个未成对电子 |
D元素原子的第一至第四电离能分别是: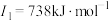 ; ; ; ;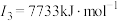 ; ;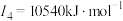 |
E原子核外所有 轨道全满或半满 轨道全满或半满 |
| F在周期表的第8纵列 |
(2)B元素的电负性
(3)C与D形成的化合物所含有的化学键类型为
(4)E基态原子中能量最高的电子,其电子云在空间有
(5)基态
 核外电子排布式为
核外电子排布式为
您最近半年使用:0次
9 . B、C、N、O、F是重要的非金属元素,在日常生活和化工生产中有广泛的应用。回答下列问题:
(1)C、N、O的第三电离能由大到小的顺序是_______ ,电负性由大到小的顺序是_______ 。
(2)三氟化硼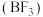 是一种无色气体,用于制造火箭的高能燃料。
是一种无色气体,用于制造火箭的高能燃料。 水解生成
水解生成 和另一种一元无氧酸(甲),甲中B的杂化方式是
和另一种一元无氧酸(甲),甲中B的杂化方式是 ,则甲的化学式是
,则甲的化学式是_______ 。
(3)已知: 中存在大π键:
中存在大π键: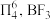 中
中 键的键能是
键的键能是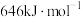 ,而
,而 中
中 键的键能仅
键的键能仅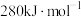 。
。 的分子构型是
的分子构型是_______ ; 中
中 键的键能大于
键的键能大于 中
中 键的键能的原因是
键的键能的原因是_______ 。
(4)亚肼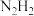 分子中四个原子在同一平面上,有两种结构:
分子中四个原子在同一平面上,有两种结构: 和
和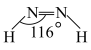 。试推测在水中的溶解度:
。试推测在水中的溶解度:
_______  (填“大于”或“小于”)。
(填“大于”或“小于”)。
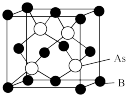
(5)超高热导率半导体材料一砷化硼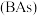 的晶胞结构如图所示,已知阿伏加德罗常数的值为
的晶胞结构如图所示,已知阿伏加德罗常数的值为 ,若该晶体的密度为
,若该晶体的密度为 ,则该晶胞中
,则该晶胞中 原子到B原子的最近距离为
原子到B原子的最近距离为_______  (列出含p、
(列出含p、 的计算式即可)。
的计算式即可)。
(1)C、N、O的第三电离能由大到小的顺序是
(2)三氟化硼
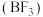 是一种无色气体,用于制造火箭的高能燃料。
是一种无色气体,用于制造火箭的高能燃料。 水解生成
水解生成 和另一种一元无氧酸(甲),甲中B的杂化方式是
和另一种一元无氧酸(甲),甲中B的杂化方式是 ,则甲的化学式是
,则甲的化学式是(3)已知:
 中存在大π键:
中存在大π键: 中
中 键的键能是
键的键能是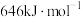 ,而
,而 中
中 键的键能仅
键的键能仅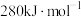 。
。 的分子构型是
的分子构型是 中
中 键的键能大于
键的键能大于 中
中 键的键能的原因是
键的键能的原因是(4)亚肼
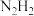 分子中四个原子在同一平面上,有两种结构:
分子中四个原子在同一平面上,有两种结构: 和
和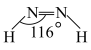 。试推测在水中的溶解度:
。试推测在水中的溶解度:
 (填“大于”或“小于”)。
(填“大于”或“小于”)。(5)超高热导率半导体材料一砷化硼
 的晶胞结构如图所示,已知阿伏加德罗常数的值为
的晶胞结构如图所示,已知阿伏加德罗常数的值为 ,若该晶体的密度为
,若该晶体的密度为 ,则该晶胞中
,则该晶胞中 原子到B原子的最近距离为
原子到B原子的最近距离为 (列出含p、
(列出含p、 的计算式即可)。
的计算式即可)。
您最近半年使用:0次
名校
解题方法
10 . 有机物K合成路线如下图 (部分条件已省略)。

已知:
①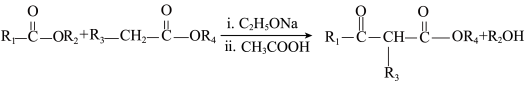
②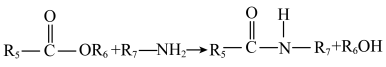 (
( 表示烃基)。
表示烃基)。
请回答下列问题。
(1)K的分子式为_______ 。
(2)A中官能团的名称是_______ ,G→H的反应类型是_______ 。
(3)B→D的化学方程式为_______ 。
(4)F→G中NaOH的作用是_______ 。
(5)D+H→J中形成酰胺键。在有机合成中常用酯基和 生成酰胺基,而不是用羧基和
生成酰胺基,而不是用羧基和 直接反应生成酰胺基,请结合元素电负性和键的极性解释原因:
直接反应生成酰胺基,请结合元素电负性和键的极性解释原因:_______ 。(元素电负性:H-2.1 C-2.5 O-3.5)
(6)由J生成K可以看作三步反应,如下图所示。

①P中有两个六元环结构。P的结构简式为_______ 。
②Q和K是互变异构关系,K比Q稳定的原因是_______ 。
(7)X是D的同分异构体,符合下列条件的X的结构简式是_______ 。
a.1molX能与足量银氨溶液反应生成4molAg
b.X中核磁共振氢谱中出现3组吸收峰,峰面积比为1:1:3

已知:
①
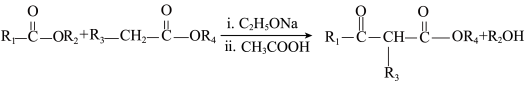
②
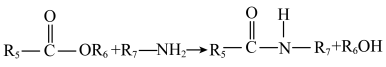 (
( 表示烃基)。
表示烃基)。请回答下列问题。
(1)K的分子式为
(2)A中官能团的名称是
(3)B→D的化学方程式为
(4)F→G中NaOH的作用是
(5)D+H→J中形成酰胺键。在有机合成中常用酯基和
 生成酰胺基,而不是用羧基和
生成酰胺基,而不是用羧基和 直接反应生成酰胺基,请结合元素电负性和键的极性解释原因:
直接反应生成酰胺基,请结合元素电负性和键的极性解释原因:(6)由J生成K可以看作三步反应,如下图所示。

①P中有两个六元环结构。P的结构简式为
②Q和K是互变异构关系,K比Q稳定的原因是
(7)X是D的同分异构体,符合下列条件的X的结构简式是
a.1molX能与足量银氨溶液反应生成4molAg
b.X中核磁共振氢谱中出现3组吸收峰,峰面积比为1:1:3
您最近半年使用:0次