9-10高一下·江苏南通·期中
1 . A.原子数相同、电子总数相同的分子,互称为等电子体。
Ⅰ.已知A、B、C、D和E五种分子所含原子的数目依次为1、2、3、6和6,且都含有18个电子,又知B、C和D是由两种元素的原子组成,且D分子中两种原子个数比为1 :2。
请回答:
(1)组成A分子的原子的元素符号是_______________ ;已知E是有毒的有机物,E的熔、沸点比CH4的熔、沸点高,其主要原因是____________________________________ 。
(2)C的立体结构呈_________ 形,该分子属于_____ 分子(填“极性”或“非极性”);
(3)火箭中可充入四氧化二氮和D作为燃料反应生成氮气和水,该反应的化学方程式为__________________________________________________________________ 。(不需要写反应条件)
Ⅱ.CO与N2互为等电子体。
(4)CO的总键能大于N2的总键能,但CO比N2容易参加化学反应。
根据下表数据,说明CO比N2活泼的原因是____________________________________ 。
(5)它们的分子中都包含___________ 个σ键,______________ 个π键。
(6)Fe、Co、Ni等金属能与CO反应的原因与这些金属原子的电子层结构有关。
Ni原子的价电子排布式为_________________________ 。Fe(CO)5常温下呈液态,熔点为
-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于__________ (填晶体类型);Fe(CO)5是配合物,配体是_____________________ 。
B.茶中含有多种有益于人体健康的成分,据测定茶叶中含有450种以上的有机成分与15种以上的元素。某化学研究小组欲探究茶叶中钙元素的含量,设计了探究实验方案如下:(已知茶叶中的铝、铁元素对钙离子的测定有影响)
步骤1:称取500g干燥的茶叶,置于通风橱中,充分灼烧使茶叶灰化,再用研钵磨细后移入烧杯中,然后将200mL 1 mol·L-1盐酸加入灰中搅拌、过滤、洗涤。
步骤2:向步骤1所得滤液中逐滴加入稀氢氧化钠溶液,调节溶液的pH至6~7左右,使铝、铁元素以氢氧化物的形式完全沉淀,再加热煮沸30 min,加入7.95g无水碳酸钠,充分搅拌,待沉淀完全后,过滤,洗涤,过滤后得到滤液和沉淀。
步骤3:将步骤2所得的滤液稀释至500 mL,取其中的20.00 mL溶液以甲基橙作指示剂,用0.100mol·L-1的HCl标准溶液滴定,终点时消耗盐酸的体积为20.00mL,计算结果。
请回答下列问题:
步骤 1中,使茶叶灰化时需要用到三角架、泥三角、酒精喷灯、_______ 、_______ 等仪器。
步骤2中,改用试剂____________________ (写试剂名称)来调节pH将更为方便;判断沉淀已经洗净的方法是____________________________________________________________ 。
步骤3中,滴定过程中,眼睛应注视______________________________________________________________ ,被滴定的20 mL滤液中含CO32-的物质的量为______________ mol,试计算原500g茶叶中钙离子的质量分数为_________________ ,计算过程如下:
Ⅰ.已知A、B、C、D和E五种分子所含原子的数目依次为1、2、3、6和6,且都含有18个电子,又知B、C和D是由两种元素的原子组成,且D分子中两种原子个数比为1 :2。
请回答:
(1)组成A分子的原子的元素符号是
(2)C的立体结构呈
(3)火箭中可充入四氧化二氮和D作为燃料反应生成氮气和水,该反应的化学方程式为
Ⅱ.CO与N2互为等电子体。
(4)CO的总键能大于N2的总键能,但CO比N2容易参加化学反应。
根据下表数据,说明CO比N2活泼的原因是
| A-B | A=B | A≡B | ||
| CO | 键能(kJ/mol) | 357.7 | 798.9 | 1071.9 |
| 键能差值kJ/mol) | 441.2 273 | |||
| N2 | 键能(kJ/mol) | 154.8 | 418.4 | 941.7 |
| 键能差值kJ/mol) | 263.6 523.3 | |||
(5)它们的分子中都包含
(6)Fe、Co、Ni等金属能与CO反应的原因与这些金属原子的电子层结构有关。
Ni原子的价电子排布式为
-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于
B.茶中含有多种有益于人体健康的成分,据测定茶叶中含有450种以上的有机成分与15种以上的元素。某化学研究小组欲探究茶叶中钙元素的含量,设计了探究实验方案如下:(已知茶叶中的铝、铁元素对钙离子的测定有影响)
步骤1:称取500g干燥的茶叶,置于通风橱中,充分灼烧使茶叶灰化,再用研钵磨细后移入烧杯中,然后将200mL 1 mol·L-1盐酸加入灰中搅拌、过滤、洗涤。
步骤2:向步骤1所得滤液中逐滴加入稀氢氧化钠溶液,调节溶液的pH至6~7左右,使铝、铁元素以氢氧化物的形式完全沉淀,再加热煮沸30 min,加入7.95g无水碳酸钠,充分搅拌,待沉淀完全后,过滤,洗涤,过滤后得到滤液和沉淀。
步骤3:将步骤2所得的滤液稀释至500 mL,取其中的20.00 mL溶液以甲基橙作指示剂,用0.100mol·L-1的HCl标准溶液滴定,终点时消耗盐酸的体积为20.00mL,计算结果。
请回答下列问题:
步骤 1中,使茶叶灰化时需要用到三角架、泥三角、酒精喷灯、
步骤2中,改用试剂
步骤3中,滴定过程中,眼睛应注视
您最近半年使用:0次
名校
解题方法
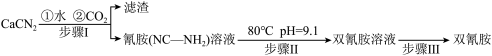
2 . 双氰胺( )为白色晶体,在冷水中溶解度较小,溶于热水、乙醇,其水溶液在80℃以上会发生分解等副反应,主要用于生产树脂、涂料、含氮复合肥等。实验室以石灰氮
)为白色晶体,在冷水中溶解度较小,溶于热水、乙醇,其水溶液在80℃以上会发生分解等副反应,主要用于生产树脂、涂料、含氮复合肥等。实验室以石灰氮 为原料制备双氰胺的流程如下:
为原料制备双氰胺的流程如下:
已知氰胺二聚反应机理为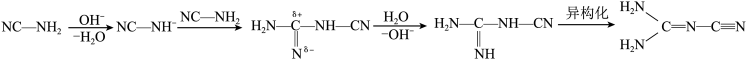
(1)已知:氰基是吸电子基团。氰氨
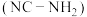 的碱性
的碱性(2)写出步骤Ⅰ的化学反应方程式:
(3)步骤Ⅱ中调节溶液pH为9.1,pH不能过低的原因:
(4)步骤Ⅲ中蒸发浓缩时,常采用真空蒸发浓缩,目的是
(5)凯氏定氮法是测定有机物中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐。
已知:
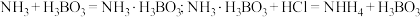

②仪器清洗后,g中加入硼酸
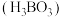 和指示剂。铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭
和指示剂。铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭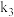 ,d中保留少量水。打开
,d中保留少量水。打开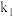 ,加热b,使水蒸气进入e。
,加热b,使水蒸气进入e。d中保留少量水的目的是
③取双氰胺样品m克进行测定,滴定g中吸收液时消耗浓度为
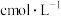 的盐酸VmL,则样品中氮的质量分数为
的盐酸VmL,则样品中氮的质量分数为
您最近半年使用:0次
3 . 一种从废钼钴催化剂中回收有价金属的工艺流程如图甲所示:
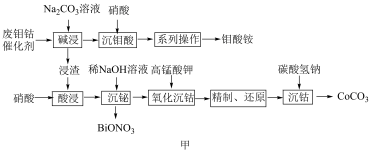
已知:I.废钼钴催化剂的主要成分如表。
II.“酸浸”所得溶液中主要含有H+、Bi3+、Co2+等阳离子。
回答下列问题:
(1)钼酸铵 中Mo元素的化合价为
中Mo元素的化合价为_______ ,其所含非金属元素的电负性由大到小排序为_______ 。
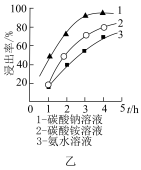
(2)“碱浸”时需在75℃条件下进行反应,且选择不同碱性试剂钼元素的浸出率随时间变化如图乙所示。则“碱浸”时的最佳条件为_______ 。
(3)“沉钼酸”时,一般控制反应温度为60℃,温度不宜太高的原因为_______ 。
(4)“沉铋”时,反应的离子方程式为_______ 。
(5)“氧化沉钴”时调节溶液 ,反应生成
,反应生成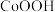 和
和 ,其离子方程式为
,其离子方程式为_______ 。
(6)若通过该流程处理1kg废钼钴催化剂,得到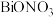 的质量为0.1435kg,则Bi元素的回收率最接近
的质量为0.1435kg,则Bi元素的回收率最接近_____ (填标号)(Bi元素的回收率 )。
)。
A.70% B.80% C.90%

已知:I.废钼钴催化剂的主要成分如表。
| 主要成分 |  |  |  |
| 质量分数 | 44.61% | 6.67% | 13.98% |
回答下列问题:
(1)钼酸铵
 中Mo元素的化合价为
中Mo元素的化合价为(2)“碱浸”时需在75℃条件下进行反应,且选择不同碱性试剂钼元素的浸出率随时间变化如图乙所示。则“碱浸”时的最佳条件为

(3)“沉钼酸”时,一般控制反应温度为60℃,温度不宜太高的原因为
(4)“沉铋”时,反应的离子方程式为
(5)“氧化沉钴”时调节溶液
 ,反应生成
,反应生成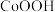 和
和 ,其离子方程式为
,其离子方程式为(6)若通过该流程处理1kg废钼钴催化剂,得到
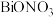 的质量为0.1435kg,则Bi元素的回收率最接近
的质量为0.1435kg,则Bi元素的回收率最接近 )。
)。A.70% B.80% C.90%
您最近半年使用:0次
名校
解题方法
4 . 三氯化铬( )在工业上主要用作媒染剂和催化剂,
)在工业上主要用作媒染剂和催化剂, 常用于颜料、陶瓷、橡胶等工业,实验室模拟工业上以BaCrO4为原料制备
常用于颜料、陶瓷、橡胶等工业,实验室模拟工业上以BaCrO4为原料制备 和
和 。
。
(1)三价铬离子能形成多种配位化合物,配合物[Cr(NH3)3(H2O)2Cl]2+中元素电负性由大到小的顺序___________ 。
(2)制备 。取一定质量的BaCrO4和对应量的水加入到三颈瓶中,水浴加热并搅拌,一段时间后同时加入过量浓盐酸和无水乙醇充分反应,生成
。取一定质量的BaCrO4和对应量的水加入到三颈瓶中,水浴加热并搅拌,一段时间后同时加入过量浓盐酸和无水乙醇充分反应,生成 并放出
并放出 气体。
气体。
①上述反应的化学方程式为___________ 。
②上述反应中的乙醇与BaCrO4投料的物质的量比例大约为3:8,原因是___________ 。
(3)测定 的质量分数。
的质量分数。
Ⅰ.称取样品0.3300g,加水溶解并配成250.0mL的溶液。
Ⅱ.移取25.00mL样品溶液于带塞的锥形瓶中,加热至沸后加入稍过量的 ,稀释并加热煮沸,再加入过量的硫酸酸化,将
,稀释并加热煮沸,再加入过量的硫酸酸化,将 氧化为
氧化为 ;再加入过量KI固体加塞摇匀,使铬完全以
;再加入过量KI固体加塞摇匀,使铬完全以 的形式存在。
的形式存在。
Ⅲ.加入1mL淀粉溶液,用0.0250 标准
标准 溶液滴定至终点,平行测定3次,平均消耗标准
溶液滴定至终点,平行测定3次,平均消耗标准 溶液24.00mL。
溶液24.00mL。
已知反应: (未配平) ;
(未配平) ; (未配平)
(未配平)
①滴定终点的现象是___________ 。
②计算 的质量分数(写出计算过程)
的质量分数(写出计算过程)___________ 。
(4)制备 。Cr(Ⅲ )的存在形态的物质的量分数随溶液pH的分布如图所示。
。Cr(Ⅲ )的存在形态的物质的量分数随溶液pH的分布如图所示。

请补充完整由 溶液制备
溶液制备 的实验方案:取适量
的实验方案:取适量 溶液,
溶液,___________ ,低温烘干,得到 晶体(实验中须使用的试剂:1
晶体(实验中须使用的试剂:1 NaOH溶液、0.1
NaOH溶液、0.1
 溶液、0.1
溶液、0.1
 溶液、蒸馏水)。
溶液、蒸馏水)。
 )在工业上主要用作媒染剂和催化剂,
)在工业上主要用作媒染剂和催化剂, 常用于颜料、陶瓷、橡胶等工业,实验室模拟工业上以BaCrO4为原料制备
常用于颜料、陶瓷、橡胶等工业,实验室模拟工业上以BaCrO4为原料制备 和
和 。
。(1)三价铬离子能形成多种配位化合物,配合物[Cr(NH3)3(H2O)2Cl]2+中元素电负性由大到小的顺序
(2)制备
 。取一定质量的BaCrO4和对应量的水加入到三颈瓶中,水浴加热并搅拌,一段时间后同时加入过量浓盐酸和无水乙醇充分反应,生成
。取一定质量的BaCrO4和对应量的水加入到三颈瓶中,水浴加热并搅拌,一段时间后同时加入过量浓盐酸和无水乙醇充分反应,生成 并放出
并放出 气体。
气体。①上述反应的化学方程式为
②上述反应中的乙醇与BaCrO4投料的物质的量比例大约为3:8,原因是
(3)测定
 的质量分数。
的质量分数。Ⅰ.称取样品0.3300g,加水溶解并配成250.0mL的溶液。
Ⅱ.移取25.00mL样品溶液于带塞的锥形瓶中,加热至沸后加入稍过量的
 ,稀释并加热煮沸,再加入过量的硫酸酸化,将
,稀释并加热煮沸,再加入过量的硫酸酸化,将 氧化为
氧化为 ;再加入过量KI固体加塞摇匀,使铬完全以
;再加入过量KI固体加塞摇匀,使铬完全以 的形式存在。
的形式存在。Ⅲ.加入1mL淀粉溶液,用0.0250
 标准
标准 溶液滴定至终点,平行测定3次,平均消耗标准
溶液滴定至终点,平行测定3次,平均消耗标准 溶液24.00mL。
溶液24.00mL。已知反应:
 (未配平) ;
(未配平) ; (未配平)
(未配平)①滴定终点的现象是
②计算
 的质量分数(写出计算过程)
的质量分数(写出计算过程)(4)制备
 。Cr(Ⅲ )的存在形态的物质的量分数随溶液pH的分布如图所示。
。Cr(Ⅲ )的存在形态的物质的量分数随溶液pH的分布如图所示。
请补充完整由
 溶液制备
溶液制备 的实验方案:取适量
的实验方案:取适量 溶液,
溶液, 晶体(实验中须使用的试剂:1
晶体(实验中须使用的试剂:1 NaOH溶液、0.1
NaOH溶液、0.1
 溶液、0.1
溶液、0.1
 溶液、蒸馏水)。
溶液、蒸馏水)。
您最近半年使用:0次
名校
解题方法
5 . 有A、B、C、D四种主族元素,原子序数依次增大,A元素原子 轨道上有2个未成对电子。B元素原子的p轨道中有3个未成对电子,其简单气态氢化物在水中的溶解度在同族元素所形成的简单氢化物中最大。C的最高化合价和最低化合价的代数和为4,其最高价氧化物中含C的质量分数为40%,且其核内质子数等于中子数。D元素原子得一个电子填入
轨道上有2个未成对电子。B元素原子的p轨道中有3个未成对电子,其简单气态氢化物在水中的溶解度在同族元素所形成的简单氢化物中最大。C的最高化合价和最低化合价的代数和为4,其最高价氧化物中含C的质量分数为40%,且其核内质子数等于中子数。D元素原子得一个电子填入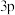 轨道后,
轨道后,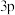 轨道为全充满状态。请回答下列问题:
轨道为全充满状态。请回答下列问题:
(1)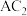 分子中含有
分子中含有___________ 个 键,属于
键,属于___________ (填“极性”或“非极性”)分子。
(2)B的简单气态氢化物的立体构型为___________ , 原子采用
原子采用___________ 杂化。
(3)写出 的常见氧化物与
的常见氧化物与 的氧化物中互为等电子体的一组物质:
的氧化物中互为等电子体的一组物质:___________ 。
(4)C元素的电负性___________ (填“>”“<”或“=”)D元素的电负性,用一个化学方程式表示:___________ 。
 轨道上有2个未成对电子。B元素原子的p轨道中有3个未成对电子,其简单气态氢化物在水中的溶解度在同族元素所形成的简单氢化物中最大。C的最高化合价和最低化合价的代数和为4,其最高价氧化物中含C的质量分数为40%,且其核内质子数等于中子数。D元素原子得一个电子填入
轨道上有2个未成对电子。B元素原子的p轨道中有3个未成对电子,其简单气态氢化物在水中的溶解度在同族元素所形成的简单氢化物中最大。C的最高化合价和最低化合价的代数和为4,其最高价氧化物中含C的质量分数为40%,且其核内质子数等于中子数。D元素原子得一个电子填入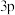 轨道后,
轨道后,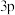 轨道为全充满状态。请回答下列问题:
轨道为全充满状态。请回答下列问题:(1)
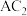 分子中含有
分子中含有 键,属于
键,属于(2)B的简单气态氢化物的立体构型为
 原子采用
原子采用(3)写出
 的常见氧化物与
的常见氧化物与 的氧化物中互为等电子体的一组物质:
的氧化物中互为等电子体的一组物质:(4)C元素的电负性
您最近半年使用:0次
2023-05-02更新
|
122次组卷
|
3卷引用:云南省盐津县第二中学2018-2019学年高二上学期12月份考试化学试题
6 . 已知A、B、C、D、E、F是原子序数依次增大的前四周期元素。其中A是宇宙中含量最多的元素;B元素原子最高能级的不同轨道都有电子,并且自旋方向相同;C元素原子的价层电子排布是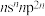 ;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其最外层电子数等于其能层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。
;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其最外层电子数等于其能层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。
(1)请用元素符号完成下列空白:
①A、B、C三种元素的电负性由大到小顺序为:___________ 。
②B、C、D、E 4种元素的第一电离能由大到小顺序为:___________ 。
(2)下面是A~F元素中某种元素的部分电离能,由此可判断该元素是___________ 。
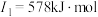
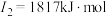
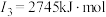
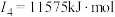
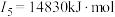
(3)F在周期表中的位置___________ ,位于周期表的___________ 区。
(4)BA3是一种很好的配体,BA3的沸点___________ (填“>”“=”或“<”)AsA3。
(5)B原子核外有___________ 种不同运动状态的电子;基态B原子中,能量最高的电子所占据的原子轨道的形状为___________ ;F原子核外电子占据的最高能层的符号是___________ 。
 ;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其最外层电子数等于其能层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。
;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其最外层电子数等于其能层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。(1)请用元素符号完成下列空白:
①A、B、C三种元素的电负性由大到小顺序为:
②B、C、D、E 4种元素的第一电离能由大到小顺序为:
(2)下面是A~F元素中某种元素的部分电离能,由此可判断该元素是
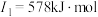
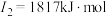
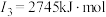
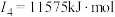
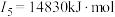
(3)F在周期表中的位置
(4)BA3是一种很好的配体,BA3的沸点
(5)B原子核外有
您最近半年使用:0次
名校
7 . 嫦娥5号月球探测器带回的月壤样品的元素分析结果如图,下列有关含量前六位元素的说法正确的是
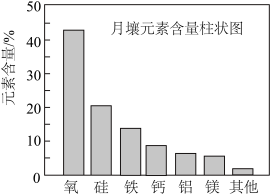
| A.基态Mg原子有6种能量不同的电子 | B.这六种元素中,电负性最大的是O |
| C.Ca原子核外有4种形状的原子轨道 | D.基态原子未成对电子数:Si<Al |
您最近半年使用:0次
名校
解题方法
8 . A、B、C、D、E、F、G、H是元素周期表前四周期常见元素,且原子序数依次增大,相关信息如下表:
请用化学用语填空:
(1)A元素在元素周期表中的位置___________ ;C元素和F元素的电负性比较,较小的是___________ (填元素符号)。
(2)B元素与宇宙中含量最丰富的元素形成的最简单化合物的电子式为___________ ,B元素所形成的单质分子中σ键与π键数目之比为___________ 。
(3)F元素原子的价电子的轨道表示式是___________ ;G的高价阳离子的溶液与H单质反应的离子方程式为___________ ;元素X与元素E在周期表中呈对角线关系,且元素X的最高价氧化物的水化物也具有两性,试写出X元素的最高价氧化物的水化物与D元素的最高价氧化物的水化物反应的化学方程式___________ 。
| 元素 | 元素相关信息 |
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 基态原子最外层电子排布式为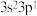 |
| F | 基态原子的最外层p轨道有两个电子的自旋方向与其他电子的自旋方向相反 |
| G | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
| H | 是我国使用最早的合金中的最主要元素 |
(1)A元素在元素周期表中的位置
(2)B元素与宇宙中含量最丰富的元素形成的最简单化合物的电子式为
(3)F元素原子的价电子的轨道表示式是
您最近半年使用:0次
名校
解题方法
9 . 前四周期元素X、Y、Z、W的原子序数依次增大,X原子中有6个运动状态不同的电子,Y是地壳中含量最多的元素,基态Z原子K、L层上的电子总数是3p原子轨道上电子数的两倍,基态W原子中有6个未成对电子。下列说法不正确的是
| A.电负性: X < Y,原子半径: X < Y |
| B.同周期中,除稀有气体外元素Z的第一电离能最大 |
| C.在一定条件下,X与氢元素形成的某些化合物与Z的单质及氢化物均能反应 |
D.在一定条件下,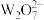 和 和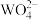 可以相互转化,且二者均具有强氧化性 可以相互转化,且二者均具有强氧化性 |
您最近半年使用:0次
名校
解题方法
10 . 元素周期表有多种形式。如图分别是两种不同形式元素周期表的局部区域。_______ (选填“金属性”或“非金属性”)越大。
②根据图甲中的信息判断,下列物质中含有离子键的是_______ 。
A.AlF3 B.AlCl3 C.Al2O3 D.Al2S3
(2)①图乙所示第二周期元素中,某一元素的该性质反常偏高,原因是_______ 。
②若将下列元素在图乙中排列,位置最低的元素是_______ 。
A.Na B.K C.Mg D.Ca
(3)图丙表示含义的是元素_______ 。
(4)①图中能正确表示基态N原子轨道表示式的是_______ 。_______ 。
A.能量最低原理 B.泡利原理 C.洪特规则
③基态N原子核外电子共有_______ 种不同的运动状态。
(5)同压下,部分氟化物的熔点见表:
①NaF、MgF2的熔点存在差异的原因是________ 。
②SiF4的熔点明显低于NaF、MgF2,原因是________ 。
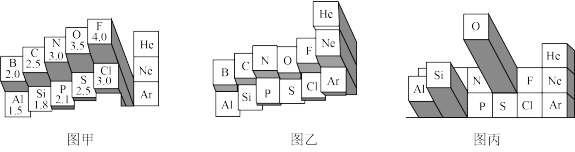
②根据图甲中的信息判断,下列物质中含有离子键的是
A.AlF3 B.AlCl3 C.Al2O3 D.Al2S3
(2)①图乙所示第二周期元素中,某一元素的该性质反常偏高,原因是
②若将下列元素在图乙中排列,位置最低的元素是
A.Na B.K C.Mg D.Ca
(3)图丙表示含义的是元素
| A.原子半径 | B.第一电离能 | C.电负性 | D.在地壳中的含量 |
(4)①图中能正确表示基态N原子轨道表示式的是
A.  B.
B.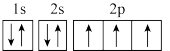
A.能量最低原理 B.泡利原理 C.洪特规则
③基态N原子核外电子共有
(5)同压下,部分氟化物的熔点见表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/℃ | 1266 | 1534 | 183 |
②SiF4的熔点明显低于NaF、MgF2,原因是
您最近半年使用:0次



