名校
1 . 已知冰醋酸能与 在
在 催化下发生反应生成
催化下发生反应生成 和HCl。对实验过程进行监测,发现反应过程中出现了C―I键,下列有关说法错误的是
和HCl。对实验过程进行监测,发现反应过程中出现了C―I键,下列有关说法错误的是
 在
在 催化下发生反应生成
催化下发生反应生成 和HCl。对实验过程进行监测,发现反应过程中出现了C―I键,下列有关说法错误的是
和HCl。对实验过程进行监测,发现反应过程中出现了C―I键,下列有关说法错误的是| A.实验中C―I键的产生,可通过红外光谱结果证明 |
B. 中存在 中存在 键 键 |
| C.C―I键比C―Cl键更易形成,且键能更大 |
D. 的酸性比 的酸性比 强 强 |
您最近半年使用:0次
名校
2 . 临床证明磷酸氯喹对治疗“新冠肺炎”有良好的疗效,磷酸氯喹的结构如图所示。下列有关磷酸氯喹的说法错误的是
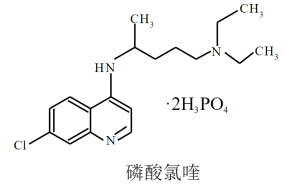

| A.磷酸氯喹既能与强酸、又能与强碱反应 |
| B.磷酸氯喹中C、N、O元素的电负性大小顺序是:N>O>C |
| C.磷酸氯喹中的N—H键的键能大于C—H键的键能 |
| D.磷酸氯喹结构中存在σ键、大π键等 |
您最近半年使用:0次
2022-07-14更新
|
471次组卷
|
2卷引用:辽宁省东北育才学校-辽宁省实验中学-大连24中-大连八中-鞍山一中五校2021-2022学年高二下学期期末联考化学试题
解题方法
3 . 临床证明磷酸氯喹对治疗“新冠肺炎”有良好的疗效,磷酸氯喹的结构如图所示。下列有关磷酸氯喹的说法错误的是
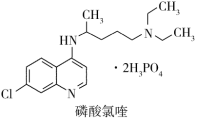

| A.磷酸氯喹中N、O、P元素的电负性:N>O>P |
| B.磷酸氯喹中N的杂化方式sp2、sp3 |
| C.磷酸氯喹中的N-H键的键能大于C-H键的键能 |
| D.磷酸氯喹结构中存在σ键、大π键等 |
您最近半年使用:0次
解题方法
4 . 钛、钒、铬、铁、镍、铜等过渡金属及其化合物在工业上有重要用途。
(1)钛铁合金具有放氢温度低、价格适中等优点,是钛系储氢合金的代表。
①基态 原子价层电子排布式为
原子价层电子排布式为___________ 。
②基态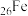 原子核外电子的运动状态有
原子核外电子的运动状态有___________ 种。
(2)Ti的四卤化物熔点如下表所示,自 至
至 熔点依次升高,原因是
熔点依次升高,原因是___________ 。
(3)制备 的反应为
的反应为 。
。
①上述化学方程式中非金属元素电负性由小到大的顺序为___________ (用元素符号表示)。
② 分子中所有原子均满足8电子稳定结构,
分子中所有原子均满足8电子稳定结构, 分子中π键和σ键的个数比为
分子中π键和σ键的个数比为___________ ,中心原子的杂化方式为___________ 。
(4)一种钒的硫化物的晶体结构(图a)及其俯视图(图b)如图所示:___________ 。
②该钒的硫化物的晶体中,与每V原子最近且等距S原子的个数是___________ 。
③能准确证明该钒的硫化物是晶体的最可靠的科学方法是___________ 。
(1)钛铁合金具有放氢温度低、价格适中等优点,是钛系储氢合金的代表。
①基态
 原子价层电子排布式为
原子价层电子排布式为②基态
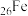 原子核外电子的运动状态有
原子核外电子的运动状态有(2)Ti的四卤化物熔点如下表所示,自
 至
至 熔点依次升高,原因是
熔点依次升高,原因是| 化合物 |  |  |  |
| 熔点/℃ | -24.12 | 38.3 | 155 |
(3)制备
 的反应为
的反应为 。
。①上述化学方程式中非金属元素电负性由小到大的顺序为
②
 分子中所有原子均满足8电子稳定结构,
分子中所有原子均满足8电子稳定结构, 分子中π键和σ键的个数比为
分子中π键和σ键的个数比为(4)一种钒的硫化物的晶体结构(图a)及其俯视图(图b)如图所示:
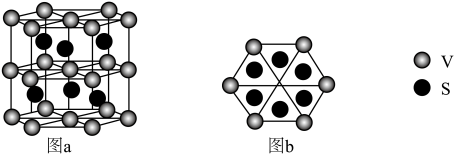
②该钒的硫化物的晶体中,与每V原子最近且等距S原子的个数是
③能准确证明该钒的硫化物是晶体的最可靠的科学方法是
您最近半年使用:0次
解题方法
5 . 氢、氮、硫、氯、铜是元素周期表中前四周期元素。回答下列问题:
(1)氮在元素周期表中的位置_____ 。写出 的电子式
的电子式_____ , 的分子空间构型为
的分子空间构型为_____ , 中心原子的杂化方式为
中心原子的杂化方式为_____ 。
(2)氯与硫相比,非金属性较强的是_____ (用元素符号表示),下列事实能证明这一结论的是_____ (填序号)。
a.常温下氯的单质呈气态,硫的单质呈固态 b.稳定性
c.酸性: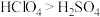 d.氯的电负性大于硫的电负性
d.氯的电负性大于硫的电负性
(3)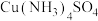 组成元素中,第一电离能最大的元素是
组成元素中,第一电离能最大的元素是_____ (用元素符号表示); 中含有
中含有 键数目为
键数目为_____ 。
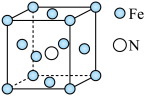
(4)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为_____ ;设晶胞边长为 ,该晶体的密度为
,该晶体的密度为_____  (用含a和
(用含a和 的式子表示)。
的式子表示)。
(1)氮在元素周期表中的位置
 的电子式
的电子式 的分子空间构型为
的分子空间构型为 中心原子的杂化方式为
中心原子的杂化方式为(2)氯与硫相比,非金属性较强的是
a.常温下氯的单质呈气态,硫的单质呈固态 b.稳定性

c.酸性:
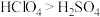 d.氯的电负性大于硫的电负性
d.氯的电负性大于硫的电负性(3)
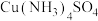 组成元素中,第一电离能最大的元素是
组成元素中,第一电离能最大的元素是 中含有
中含有 键数目为
键数目为(4)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图所示,则氮化铁的化学式为
 ,该晶体的密度为
,该晶体的密度为 (用含a和
(用含a和 的式子表示)。
的式子表示)。
您最近半年使用:0次
6 . W、X、Y、Z四种短周期元素的原子序数 。四种元素原子结构描述如下:
。四种元素原子结构描述如下:
(1)根据上述信息Z元素基态原子中能量最高的电子,其电子云在空间有___________ 个伸展方向,轨道呈___________ 形。
(2)元素W位于元素周期表的第___________ 周期第___________ 族,该原子的价电子轨道表示式为___________ 。
(3)Y、Z的电负性:___________ >___________ (填元素符号),两元素形成的化合物的电子式___________ 。
(4)X的基态原子核外电子排布式为___________ ,该元素位于元素周期表的___________ 区。
(5)下列事实能证明W的活泼性大于X的事实是___________。
 。四种元素原子结构描述如下:
。四种元素原子结构描述如下:| X | 原子核外s电子与p电子数之比为 |
| W | 原子的最外层没有p电子,且同周期中第一电离能最小 |
| Y | 原子最外层s电子与p电子数之比为 |
| Z | 原子核外电子中p电子数比Y原子多2个 |
(2)元素W位于元素周期表的第
(3)Y、Z的电负性:
(4)X的基态原子核外电子排布式为
(5)下列事实能证明W的活泼性大于X的事实是___________。
| A.W能与冷水反应,而X不能 | B.W最外层有一个电子,X最外层有两个电子 |
C.碱性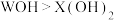 | D.W能从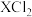 的溶液中把X置换出来 的溶液中把X置换出来 |
您最近半年使用:0次
2023高三·全国·专题练习
解题方法
7 . 一般认为:如果两个成键原子间的电负性差值大于1.7,原子之间通常形成离子键;如果两个成键原子间的电负性差值小于1.7,通常形成共价键。部分短周期元素的电负性数值如表所示:
(1)根据对角线规则,Be、Al元素最高价氧化物对应水化物的性质相似,它们都具有两性,其中Be(OH)2显示这种性质的离子方程式是___________ 。
(2)通过分析电负性数值变化规律,确定Mg元素电负性的最小范围:___________ 。
(3)请归纳元素的电负性和金属性、非金属性的关系:___________ 。
(4)从电负性角度,判断AlCl3是离子化合物还是共价化合物___________ ?请说出理由___________ ,并设计一个实验方案证明上述所得结论___________ 。
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| 电负性值 | 1.0 | 1.57 | 2.04 | 2.55 | 3.44 | 4.0 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(2)通过分析电负性数值变化规律,确定Mg元素电负性的最小范围:
(3)请归纳元素的电负性和金属性、非金属性的关系:
(4)从电负性角度,判断AlCl3是离子化合物还是共价化合物
您最近半年使用:0次
名校
解题方法
8 . A、B、C、D、E、F均是短周期元素,其原子序数依次增大,A和B同周期,A和E同主族,A原子最外层电子数是内层电子数的二倍,B元素族序数是周期数的三倍,B的阴离子与C、D的阳离子电子层结构相同,C与B可生成C2B或C2B2,D的阳离子半径是同周期最小的,F的原子半径是所在周期中最小的。请回答:
(1)E在元素周期表中的位置是_______ 。
(2)C所在周期电负性最强的是_______ ;AB2的结构式是_______ 。
(3)B、C、F的离子半径由大到小的顺序为_______ (用化学式回答,下同);A、D、E元素的最高价氧化物对应水化物中,酸性最强的是_______ 。
(4)B的简单氢化物比H2S沸点高的原因是_______ 。
(5)C与D两元素的最高价氧化物对应水化物反应的离子方程式:_______ 。
(6)用一个离子方程式证明A、E的非金属性强弱:_______ 。
(1)E在元素周期表中的位置是
(2)C所在周期电负性最强的是
(3)B、C、F的离子半径由大到小的顺序为
(4)B的简单氢化物比H2S沸点高的原因是
(5)C与D两元素的最高价氧化物对应水化物反应的离子方程式:
(6)用一个离子方程式证明A、E的非金属性强弱:
您最近半年使用:0次
9 . 已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L层上有2对成对电子;E+核外有3层电子且M层3d轨道电子全充满。请回答下列问题:
(1)A原子的核外电子的原子轨道有___________ 个伸展方向。
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为___________ (填元素符号)。
(3)E元素基态原子的电子排布式为___________ 。
(4)B2A4是重要的石油化工原料,其形成的高聚物的结构简式为___________ 。
(5)D元素与氟元素相比,电负性:D___________ (填“>”“=”或“<”)F,下列表述中能证明这一事实的是___________ (填字母)。
A.常温下氟气的颜色比D单质的颜色深
B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(6)以下原子的电子排布式不符合洪特规则的是___________。
(1)A原子的核外电子的原子轨道有
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为
(3)E元素基态原子的电子排布式为
(4)B2A4是重要的石油化工原料,其形成的高聚物的结构简式为
(5)D元素与氟元素相比,电负性:D
A.常温下氟气的颜色比D单质的颜色深
B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(6)以下原子的电子排布式不符合洪特规则的是___________。
| A.1s22s22p63s23p63d74s2 | B.1s22s22p63s23p63d44s2 |
| C.1s22s22p63s23p63d104s24p1 | D.某原子的外围电子的轨道表示式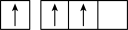 |
您最近半年使用:0次
10 . 元素周期表是学习、研究和应用化学的一种重要工具。如图为元素周期表前四周期的一部分,R、W、X、Y、Z代表五种元素,回答下列问题。
(1)基态R原子的电子排布式为______ 。
(2)W、X、Y三种元素的基态原子中,p能级未成对电子最多的是______ (填元素符号)。
(3)X、Z两种元素气态氢化物的稳定性:______ >______ (填化学式)。
(4)Y的第一电离能小于W的,结合价层电子排布式解释其原因_______ 。
(5)元素的电负性是元素的一种基本性质,下面给出10种元素的电负性。
已知:
i.通常两成键元素间电负性差值大于1.7时,形成离子键;两成键元素间电负性差值小于1.7时,形成共价键。
ii.在水等强极性溶剂中,成键原子电负性的差异是影响化学键断裂难易程度的原因之一。水化物M-O-H(M代表某种元素)结构中,成键原子电负性差异越大,所成化学键越容易断裂,电离出OH-或H+。
①通过分析电负性的变化规律,确定Mg元素电负性的最小范围______ 。
②下列物质属于离子化合物的是______ (填字母)。
a.BeCl2 b.Li3N c.HCl d.CCl4
③请设计实验方案证明②中你选出物质为离子化合物______ 。
④结合电负性数据,解释HClO水溶液显酸性而不显碱性的依据是______ 。
| X | |||
| W | Y | R | |
| Z |
(2)W、X、Y三种元素的基态原子中,p能级未成对电子最多的是
(3)X、Z两种元素气态氢化物的稳定性:
(4)Y的第一电离能小于W的,结合价层电子排布式解释其原因
(5)元素的电负性是元素的一种基本性质,下面给出10种元素的电负性。
| 元素 | Al | Be | Mg | C | Cl | Na | Li | N | Si | O | H |
| 电负性 | 1.5 | 1.5 | 2.5 | 3.0 | 0.9 | 1.0 | 3.0 | 1.8 | 3.5 | 2.1 |
i.通常两成键元素间电负性差值大于1.7时,形成离子键;两成键元素间电负性差值小于1.7时,形成共价键。
ii.在水等强极性溶剂中,成键原子电负性的差异是影响化学键断裂难易程度的原因之一。水化物M-O-H(M代表某种元素)结构中,成键原子电负性差异越大,所成化学键越容易断裂,电离出OH-或H+。
①通过分析电负性的变化规律,确定Mg元素电负性的最小范围
②下列物质属于离子化合物的是
a.BeCl2 b.Li3N c.HCl d.CCl4
③请设计实验方案证明②中你选出物质为离子化合物
④结合电负性数据,解释HClO水溶液显酸性而不显碱性的依据是
您最近半年使用:0次



