名校
1 . 三氯化铬(CrCl3)为紫色单斜晶体,熔点为83℃,易潮解,易升华,能溶于水但不易水解,高温下能被氧气氧化,工业上主要用作媒染剂和催化剂。
(1)某化学小组用Cr2O3和CCl4在高温下制备无水三氯化铬,部分实验装置如图所示,其中锥形瓶内装有CCl4,其沸点为76.8℃。
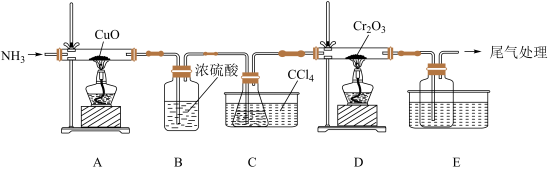
实验前先加热装置A,产生气体的化学方程式:___________ ,实验过程中需持续产生该气体,该气体的作用为___________ 。
(2)三价铬离子能形成多种配位化合物,配合物[Cr(NH3)3(H2O)2Cl]2+中元素电负性由大到小的顺序___________ 。
(3)装置D中还会生成光气(COCl2),D中反应的化学方程式为___________ 。
(4)该实验装置有设计不合理的地方,请写出改进方法:___________ (写一点即可)
(5)为进一步探究CrCl3的性质,某同学取试管若干支,分别加入10滴0.1 mol∙L−1 CrCl3溶液,并用4滴2 mol∙L−1 H2SO4酸化,再分别加入不同滴数的0.1 mol∙L−1KMnO4溶液,并在不同的温度下进行实验,反应现象记录于表中。
①浓度对反应的影响
CrCl3与KMnO4在常温下反应,观察不到Cr2O 离子的橙色,甲同学认为其中一个原因是Cr2O
离子的橙色,甲同学认为其中一个原因是Cr2O 离子的橙色被MnO
离子的橙色被MnO 离子的紫红色掩盖,另一种可能的原因是
离子的紫红色掩盖,另一种可能的原因是___________ ,所以必须将反应液加热至沸腾 后,才能观察到反应液由紫红色逐渐变为橙黄色的实验现象。
后,才能观察到反应液由紫红色逐渐变为橙黄色的实验现象。
②CrCl3与KMnO4的用量对反应的影响
对表中数据进行分析,在上述反应条件下,欲将Cr3+氧化为Cr2O ,CrCl3与KMnO4最佳用量比为
,CrCl3与KMnO4最佳用量比为___________ 。这与由反应10Cr3+ + 6MnO + 11H2O
+ 11H2O Cr2O
Cr2O + 6Mn2+ + 22H+ 所推断得到的用量比不符,你推测的原因是
+ 6Mn2+ + 22H+ 所推断得到的用量比不符,你推测的原因是___________ 。
(1)某化学小组用Cr2O3和CCl4在高温下制备无水三氯化铬,部分实验装置如图所示,其中锥形瓶内装有CCl4,其沸点为76.8℃。

实验前先加热装置A,产生气体的化学方程式:
(2)三价铬离子能形成多种配位化合物,配合物[Cr(NH3)3(H2O)2Cl]2+中元素电负性由大到小的顺序
(3)装置D中还会生成光气(COCl2),D中反应的化学方程式为
(4)该实验装置有设计不合理的地方,请写出改进方法:
(5)为进一步探究CrCl3的性质,某同学取试管若干支,分别加入10滴0.1 mol∙L−1 CrCl3溶液,并用4滴2 mol∙L−1 H2SO4酸化,再分别加入不同滴数的0.1 mol∙L−1KMnO4溶液,并在不同的温度下进行实验,反应现象记录于表中。
| KMnO4的用量 (滴数) | 在不同温度下的反应现象 | |
| 25℃ | 90~100℃ | |
| 1 | 紫红色 | 蓝绿色溶液 |
| 2~9 | 紫红色 | 黄绿色溶液,且随KMnO4滴数增加,黄色成分增多 |
| 10 | 紫红色 | 澄清的橙黄色溶液 |
| 11~23 | 紫红色 | 橙黄色溶液,有棕褐色沉淀,且随KMnO4滴数增加,沉淀增多 |
| 24~25 | 紫红色 | 紫红色溶液,有较多的棕褐色沉淀 |
CrCl3与KMnO4在常温下反应,观察不到Cr2O
 离子的橙色,甲同学认为其中一个原因是Cr2O
离子的橙色,甲同学认为其中一个原因是Cr2O 离子的橙色被MnO
离子的橙色被MnO 离子的紫红色掩盖,另一种可能的原因是
离子的紫红色掩盖,另一种可能的原因是 后,才能观察到反应液由紫红色逐渐变为橙黄色的实验现象。
后,才能观察到反应液由紫红色逐渐变为橙黄色的实验现象。②CrCl3与KMnO4的用量对反应的影响
对表中数据进行分析,在上述反应条件下,欲将Cr3+氧化为Cr2O
 ,CrCl3与KMnO4最佳用量比为
,CrCl3与KMnO4最佳用量比为 + 11H2O
+ 11H2O Cr2O
Cr2O + 6Mn2+ + 22H+ 所推断得到的用量比不符,你推测的原因是
+ 6Mn2+ + 22H+ 所推断得到的用量比不符,你推测的原因是
您最近半年使用:0次
解题方法
2 . 元素X、Y、Z、T、R的原子序数依次增大且小于20,其最外层电子数与原子半径间大大小关系如图所示。
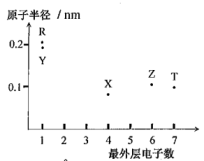
请按要求回答下列问题:
(1)写出基态R原子的价层电子排布式:_______ 。
(2)上述五种元素中,电负性最大的是(写元素符号,下同)_______ ,第一电离能最小的是_______ 。
(3)Z所在主族元素的氢化物中,其中稳定性最强是(用化学式表示)_______ 。
(4)向Y的最高价氧化物的水溶液中充入少量Z的氢化物,写出反应的离子方程式为_______ 。
(5)某化学兴趣小组为探究涉及上述元素性质的变化规律,设计了以下系列实验。
①甲同学欲探究同主族部分元素性质的递变规律,以元素Y、R为例,请完成其实验步骤:_______ 。通过观察现象得出的结论:相同条件下,同主族元素R的金属性比Y的强。
②乙同学欲探究第三周期部分元素性质的递变规律,以元素Z、T为例,自拟通过一步反应实现实验目的,其原理的化学方程式为:_______ 。欲观察到现象为:_______ ;结论:_______ 。

请按要求回答下列问题:
(1)写出基态R原子的价层电子排布式:
(2)上述五种元素中,电负性最大的是(写元素符号,下同)
(3)Z所在主族元素的氢化物中,其中稳定性最强是(用化学式表示)
(4)向Y的最高价氧化物的水溶液中充入少量Z的氢化物,写出反应的离子方程式为
(5)某化学兴趣小组为探究涉及上述元素性质的变化规律,设计了以下系列实验。
①甲同学欲探究同主族部分元素性质的递变规律,以元素Y、R为例,请完成其实验步骤:
②乙同学欲探究第三周期部分元素性质的递变规律,以元素Z、T为例,自拟通过一步反应实现实验目的,其原理的化学方程式为:
您最近半年使用:0次
解题方法
3 . 制备 的实验操作及现象如下:
的实验操作及现象如下:
 溶液
溶液 蓝色沉淀
蓝色沉淀 深蓝色透明溶液
深蓝色透明溶液 深蓝色晶体
深蓝色晶体
下列说法不正确的是
 的实验操作及现象如下:
的实验操作及现象如下: 溶液
溶液 蓝色沉淀
蓝色沉淀 深蓝色透明溶液
深蓝色透明溶液 深蓝色晶体
深蓝色晶体下列说法不正确的是
A. 的空间结构是正四面体形 的空间结构是正四面体形 | B.蓝色沉淀是 |
C.乙醇分子中元素的电负性: | D.深蓝色晶体属于离子晶体 |
您最近半年使用:0次
解题方法
4 . 表中列出了第三周期的几种元素的部分性质:
请按要求回答下列问题:
(1)写出基态 原子的价层电子轨道表示式:
原子的价层电子轨道表示式:___________ 。
(2)表中元素原子半径最大的是(写元素符号)___________ 。预测 值的区间
值的区间___________ 。
(3) 、
、 、
、 三种元素形成的氢化物中,其稳定性由强到弱的顺序是(用化学式表示)
三种元素形成的氢化物中,其稳定性由强到弱的顺序是(用化学式表示)___________ 。
(4)d、e最高价氧化物对应水化物相互反应的离子方程式为___________ 。
(5)上表中五种元素的第一电离能由大到小的顺序是(写元素符号)___________ 。
(6)某化学兴趣小组为探究元素性质的递变规律,设计了以下系列实验。
①甲同学为探究同主族元素金属性的递变规律,取绿豆粒大小的钠、钾分别放入到盛有 水的烧杯(滴有几滴酚酞溶液)中,通过观察现象得出的结论是
水的烧杯(滴有几滴酚酞溶液)中,通过观察现象得出的结论是___________ 。
②乙同学利用现有药品: 溶液、
溶液、 固体、浓盐酸、
固体、浓盐酸、 ,设计如图装置探究第三周期部分元素非金属性的递变规律。
,设计如图装置探究第三周期部分元素非金属性的递变规律。 中所装药品为
中所装药品为___________ ,装置 中的实验现象为有淡黄色沉淀生成,离子方程式为
中的实验现象为有淡黄色沉淀生成,离子方程式为___________ ;所得结论为___________ 。
| 元素编号 |  |  |  |  |  |
| 电负性 | 3.0 | 2.5 |  | 1.5 | 0.9 |
| 主要化合价 | -1,+7 | -2,+6 | -3,+5 | +3 | +1 |
(1)写出基态
 原子的价层电子轨道表示式:
原子的价层电子轨道表示式:(2)表中元素原子半径最大的是(写元素符号)
 值的区间
值的区间(3)
 、
、 、
、 三种元素形成的氢化物中,其稳定性由强到弱的顺序是(用化学式表示)
三种元素形成的氢化物中,其稳定性由强到弱的顺序是(用化学式表示)(4)d、e最高价氧化物对应水化物相互反应的离子方程式为
(5)上表中五种元素的第一电离能由大到小的顺序是(写元素符号)
(6)某化学兴趣小组为探究元素性质的递变规律,设计了以下系列实验。
①甲同学为探究同主族元素金属性的递变规律,取绿豆粒大小的钠、钾分别放入到盛有
 水的烧杯(滴有几滴酚酞溶液)中,通过观察现象得出的结论是
水的烧杯(滴有几滴酚酞溶液)中,通过观察现象得出的结论是②乙同学利用现有药品:
 溶液、
溶液、 固体、浓盐酸、
固体、浓盐酸、 ,设计如图装置探究第三周期部分元素非金属性的递变规律。
,设计如图装置探究第三周期部分元素非金属性的递变规律。 中所装药品为
中所装药品为 中的实验现象为有淡黄色沉淀生成,离子方程式为
中的实验现象为有淡黄色沉淀生成,离子方程式为
您最近半年使用:0次
名校
解题方法
5 . 双氰胺( )为白色晶体,在冷水中溶解度较小,溶于热水、乙醇,其水溶液在80℃以上会发生分解等副反应,主要用于生产树脂、涂料、含氮复合肥等。实验室以石灰氮
)为白色晶体,在冷水中溶解度较小,溶于热水、乙醇,其水溶液在80℃以上会发生分解等副反应,主要用于生产树脂、涂料、含氮复合肥等。实验室以石灰氮 为原料制备双氰胺的流程如下:
为原料制备双氰胺的流程如下:
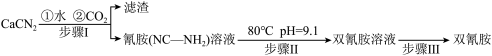
已知氰胺二聚反应机理为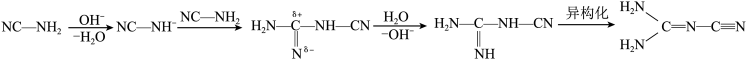
(1)已知:氰基是吸电子基团。氰氨
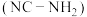 的碱性
的碱性(2)写出步骤Ⅰ的化学反应方程式:
(3)步骤Ⅱ中调节溶液pH为9.1,pH不能过低的原因:
(4)步骤Ⅲ中蒸发浓缩时,常采用真空蒸发浓缩,目的是
(5)凯氏定氮法是测定有机物中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐。
已知:
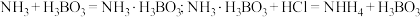

②仪器清洗后,g中加入硼酸
 和指示剂。铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭
和指示剂。铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭 ,d中保留少量水。打开
,d中保留少量水。打开 ,加热b,使水蒸气进入e。
,加热b,使水蒸气进入e。d中保留少量水的目的是
③取双氰胺样品m克进行测定,滴定g中吸收液时消耗浓度为
 的盐酸VmL,则样品中氮的质量分数为
的盐酸VmL,则样品中氮的质量分数为
您最近半年使用:0次
名校
解题方法
6 . 太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置。
I.第一代电池的光电转换材料是单晶硅。某单晶硅制备工艺中涉及的主要物质转化如下:
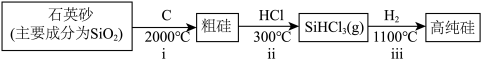
(1)下列事实能作为“非金属性C比Si强”的证据的是___________ (填字母)。
a.i中,C做还原剂
b.碳酸的酸性强于硅酸
c.碳酸的热稳定性弱于硅酸
(2)ii中,lmolSi与3molHCl反应转移4mol电子。
①该反应的化学方程式为___________ 。
②SiHCl3中,H的化合价为___________ ,由此推测Si的电负性比H的___________ (填“大”或“小”)。
(3)ⅲ中,利用沸点差异,可直接实现高纯硅与SiHCl3的分离,从晶体类型角度解释其原因:___________ 。
II.黄铜矿(主要成分为CuFeS2)可用于冶炼Cu2O。
(4)下图中,表示Cu2O晶胞的是___________ (填“图1”或“图2”)。
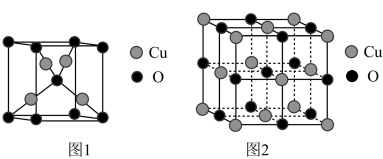
(5)Cu2O与Cu2S都可视为离子晶体,且结构相似,但Cu2O的熔点比Cu2S的高约100℃,原因是___________ 。
(6)CuFeS2的晶胞如图3所示。
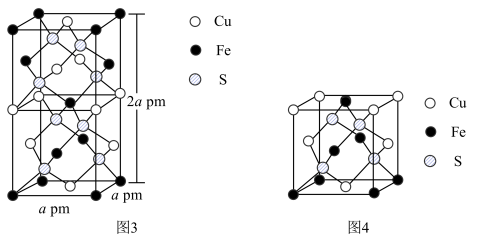
①图4所示结构单元不能作为CuFeS2晶胞的原因是___________ 。
②从图3可以看出,每个CuFeS2晶胞中含有的Cu原子个数为___________ 。
③已知:CuFeS2晶体的密度是4.30g/cm3,阿伏伽德罗常数的值为NA.CuFeS2晶胞中底边边长___________ pm(用计算式表示;1cm=10-l0pm;CuFeS2的摩尔质量为184g/mol)。
I.第一代电池的光电转换材料是单晶硅。某单晶硅制备工艺中涉及的主要物质转化如下:

(1)下列事实能作为“非金属性C比Si强”的证据的是
a.i中,C做还原剂
b.碳酸的酸性强于硅酸
c.碳酸的热稳定性弱于硅酸
(2)ii中,lmolSi与3molHCl反应转移4mol电子。
①该反应的化学方程式为
②SiHCl3中,H的化合价为
(3)ⅲ中,利用沸点差异,可直接实现高纯硅与SiHCl3的分离,从晶体类型角度解释其原因:
II.黄铜矿(主要成分为CuFeS2)可用于冶炼Cu2O。
(4)下图中,表示Cu2O晶胞的是

(5)Cu2O与Cu2S都可视为离子晶体,且结构相似,但Cu2O的熔点比Cu2S的高约100℃,原因是
(6)CuFeS2的晶胞如图3所示。

①图4所示结构单元不能作为CuFeS2晶胞的原因是
②从图3可以看出,每个CuFeS2晶胞中含有的Cu原子个数为
③已知:CuFeS2晶体的密度是4.30g/cm3,阿伏伽德罗常数的值为NA.CuFeS2晶胞中底边边长
您最近半年使用:0次
2024-01-31更新
|
309次组卷
|
2卷引用:北京市第十四中学2023-2024学年高三上学期12月月考化学试题
名校
7 . 三氯甲硅烷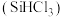 是制取高纯硅的重要原料,常温下为无色液体,沸点为
是制取高纯硅的重要原料,常温下为无色液体,沸点为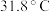 ,熔点为
,熔点为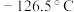 ,易水解。实验室根据反应
,易水解。实验室根据反应 ,利用如下装置制备
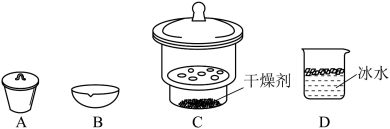
,利用如下装置制备 粗品(加热及夹持装置略)。回答下列问题:
粗品(加热及夹持装置略)。回答下列问题:
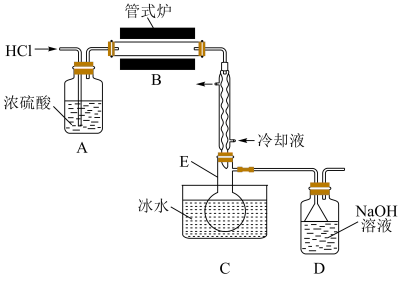
(1)制备 时进行操作:(i)……;(ii)将盛有硅粉的瓷舟置于管式炉中;(iii)通入
时进行操作:(i)……;(ii)将盛有硅粉的瓷舟置于管式炉中;(iii)通入 、一段时间后接通冷凝装置,加热开始反应。操作(i)为
、一段时间后接通冷凝装置,加热开始反应。操作(i)为___________ ;判断制备反应结束的实验现象是___________ 。图示装置存在的两处缺陷是___________ ,装置 的名称为
的名称为___________ 。
(2)已知电负性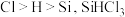 在浓
在浓 溶液中发生反应的化学方程式为
溶液中发生反应的化学方程式为___________ 。
(3)采用如下方法测定溶有少量 的
的 纯度。
纯度。
 样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:①
样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:①___________ ,②___________ (填操作名称),③称量等操作,测得所得固体氧化物质量为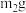 ,从下列仪器中选出①、②中需使用的仪器,依次为
,从下列仪器中选出①、②中需使用的仪器,依次为___________ (填标号)。测得样品纯度为___________ (用含 的代数式表示)。
的代数式表示)。
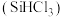 是制取高纯硅的重要原料,常温下为无色液体,沸点为
是制取高纯硅的重要原料,常温下为无色液体,沸点为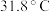 ,熔点为
,熔点为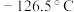 ,易水解。实验室根据反应
,易水解。实验室根据反应 ,利用如下装置制备
,利用如下装置制备 粗品(加热及夹持装置略)。回答下列问题:
粗品(加热及夹持装置略)。回答下列问题:
(1)制备
 时进行操作:(i)……;(ii)将盛有硅粉的瓷舟置于管式炉中;(iii)通入
时进行操作:(i)……;(ii)将盛有硅粉的瓷舟置于管式炉中;(iii)通入 、一段时间后接通冷凝装置,加热开始反应。操作(i)为
、一段时间后接通冷凝装置,加热开始反应。操作(i)为 的名称为
的名称为(2)已知电负性
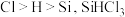 在浓
在浓 溶液中发生反应的化学方程式为
溶液中发生反应的化学方程式为(3)采用如下方法测定溶有少量
 的
的 纯度。
纯度。 样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:①
样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:①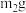 ,从下列仪器中选出①、②中需使用的仪器,依次为
,从下列仪器中选出①、②中需使用的仪器,依次为 的代数式表示)。
的代数式表示)。
您最近半年使用:0次
名校
8 . 三氯甲硅烷((SiHCl₃)是制取高纯硅的重要原料,常温下为无色液体,沸点为31.8℃,熔点为-126.5℃,易水解。实验室根据反应 ,利用如下装置制备
,利用如下装置制备 粗品(加热及夹持装置略)。回答下列问题:
粗品(加热及夹持装置略)。回答下列问题:

(1)制备 时进行操作:(ⅰ)……;(ⅱ)将盛有硅粉的瓷舟置于管式炉中;(ⅲ)通入HCl,一段时间后接通冷凝装置,加热开始反应。操作(ⅰ)为
时进行操作:(ⅰ)……;(ⅱ)将盛有硅粉的瓷舟置于管式炉中;(ⅲ)通入HCl,一段时间后接通冷凝装置,加热开始反应。操作(ⅰ)为______ ;判断制备反应结束的实验现象是______ 。图示装置存在的两处缺陷,请提出相应改进建议______ 。
(2)已知电负性Cl>H>Si, 在浓NaOH溶液中发生反应的化学方程式为
在浓NaOH溶液中发生反应的化学方程式为______ 。
(3)采用如下方法测定溶有少量HCl的 纯度。
纯度。
 g样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:①
g样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:①______ ,②______ (填操作名称),③称量等操作,测得所得固体氧化物质量为 g,从下列仪器中选出①、②中需使用的仪器,依次为
g,从下列仪器中选出①、②中需使用的仪器,依次为______ (填标号)。测得样品纯度为______ (用含 、
、 的代数式表示)。
的代数式表示)。

 ,利用如下装置制备
,利用如下装置制备 粗品(加热及夹持装置略)。回答下列问题:
粗品(加热及夹持装置略)。回答下列问题:
(1)制备
 时进行操作:(ⅰ)……;(ⅱ)将盛有硅粉的瓷舟置于管式炉中;(ⅲ)通入HCl,一段时间后接通冷凝装置,加热开始反应。操作(ⅰ)为
时进行操作:(ⅰ)……;(ⅱ)将盛有硅粉的瓷舟置于管式炉中;(ⅲ)通入HCl,一段时间后接通冷凝装置,加热开始反应。操作(ⅰ)为(2)已知电负性Cl>H>Si,
 在浓NaOH溶液中发生反应的化学方程式为
在浓NaOH溶液中发生反应的化学方程式为(3)采用如下方法测定溶有少量HCl的
 纯度。
纯度。 g样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:①
g样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:① g,从下列仪器中选出①、②中需使用的仪器,依次为
g,从下列仪器中选出①、②中需使用的仪器,依次为 、
、 的代数式表示)。
的代数式表示)。
您最近半年使用:0次
名校
解题方法
9 . 高纯单晶硅是重要的半导体材料,在各种集成电路、芯片和CPU的制作中有不可替代的作用。实验室中模拟 制备高纯硅的装置如图所示(夹持装置略去),下列说法错误的是
制备高纯硅的装置如图所示(夹持装置略去),下列说法错误的是

已知:电负性 的沸点为
的沸点为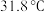 ,熔点为
,熔点为 ,在空气中易自燃,遇水会剧烈反应。
,在空气中易自燃,遇水会剧烈反应。
 制备高纯硅的装置如图所示(夹持装置略去),下列说法错误的是
制备高纯硅的装置如图所示(夹持装置略去),下列说法错误的是
已知:电负性
 的沸点为
的沸点为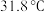 ,熔点为
,熔点为 ,在空气中易自燃,遇水会剧烈反应。
,在空气中易自燃,遇水会剧烈反应。A.实验过程中,加热石英管前应先对 进行验纯 进行验纯 |
B.实验开始时,排尽装置中的空气是为了防止 自燃和水解 自燃和水解 |
C.尾气通入 溶液中, 溶液中, 发生反应的化学方程式为 发生反应的化学方程式为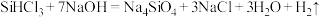 |
D.为提高装置Ⅳ中 的利用率,装置Ⅲ应使用冷水浴 的利用率,装置Ⅲ应使用冷水浴 |
您最近半年使用:0次
2023-11-06更新
|
262次组卷
|
2卷引用:湖北省六校新高考联盟学校2023-2024学年高三上学期11月联考化学试题
解题方法
10 . 太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置。
Ⅰ.第一代电池的光电转换材料是单晶硅。某单晶硅制备工艺中涉及的主要物质转化如下:

(1)下列事实能作为“非金属性C比Si强”的证据的是___________ (填字母)。
a.ⅰ中,C做还原剂
b.碳酸的酸性强于硅酸
c.碳酸的热稳定性弱于硅酸
(2)ⅱ中,1mol Si与3mol HCl反应转移4mol电子。
①该反应的化学方程式为___________ 。
② 中,H的化合价为
中,H的化合价为___________ ,由此推测Si的电负性比H的___________ (填“大”或“小”)。
(3)ⅲ中,利用沸点差异,可直接实现高纯硅与 的分离,从晶体类型角度解释其原因:
的分离,从晶体类型角度解释其原因:___________ 。
Ⅱ.第二代电池的光电转换材料是一种无机物薄膜,其光电转化率高于单晶硅。科学家在元素周期表中Si的附近寻找到元素A和D,并制成化合物AD的薄膜,其晶体结构类似单晶硅。Si、A、D在元素周期表中的位置关系如图所示。
(4)基态A原子核外电子排布式为___________ 。
(5)D的第一电离能比Se的大,从原子结构角度说明理由:___________ 。
Ⅰ.第一代电池的光电转换材料是单晶硅。某单晶硅制备工艺中涉及的主要物质转化如下:

(1)下列事实能作为“非金属性C比Si强”的证据的是
a.ⅰ中,C做还原剂
b.碳酸的酸性强于硅酸
c.碳酸的热稳定性弱于硅酸
(2)ⅱ中,1mol Si与3mol HCl反应转移4mol电子。
①该反应的化学方程式为
②
 中,H的化合价为
中,H的化合价为(3)ⅲ中,利用沸点差异,可直接实现高纯硅与
 的分离,从晶体类型角度解释其原因:
的分离,从晶体类型角度解释其原因:Ⅱ.第二代电池的光电转换材料是一种无机物薄膜,其光电转化率高于单晶硅。科学家在元素周期表中Si的附近寻找到元素A和D,并制成化合物AD的薄膜,其晶体结构类似单晶硅。Si、A、D在元素周期表中的位置关系如图所示。
| Si | ||
| A | D |
(4)基态A原子核外电子排布式为
(5)D的第一电离能比Se的大,从原子结构角度说明理由:
您最近半年使用:0次



