1 . 短周期元素可形成许多结构和性质不同的化合物,回答下列问题:

(1) 是一种甲基化试剂,能发生水解反应
是一种甲基化试剂,能发生水解反应 ;
; 的水解产物为
的水解产物为_____ (填化学式)。
(2) 是共价化合物,可以形成二聚体和多聚体
是共价化合物,可以形成二聚体和多聚体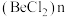 ,二聚体中
,二聚体中 的杂化方式为
的杂化方式为 ,二聚体的结构式为
,二聚体的结构式为_____ 。
(3)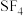 分子的电子对空间构型为三角双锥,排布方式有两种,结构如图。根据价层电子对互斥理论中:“孤电子对一成键电子对”分布在互成
分子的电子对空间构型为三角双锥,排布方式有两种,结构如图。根据价层电子对互斥理论中:“孤电子对一成键电子对”分布在互成 的方向上时斥力最大,判断
的方向上时斥力最大,判断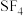 应采用结构
应采用结构_____ (填“a”或“b”)。
(4) 在水溶液中显蓝色,加入过量的氨水后变为深蓝色,原因是生成了
在水溶液中显蓝色,加入过量的氨水后变为深蓝色,原因是生成了_____ (填化学式),比较它与 的稳定性并说明理由
的稳定性并说明理由_____ 。
(5)在超高压下,金属钠和氦可形成化合物。结构中的钠离子按简单立方排布,形成 立方体空隙如图,电子对
立方体空隙如图,电子对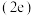 和氦原子交替分布填充在立方体的中心。若将氦原子放在晶胞顶点,则电子对
和氦原子交替分布填充在立方体的中心。若将氦原子放在晶胞顶点,则电子对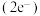 在该晶胞中的所有分数坐标除了
在该晶胞中的所有分数坐标除了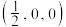 、
、 ,还有
,还有_____ ;若晶体的密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,晶胞的边长
,晶胞的边长
_____  (用含
(用含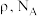 的代数式表示)。
的代数式表示)。


(1)
 是一种甲基化试剂,能发生水解反应
是一种甲基化试剂,能发生水解反应 ;
; 的水解产物为
的水解产物为(2)
 是共价化合物,可以形成二聚体和多聚体
是共价化合物,可以形成二聚体和多聚体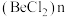 ,二聚体中
,二聚体中 的杂化方式为
的杂化方式为 ,二聚体的结构式为
,二聚体的结构式为(3)
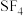 分子的电子对空间构型为三角双锥,排布方式有两种,结构如图。根据价层电子对互斥理论中:“孤电子对一成键电子对”分布在互成
分子的电子对空间构型为三角双锥,排布方式有两种,结构如图。根据价层电子对互斥理论中:“孤电子对一成键电子对”分布在互成 的方向上时斥力最大,判断
的方向上时斥力最大,判断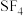 应采用结构
应采用结构(4)
 在水溶液中显蓝色,加入过量的氨水后变为深蓝色,原因是生成了
在水溶液中显蓝色,加入过量的氨水后变为深蓝色,原因是生成了 的稳定性并说明理由
的稳定性并说明理由(5)在超高压下,金属钠和氦可形成化合物。结构中的钠离子按简单立方排布,形成
 立方体空隙如图,电子对
立方体空隙如图,电子对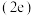 和氦原子交替分布填充在立方体的中心。若将氦原子放在晶胞顶点,则电子对
和氦原子交替分布填充在立方体的中心。若将氦原子放在晶胞顶点,则电子对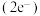 在该晶胞中的所有分数坐标除了
在该晶胞中的所有分数坐标除了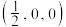 、
、 ,还有
,还有 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,晶胞的边长
,晶胞的边长
 (用含
(用含 的代数式表示)。
的代数式表示)。
您最近半年使用:0次
名校
2 . 已知W、X、Y和Z为前四周期元素,且原子序数依次增大,W的原子半径在元素周期表中最小,X、Y位于同一主族,Z的正一价离子在酸性条件下可以发生歧化反应, 分解的TG曲线(热重)及DSC曲线(反映体系热量变化情况,数值已省略)如图所示。下列说法不正确的是
分解的TG曲线(热重)及DSC曲线(反映体系热量变化情况,数值已省略)如图所示。下列说法不正确的是

 分解的TG曲线(热重)及DSC曲线(反映体系热量变化情况,数值已省略)如图所示。下列说法不正确的是
分解的TG曲线(热重)及DSC曲线(反映体系热量变化情况,数值已省略)如图所示。下列说法不正确的是
| A.W、X、Y、Z的电负性大小:X>Y>W>Z |
B. 和 和 之间存在不同的作用力 之间存在不同的作用力 |
| C.700℃左右有两个吸收峰,此时发生两个氧化还原反应 |
D.1200℃时固体成分为 |
您最近半年使用:0次
名校
解题方法
3 .  及其化合物在生产和生活中用途广泛,回答下列问题。
及其化合物在生产和生活中用途广泛,回答下列问题。
(1) 的基态原子共有
的基态原子共有_____________ 种不同能级的电子。
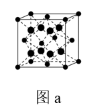
(2) 为只含有离子键的离子化合物,其晶胞结构如图a,距一个
为只含有离子键的离子化合物,其晶胞结构如图a,距一个 最近的所有
最近的所有 为顶点构成的几何形状为
为顶点构成的几何形状为_____________ 。
(3)二茂铁是最重要的金属茂基配合物,结构为一个铁原子处在两个平行的环戊二烯基环之间,结构如图b所示,已知二茂铁的一氯代物只有一种。

①二茂铁的分子式为_____________ 。
②穆斯堡尔谱学数据显示,二茂铁中学铁原子的氧化态为+2,每个茂环带有一个单位负电荷,因此每个环含有_____________ 个 电子。
电子。
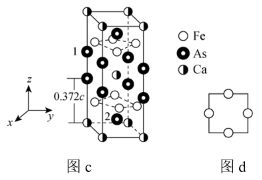
(4)一种铁基超导材料( ,相对分子质量为
,相对分子质量为 )晶胞如图c所示,图d为铁原子沿轴方向的投影图。
)晶胞如图c所示,图d为铁原子沿轴方向的投影图。
① 与
与 位于同一周期、且最外层电子数相等,但
位于同一周期、且最外层电子数相等,但 的熔点、沸点均比
的熔点、沸点均比 高,原因是
高,原因是_____________ 。
② 分子与
分子与 形成配合物后
形成配合物后 键角
键角_____________ (填“变大”“变小”或“不变”)。
③ 、
、 、
、 电负性由大到小的顺序为
电负性由大到小的顺序为_____________ 。
④ 的沸点(319℃,易升华)高于
的沸点(319℃,易升华)高于 的沸点(130.2℃),原因是
的沸点(130.2℃),原因是_____________ 。
⑤已知处于体心与顶点的 原子有着相同的化学环境,晶胞中
原子有着相同的化学环境,晶胞中 原子1的原子坐标为(0,0,0.628),则
原子1的原子坐标为(0,0,0.628),则 原子2的原子坐标为
原子2的原子坐标为_____________ 。
 及其化合物在生产和生活中用途广泛,回答下列问题。
及其化合物在生产和生活中用途广泛,回答下列问题。(1)
 的基态原子共有
的基态原子共有(2)
 为只含有离子键的离子化合物,其晶胞结构如图a,距一个
为只含有离子键的离子化合物,其晶胞结构如图a,距一个 最近的所有
最近的所有 为顶点构成的几何形状为
为顶点构成的几何形状为
(3)二茂铁是最重要的金属茂基配合物,结构为一个铁原子处在两个平行的环戊二烯基环之间,结构如图b所示,已知二茂铁的一氯代物只有一种。

①二茂铁的分子式为
②穆斯堡尔谱学数据显示,二茂铁中学铁原子的氧化态为+2,每个茂环带有一个单位负电荷,因此每个环含有
 电子。
电子。(4)一种铁基超导材料(
 ,相对分子质量为
,相对分子质量为 )晶胞如图c所示,图d为铁原子沿轴方向的投影图。
)晶胞如图c所示,图d为铁原子沿轴方向的投影图。
①
 与
与 位于同一周期、且最外层电子数相等,但
位于同一周期、且最外层电子数相等,但 的熔点、沸点均比
的熔点、沸点均比 高,原因是
高,原因是②
 分子与
分子与 形成配合物后
形成配合物后 键角
键角③
 、
、 、
、 电负性由大到小的顺序为
电负性由大到小的顺序为④
 的沸点(319℃,易升华)高于
的沸点(319℃,易升华)高于 的沸点(130.2℃),原因是
的沸点(130.2℃),原因是⑤已知处于体心与顶点的
 原子有着相同的化学环境,晶胞中
原子有着相同的化学环境,晶胞中 原子1的原子坐标为(0,0,0.628),则
原子1的原子坐标为(0,0,0.628),则 原子2的原子坐标为
原子2的原子坐标为
您最近半年使用:0次
4 . 铝是常见金属,其合金、化合物在生产生活中有重要应用。请回答:
(1)能量最低的激发态 的核外电子排布式是
的核外电子排布式是___________ 。
(2)铝能与H、C、N、F、Cl 等元素形成多种化合物
①下列说法不正确 的是___________ 。
A. 中Al原子的杂化方式是sp2
中Al原子的杂化方式是sp2
B.化学键中离子键成分的百分数: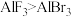
C. 分子中有6对共用电子对
分子中有6对共用电子对
D. 中所有原子或离子满足8 电子稳定结构
中所有原子或离子满足8 电子稳定结构
②常温下 AlCl3在四氯化碳中的溶解度大于MgCl2,理由是___________ 。
③三乙基铝是一种金属有机物,结构简式为Al(C2H5)3,可做高能火箭燃料,原因是___________ 。
(3)AlP 晶胞结构如下图所示:
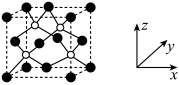
①磷化铝晶胞沿着 y轴的投影图为_________ (填选项字母)。
A. B.
B.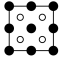 C.
C.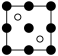 D.
D.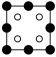
②若磷化铝的晶胞边长为 apm,NA表示阿伏加德罗常数的值,则 AlP晶体的密度为_________ g∙cm−3(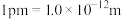 用含 NA、a 的最简代数式表示)。
用含 NA、a 的最简代数式表示)。
(1)能量最低的激发态
 的核外电子排布式是
的核外电子排布式是(2)铝能与H、C、N、F、Cl 等元素形成多种化合物
①下列说法
A.
 中Al原子的杂化方式是sp2
中Al原子的杂化方式是sp2B.化学键中离子键成分的百分数:
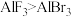
C.
 分子中有6对共用电子对
分子中有6对共用电子对D.
 中所有原子或离子满足8 电子稳定结构
中所有原子或离子满足8 电子稳定结构②常温下 AlCl3在四氯化碳中的溶解度大于MgCl2,理由是
③三乙基铝是一种金属有机物,结构简式为Al(C2H5)3,可做高能火箭燃料,原因是
(3)AlP 晶胞结构如下图所示:

①磷化铝晶胞沿着 y轴的投影图为
A.
 B.
B. C.
C. D.
D.
②若磷化铝的晶胞边长为 apm,NA表示阿伏加德罗常数的值,则 AlP晶体的密度为
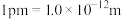 用含 NA、a 的最简代数式表示)。
用含 NA、a 的最简代数式表示)。
您最近半年使用:0次
名校
解题方法
5 . 卤素元素比较活泼,能形成种类繁多的化合物,回答下列问题:
(1)F,Cl,Br,I形成简单氢化物的沸点由高到低的顺序为:____________________________ 。
(2)卤素可形成很多酸根离子,如 、
、 、
、 、
、 等,
等, 的空间结构为
的空间结构为______________ 。
(3)卤素元素之间还能形成很多卤素互化物,如 ,
, ,
,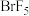 ,
,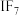 等,根据I与Cl原子的电负性大小关系写成
等,根据I与Cl原子的电负性大小关系写成 在水中水解的化学方程式:
在水中水解的化学方程式:_____________________ 。
(4)在石墨烯膜上可以制备Cl元素和Ca元素形成的新型的化合物,如图是俯视图和侧视图,俯视图中小六元环为石墨层,大六元环含3个大球(石墨六元环中心正上方)和3个小球(石墨层部分碳原子正上方),请写出该化合物的化学式______________ ,在石墨六元环中心正上方的元素为______________ 。(填元素符号)

(5)卤素还被称为成盐元素,某种卤素盐的晶体中含有Cl,Cs与Au三种元素,其最简式为 ,Au有两种化合价,其一个晶胞结构如图所示,未标出的两个小球为金(Au)离子,底面正方形边长为
,Au有两种化合价,其一个晶胞结构如图所示,未标出的两个小球为金(Au)离子,底面正方形边长为 ,高为
,高为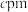 ,高分为两段,分别为
,高分为两段,分别为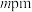 和
和 ,
, 的相对分子质量为M,回答下列问题:
的相对分子质量为M,回答下列问题:
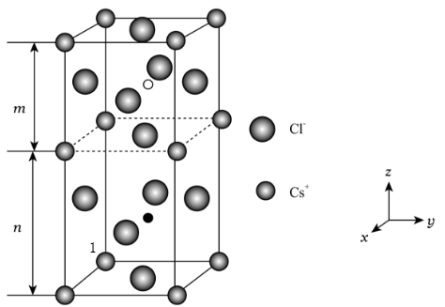
①如果 与
与 相等,
相等, 和
和 构成
构成______________ 晶胞。
②金(Au)离子和 的配位数分别为
的配位数分别为__________ 和__________ 。
③如图所示,以原子1为原点建立坐标系,写出晶胞内部小白球的分数坐标______ 。
(1)F,Cl,Br,I形成简单氢化物的沸点由高到低的顺序为:
(2)卤素可形成很多酸根离子,如
 、
、 、
、 、
、 等,
等, 的空间结构为
的空间结构为(3)卤素元素之间还能形成很多卤素互化物,如
 ,
, ,
,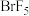 ,
,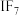 等,根据I与Cl原子的电负性大小关系写成
等,根据I与Cl原子的电负性大小关系写成 在水中水解的化学方程式:
在水中水解的化学方程式:(4)在石墨烯膜上可以制备Cl元素和Ca元素形成的新型的化合物,如图是俯视图和侧视图,俯视图中小六元环为石墨层,大六元环含3个大球(石墨六元环中心正上方)和3个小球(石墨层部分碳原子正上方),请写出该化合物的化学式

(5)卤素还被称为成盐元素,某种卤素盐的晶体中含有Cl,Cs与Au三种元素,其最简式为
 ,Au有两种化合价,其一个晶胞结构如图所示,未标出的两个小球为金(Au)离子,底面正方形边长为
,Au有两种化合价,其一个晶胞结构如图所示,未标出的两个小球为金(Au)离子,底面正方形边长为 ,高为
,高为 ,高分为两段,分别为
,高分为两段,分别为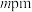 和
和 ,
, 的相对分子质量为M,回答下列问题:
的相对分子质量为M,回答下列问题:
①如果
 与
与 相等,
相等, 和
和 构成
构成②金(Au)离子和
 的配位数分别为
的配位数分别为③如图所示,以原子1为原点建立坐标系,写出晶胞内部小白球的分数坐标
您最近半年使用:0次
名校
解题方法
6 . 物质世界的神奇莫测,常常超乎人们的想象。掌握晶体的结构与性质之间的关系,也许能使你想象的翅膀变得更有力。请回答下列问题:
(1) 是目前市场上流行的补锌剂。写出
是目前市场上流行的补锌剂。写出 基态电子排布式:
基态电子排布式:___________ 。
(2)已知高温下 比
比 更稳定,试从铜原子核外电子变化角度解释其原因:
更稳定,试从铜原子核外电子变化角度解释其原因:___________ 。
(3)镍能与类卤素 反应生成
反应生成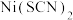 。
。 中硫原子的杂化方式是
中硫原子的杂化方式是___________ , 键和
键和 键数目之比为
键数目之比为___________ ;类卤素 对应的酸有两种,理论上硫氰酸(HSCN)的沸点低于异硫氰酸(HNCS)的沸点,其原因是
对应的酸有两种,理论上硫氰酸(HSCN)的沸点低于异硫氰酸(HNCS)的沸点,其原因是___________ 。
(4)氮化硼(BN)晶体存在两种结构,六方氮化硼的结构与石墨类似,可做润滑剂;立方氮化硼的结构与金刚石类似,可作研磨剂。六方氮化硼的晶体类型为___________ 。
(5) 中所含元素的电负性由大到小的顺序为
中所含元素的电负性由大到小的顺序为___________ ,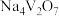 晶体中存在的相互作用有
晶体中存在的相互作用有___________ (填标号)。
a.离子键 B.共价键 C.金属键 D.氢键 E.范德华力
(6) 的结构如图所示,已知键角
的结构如图所示,已知键角 为
为 ,
, 为
为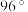 ,则
,则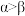 的原因主要是
的原因主要是___________ 。

(7)酸性:
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(8)已知 可形成配位数为6,颜色不同的两种配合物晶体,一种为紫色,另一为绿色。两种晶体的组成皆为
可形成配位数为6,颜色不同的两种配合物晶体,一种为紫色,另一为绿色。两种晶体的组成皆为 。为测定这两种晶体的化学式,设计了如下实验:
。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入 溶液,均产生白色沉淀;
溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现绿色晶体的水溶液得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的 。绿色晶体配合物的化学式为
。绿色晶体配合物的化学式为___________ 。
(9) 的晶胞如图所示。
的晶胞如图所示。
①已知A的坐标为(0,0,0),B的坐标为___________ 。
②设阿伏加德罗常数的值为 ,则
,则 晶体的密度为
晶体的密度为___________  (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
(1)
 是目前市场上流行的补锌剂。写出
是目前市场上流行的补锌剂。写出 基态电子排布式:
基态电子排布式:(2)已知高温下
 比
比 更稳定,试从铜原子核外电子变化角度解释其原因:
更稳定,试从铜原子核外电子变化角度解释其原因:(3)镍能与类卤素
 反应生成
反应生成 。
。 中硫原子的杂化方式是
中硫原子的杂化方式是 键和
键和 键数目之比为
键数目之比为 对应的酸有两种,理论上硫氰酸(HSCN)的沸点低于异硫氰酸(HNCS)的沸点,其原因是
对应的酸有两种,理论上硫氰酸(HSCN)的沸点低于异硫氰酸(HNCS)的沸点,其原因是(4)氮化硼(BN)晶体存在两种结构,六方氮化硼的结构与石墨类似,可做润滑剂;立方氮化硼的结构与金刚石类似,可作研磨剂。六方氮化硼的晶体类型为
(5)
 中所含元素的电负性由大到小的顺序为
中所含元素的电负性由大到小的顺序为 晶体中存在的相互作用有
晶体中存在的相互作用有a.离子键 B.共价键 C.金属键 D.氢键 E.范德华力
(6)
 的结构如图所示,已知键角
的结构如图所示,已知键角 为
为 ,
, 为
为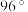 ,则
,则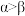 的原因主要是
的原因主要是
(7)酸性:

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(8)已知
 可形成配位数为6,颜色不同的两种配合物晶体,一种为紫色,另一为绿色。两种晶体的组成皆为
可形成配位数为6,颜色不同的两种配合物晶体,一种为紫色,另一为绿色。两种晶体的组成皆为 。为测定这两种晶体的化学式,设计了如下实验:
。为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入
 溶液,均产生白色沉淀;
溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现绿色晶体的水溶液得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的
 。绿色晶体配合物的化学式为
。绿色晶体配合物的化学式为(9)
 的晶胞如图所示。
的晶胞如图所示。
①已知A的坐标为(0,0,0),B的坐标为
②设阿伏加德罗常数的值为
 ,则
,则 晶体的密度为
晶体的密度为 (用含a、
(用含a、 的代数式表示)。
的代数式表示)。
您最近半年使用:0次
解题方法
7 . 太阳能的开发利用在新能源研究中占据重要地位。
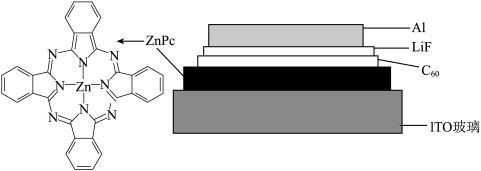
(1)我国科学家制备了一种 太阳能电池,其结构示意图如下,其中
太阳能电池,其结构示意图如下,其中 是光电转换层,ITO玻璃为导电玻璃。
是光电转换层,ITO玻璃为导电玻璃。
①基态 的价电子排布式为
的价电子排布式为___________ 。
②C、N、O、F的第一电离能从大到小的顺序为___________ 。
(2)钙钛矿材料是与钛酸钙(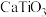 )具备相同晶体结构的一类“陶瓷氧化物”的统称,在太阳能电池中应用广泛。其化学式一般为
)具备相同晶体结构的一类“陶瓷氧化物”的统称,在太阳能电池中应用广泛。其化学式一般为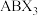 ,A代表“大半径阳离子”,B代表“金属阳离子”,X代表“阴离子”。常见的A有MA(
,A代表“大半径阳离子”,B代表“金属阳离子”,X代表“阴离子”。常见的A有MA( )、FA(
)、FA(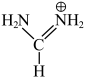 )、
)、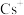 ,
,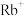 等,其中MA中N原子的杂化轨道类型是
等,其中MA中N原子的杂化轨道类型是___________ ,1molFA中存在___________ 个σ键( 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
(3)一种立方钙钛矿型晶体 有两种晶胞结构,其三视图如下(重叠处仅画出大的微粒),La的配位数均是12。
有两种晶胞结构,其三视图如下(重叠处仅画出大的微粒),La的配位数均是12。
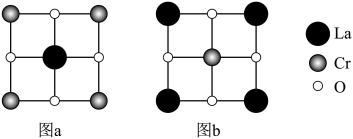
①图a晶胞中O的位置为___________ (填“体心”“顶点”“面心”“棱心”,下同);图b晶胞中O的位置为___________ 。图a的晶胞参数为393.9pm,则O与O的最小核间距为___________ pm。
②晶胞经掺杂后能提高红外辐射效率。若图a晶胞的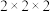 超晶胞中一个La原子被Sr代替,则掺杂后晶体化学式为
超晶胞中一个La原子被Sr代替,则掺杂后晶体化学式为___________ ;掺杂Sr后O与O的最小核间距略有减小,其可能的原因是___________ 。
(1)我国科学家制备了一种
 太阳能电池,其结构示意图如下,其中
太阳能电池,其结构示意图如下,其中 是光电转换层,ITO玻璃为导电玻璃。
是光电转换层,ITO玻璃为导电玻璃。
①基态
 的价电子排布式为
的价电子排布式为②C、N、O、F的第一电离能从大到小的顺序为
(2)钙钛矿材料是与钛酸钙(
 )具备相同晶体结构的一类“陶瓷氧化物”的统称,在太阳能电池中应用广泛。其化学式一般为
)具备相同晶体结构的一类“陶瓷氧化物”的统称,在太阳能电池中应用广泛。其化学式一般为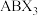 ,A代表“大半径阳离子”,B代表“金属阳离子”,X代表“阴离子”。常见的A有MA(
,A代表“大半径阳离子”,B代表“金属阳离子”,X代表“阴离子”。常见的A有MA( )、FA(
)、FA( )、
)、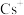 ,
,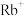 等,其中MA中N原子的杂化轨道类型是
等,其中MA中N原子的杂化轨道类型是 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。(3)一种立方钙钛矿型晶体
 有两种晶胞结构,其三视图如下(重叠处仅画出大的微粒),La的配位数均是12。
有两种晶胞结构,其三视图如下(重叠处仅画出大的微粒),La的配位数均是12。
①图a晶胞中O的位置为
②晶胞经掺杂后能提高红外辐射效率。若图a晶胞的
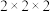 超晶胞中一个La原子被Sr代替,则掺杂后晶体化学式为
超晶胞中一个La原子被Sr代替,则掺杂后晶体化学式为
您最近半年使用:0次
2023·天津·模拟预测
8 . 铁(Fe)、钴(Co)、镍(Ni)是第四周期第Ⅶ族的元素,其化合物在生产生活中应用广泛。
(1)基态Fe的价层电子排布式为______ 。
(2)以甲醇为溶剂,Co2+可与色胺酮分子配位结合,形成对DNA具有切割作用的色胺酮钴配合物(合成过程如图所示)。
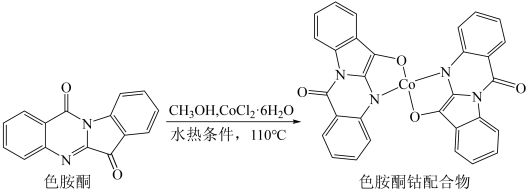
①色胺酮分子中所含元素(H、C、N、O)电负性由大到小的顺序为______ 。
②色胺酮分子中N原子的杂化类型为______ 。
③X射线衍射分析显示色胺酮钴配合物晶胞中还含有一个CH3OH分子,CH3OH是通过_______ 作用与色胺酮钴配合物相结合,CH3OH分子内______ π键。(填“有”或“没有”)
(3)超导材料在电力、交通、医学等方面有着广泛的应用,某含Ni、Mg和C三种元素的晶体具有超导性,该晶体的晶胞结构如图所示:

①距离Mg原子最近的Ni原子有______ 个。
②已知该晶胞的边长为anm,阿伏加德罗常数为NA,该晶体的密度为______ g•cm-3。(1nm=10-9m)
(1)基态Fe的价层电子排布式为
(2)以甲醇为溶剂,Co2+可与色胺酮分子配位结合,形成对DNA具有切割作用的色胺酮钴配合物(合成过程如图所示)。

①色胺酮分子中所含元素(H、C、N、O)电负性由大到小的顺序为
②色胺酮分子中N原子的杂化类型为
③X射线衍射分析显示色胺酮钴配合物晶胞中还含有一个CH3OH分子,CH3OH是通过
(3)超导材料在电力、交通、医学等方面有着广泛的应用,某含Ni、Mg和C三种元素的晶体具有超导性,该晶体的晶胞结构如图所示:

①距离Mg原子最近的Ni原子有
②已知该晶胞的边长为anm,阿伏加德罗常数为NA,该晶体的密度为
您最近半年使用:0次
9 . 锂离子电池能够成为产业发展方向,主要基于其拥有较高的能量重量比和能量体积比等多项特性,正极材料为钴酸锂、锰酸锂和磷酸亚铁锂材料等。
(1)工业上用 、
、 、LiCl及苯胺(
、LiCl及苯胺(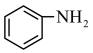 )为原料制备磷酸亚铁锂。基态Cl原子价电子的轨道表示式为
)为原料制备磷酸亚铁锂。基态Cl原子价电子的轨道表示式为_______ ,其在元素周期表中的位置为_______ ,O、N、P的电负性由大到小的顺序为_______ 。
(2)锂离子电池可采用离子液体作为电解质,以下为2种离子液体的结构。
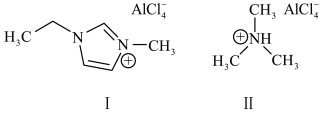
化合物Ⅰ中碳原子的杂化轨道类型为_______ ,1mol化合物Ⅰ中含有_______ 个σ键;化合物Ⅱ中阳离子的空间构型为_______ 。传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是_______ 。
(3)实验室可利用硝酸锰受热分解的方式制备锰的一种氧化物(晶胞结构如图所示)。
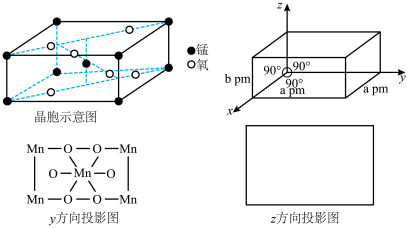
该锰的氧化物中Mn的化合价为_______ ,请画出z方向投影图_______ 。
(1)工业上用
 、
、 、LiCl及苯胺(
、LiCl及苯胺( )为原料制备磷酸亚铁锂。基态Cl原子价电子的轨道表示式为
)为原料制备磷酸亚铁锂。基态Cl原子价电子的轨道表示式为(2)锂离子电池可采用离子液体作为电解质,以下为2种离子液体的结构。

化合物Ⅰ中碳原子的杂化轨道类型为
(3)实验室可利用硝酸锰受热分解的方式制备锰的一种氧化物(晶胞结构如图所示)。

该锰的氧化物中Mn的化合价为
您最近半年使用:0次
2022高二上·安徽阜阳·竞赛
解题方法
10 . 在初中,我们曾经接触过这样一个模型:

我们称其为“洋葱模型”,因为这个原子模型看起来像一个洋葱,一层一层的……awa
每一层都被称作“能层”,而每个能层能够容纳的电子数都不一样:2,8,18,32……
但是,你是否有过这样的疑惑:
为什么每个能层能够容纳的电子的数目只能是那么多呢……?
这时,我们就要提到另外一个模型了:玻尔模型。
玻尔在提出的模型中规定:电子在一些特定的可能轨道上绕核做圆周运动,离核愈远能量愈高,这如同太阳系中的各大行星,围绕着太阳在不停的运动。
他以这个模型为基础,提出了构造原理,即从氢开始,随核电子数的增加,新增电子填入原子核外“壳层”的顺序,由此开启了用原子结构解释元素周期表的篇章。
我们之前学的“能层”,其前身就是玻尔所提出的“壳层”。
自此之后的5年,原本的“壳层”落实为了所谓的“能层”和“能级”。
在后人的不断努力下,到1936年,德国科学家马德隆以原子光谱事实为依据,最终提出了完整的构造原理。
构造原理是化学中的一种定理,决定了原子、分子和离子中电子在各能级的排布。随核电荷数递增,大多数元素的电中性基态原子的电子按顺序填入核外电子运动轨道,即为构造原理。
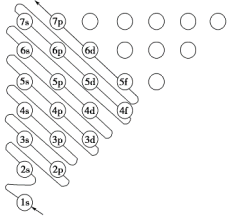
下图中,每个小圆圈表示一个能级。每一行对应一个能层,各圆圈连线的顺序表示随核电荷数递增而增加的电子填入能级的顺序;而另一张图(下)为碳原子的电子排布图:
一、已知以下有关电子排布的定义:
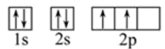
•电子排布式:是表示原子核外电子排布的图式之一、有七个电子层,分别用1、2、3、4、5、6、7等数字表示K、L、M、N、O、P、Q等电子层,用s、p、d、f等符号分别表示各电子亚层,并在这些符号右上角用数字表示各亚层上电子的数目。迄今为止,只发现了7个电子层。
•能量最低原理: 自然界一个普遍的规律是"能量越低越稳定"。原子中的电子也是如此。在不违反泡利原理、和洪特规则的条件下,电子优先占据能量较低的原子轨道,使整个原子体系能量处于最低,这样的状态是原子的基态。
•洪特规则:电子尽可能的占据不同轨道,自旋方向相同。
•泡利不相容原理:在一个能量最低的体系中,没有两个电子的四个量子数是完全相同的。
•能级交错:电子层数较大的某些轨道的能量反低于电子层数较小的某些轨道能量的现象。
•电子自旋:电子不仅在核外空间不停地运动,而且还作自旋运动。电子自旋有两种状态,相当于顺时针和逆时针两种方向。每个轨道最多容纳2个自旋方向相反的电子。同一轨道中的2个电子称成对电子,若一个轨道中只有1个电子,该电子被称为单电子。
•价层电子:指原子核外电子中能与其他原子相互作用形成化学键,跟元素化合价有关的电子,又称价电子。
•价层:就是显现化合价的电子层,通常指原子的最外层电子层。
•电负性:周期表中各元素的原子吸引电子能力的一种相对标度 。又称负电性。元素的电负性愈大,吸引电子的倾向愈大,非金属性也愈强。一般认为,电负性大于1.8的是非金属元素,小于1.8的是金属元素,在1.8左右的元素既有金属性又有非金属性。而一般构成元素的电负性差值在0.6~1.7左右的化合物都是共价化合物。
且已知原子中的每一个电子都具有一个不同的运动状态,Re原子共有14个能级,价层共有7个运动状态不同的电子:
(1)写出基态Re原子的价层电子排布图:_______ 。
(2)写出与Re同族的原子序数最小的+2价离子基态核外电子排布式:___ 。
(3)Re的电负性是1.9,Cl的电负性是3.0,ReCl3的熔点为723℃,沸点800~850℃,500℃真空升华。据此判断ReCl3是_______ (选填“共价”,“离子”)化合物。
(4)试推测N能层最多只能容纳32个电子的原因:_____ 。
二、解决了第一个问题之后,我们就成功的来到了第二个问题:
很多同学都知道,CO2和H2O明明都是3个原子,为什么CO2的空间结构是直线形,而H2O的空间结构却是V形呢?
对于下面的问题,这里我们要介绍3个知识点:价层电子对互斥模型、杂化轨道理论和大π键。
价层电子对互斥模型,又称VSEPR模型,是将共用电子对与孤对电子的概念,与原子轨道的概念相结合,且电子斥力达到最小。在这个模型中电子对相互排斥,成键电子与孤对电子距离越远越好。VSEPR模型以最简单的方法形象化了化学变化,也很容易判断物质的空间构型,并且去除孤电子对的VSEPR模型就是实际情况下的空间结构。
而孤电子对(英语:lone pair,或称孤对电子)是不与其他原子结合或共享的成对价电子。存在于原子的最外围电子壳层。 孤对电子在分子中的存在和分配影响分子的形状等,对轻原子组成的分子影响尤为显著。指分子中未成键的价电子对。
对于孤对电子,有以下计算公式: 值得注意的是,中心原子为多个相同原子时,该公式的计算结果为每一个原子上的孤对电子数,而不是中心原子孤对电子数的总和。
值得注意的是,中心原子为多个相同原子时,该公式的计算结果为每一个原子上的孤对电子数,而不是中心原子孤对电子数的总和。
(5)试计算H2O中孤电子对的对数:_______ 对。
杂化轨道理论:
杂化轨道理论是一种科学理论。在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重新组合,形成一组新的轨道,这个过程叫做轨道的杂化,产生的新轨道叫做杂化轨道。只有最外电子层中不同能级中的电子可以进行轨道杂化,且在第一层的两个电子不参与反应。不同能级中的电子在进行轨道杂化时,电子会从能量低的层跃迁到能量高的层,并且杂化以后的各电子轨道能量相等(等性杂化),同时又高于原来能量较低的能级的能量,低于原来能量较高的能级的能量。当然的,有几个原子轨道参加杂化,杂化后就生成几个杂化轨道。
那么,我们该如何计算杂化轨道的数量呢?
计算公式在这里哦(中心原子的轨道数):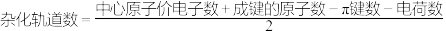
比如,PO 中P原子的杂化情况为
中P原子的杂化情况为 个轨道参与杂化,也就是sp3杂化。
个轨道参与杂化,也就是sp3杂化。
很多同学看到公式就有些懵了:π键数该如何计算呢?
这里我们要讲第三个知识点:大π键。
你可能觉得CO2分子中有两个C=O,但事实上,那真的是碳氧双键吗?
事实上,CO2中的那两个π键看成普通π键只是为了方便我们的理解,而那两个π键应该属于大π键,而他的孤对电子也因此被拿去。
我们先来看一下轨道的电子云模型(一种用来描述电子在原子核外空间某处出现机会(几率)的大小的模型,毕竟根据量子力学相关的定义,我们无法同时获得电子的位置和此时的时刻):
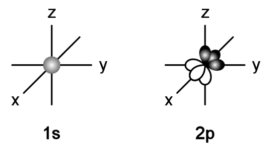
细心的同学可以发现,2p轨道其实是由3个相同结构构造成的,我们根据其朝向分别命名为2px、2py和2pz。
我们常见的π键,就是2p轨道的电子云通过侧面“肩碰肩”的方式形成的。
只是,大π键(离域π键)的形成和π键要求不同:
1. 一般情况下,所有参与形成离域π键的原子必须在同一直线或同一平面上。
2. 一般情况下,参与离域π键的原子都必须提供一个或两个互相平行的p轨道。
3. 一般情况下,形成离域π键的p电子的总数小于p轨道数的两倍。
大π键的常见表示方法: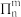 ,其中n为原子个数,m为共用电子个数,m≤2n。
,其中n为原子个数,m为共用电子个数,m≤2n。
那么,m的值应该如何计算呢?
计算公式如下: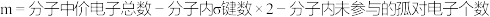
(6)试计算CO2分子中大π键的数量和对应的大π键表示:_______ 。
(7)写出CO2分子中C原子的杂化情况:_______ 。
到了这里,相信你已经能够解决题干刚开始给出的那个问题了:为什么CO2的空间结构是直线形,而H2O的空间结构却是V形呢?
已知电子对的数量和其对应的VSEPR模型如下表所示:
(8)写出N2O4一个中心原子的杂化情况和其对应的空间结构:_______ ;_______ 。

我们称其为“洋葱模型”,因为这个原子模型看起来像一个洋葱,一层一层的……awa
每一层都被称作“能层”,而每个能层能够容纳的电子数都不一样:2,8,18,32……
但是,你是否有过这样的疑惑:
为什么每个能层能够容纳的电子的数目只能是那么多呢……?
这时,我们就要提到另外一个模型了:玻尔模型。
玻尔在提出的模型中规定:电子在一些特定的可能轨道上绕核做圆周运动,离核愈远能量愈高,这如同太阳系中的各大行星,围绕着太阳在不停的运动。
他以这个模型为基础,提出了构造原理,即从氢开始,随核电子数的增加,新增电子填入原子核外“壳层”的顺序,由此开启了用原子结构解释元素周期表的篇章。
我们之前学的“能层”,其前身就是玻尔所提出的“壳层”。
自此之后的5年,原本的“壳层”落实为了所谓的“能层”和“能级”。
在后人的不断努力下,到1936年,德国科学家马德隆以原子光谱事实为依据,最终提出了完整的构造原理。
构造原理是化学中的一种定理,决定了原子、分子和离子中电子在各能级的排布。随核电荷数递增,大多数元素的电中性基态原子的电子按顺序填入核外电子运动轨道,即为构造原理。
下图中,每个小圆圈表示一个能级。每一行对应一个能层,各圆圈连线的顺序表示随核电荷数递增而增加的电子填入能级的顺序;而另一张图(下)为碳原子的电子排布图:

一、已知以下有关电子排布的定义:

•电子排布式:是表示原子核外电子排布的图式之一、有七个电子层,分别用1、2、3、4、5、6、7等数字表示K、L、M、N、O、P、Q等电子层,用s、p、d、f等符号分别表示各电子亚层,并在这些符号右上角用数字表示各亚层上电子的数目。迄今为止,只发现了7个电子层。
•能量最低原理: 自然界一个普遍的规律是"能量越低越稳定"。原子中的电子也是如此。在不违反泡利原理、和洪特规则的条件下,电子优先占据能量较低的原子轨道,使整个原子体系能量处于最低,这样的状态是原子的基态。
•洪特规则:电子尽可能的占据不同轨道,自旋方向相同。
•泡利不相容原理:在一个能量最低的体系中,没有两个电子的四个量子数是完全相同的。
•能级交错:电子层数较大的某些轨道的能量反低于电子层数较小的某些轨道能量的现象。
•电子自旋:电子不仅在核外空间不停地运动,而且还作自旋运动。电子自旋有两种状态,相当于顺时针和逆时针两种方向。每个轨道最多容纳2个自旋方向相反的电子。同一轨道中的2个电子称成对电子,若一个轨道中只有1个电子,该电子被称为单电子。
•价层电子:指原子核外电子中能与其他原子相互作用形成化学键,跟元素化合价有关的电子,又称价电子。
•价层:就是显现化合价的电子层,通常指原子的最外层电子层。
•电负性:周期表中各元素的原子吸引电子能力的一种相对标度 。又称负电性。元素的电负性愈大,吸引电子的倾向愈大,非金属性也愈强。一般认为,电负性大于1.8的是非金属元素,小于1.8的是金属元素,在1.8左右的元素既有金属性又有非金属性。而一般构成元素的电负性差值在0.6~1.7左右的化合物都是共价化合物。
且已知原子中的每一个电子都具有一个不同的运动状态,Re原子共有14个能级,价层共有7个运动状态不同的电子:
(1)写出基态Re原子的价层电子排布图:
(2)写出与Re同族的原子序数最小的+2价离子基态核外电子排布式:
(3)Re的电负性是1.9,Cl的电负性是3.0,ReCl3的熔点为723℃,沸点800~850℃,500℃真空升华。据此判断ReCl3是
(4)试推测N能层最多只能容纳32个电子的原因:
二、解决了第一个问题之后,我们就成功的来到了第二个问题:
很多同学都知道,CO2和H2O明明都是3个原子,为什么CO2的空间结构是直线形,而H2O的空间结构却是V形呢?
对于下面的问题,这里我们要介绍3个知识点:价层电子对互斥模型、杂化轨道理论和大π键。
价层电子对互斥模型,又称VSEPR模型,是将共用电子对与孤对电子的概念,与原子轨道的概念相结合,且电子斥力达到最小。在这个模型中电子对相互排斥,成键电子与孤对电子距离越远越好。VSEPR模型以最简单的方法形象化了化学变化,也很容易判断物质的空间构型,并且去除孤电子对的VSEPR模型就是实际情况下的空间结构。
而孤电子对(英语:lone pair,或称孤对电子)是不与其他原子结合或共享的成对价电子。存在于原子的最外围电子壳层。 孤对电子在分子中的存在和分配影响分子的形状等,对轻原子组成的分子影响尤为显著。指分子中未成键的价电子对。
对于孤对电子,有以下计算公式:
 值得注意的是,中心原子为多个相同原子时,该公式的计算结果为每一个原子上的孤对电子数,而不是中心原子孤对电子数的总和。
值得注意的是,中心原子为多个相同原子时,该公式的计算结果为每一个原子上的孤对电子数,而不是中心原子孤对电子数的总和。(5)试计算H2O中孤电子对的对数:
杂化轨道理论:
杂化轨道理论是一种科学理论。在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重新组合,形成一组新的轨道,这个过程叫做轨道的杂化,产生的新轨道叫做杂化轨道。只有最外电子层中不同能级中的电子可以进行轨道杂化,且在第一层的两个电子不参与反应。不同能级中的电子在进行轨道杂化时,电子会从能量低的层跃迁到能量高的层,并且杂化以后的各电子轨道能量相等(等性杂化),同时又高于原来能量较低的能级的能量,低于原来能量较高的能级的能量。当然的,有几个原子轨道参加杂化,杂化后就生成几个杂化轨道。
那么,我们该如何计算杂化轨道的数量呢?
计算公式在这里哦(中心原子的轨道数):
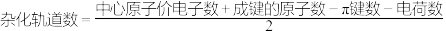
比如,PO
 中P原子的杂化情况为
中P原子的杂化情况为 个轨道参与杂化,也就是sp3杂化。
个轨道参与杂化,也就是sp3杂化。很多同学看到公式就有些懵了:π键数该如何计算呢?
这里我们要讲第三个知识点:大π键。
你可能觉得CO2分子中有两个C=O,但事实上,那真的是碳氧双键吗?
事实上,CO2中的那两个π键看成普通π键只是为了方便我们的理解,而那两个π键应该属于大π键,而他的孤对电子也因此被拿去。
我们先来看一下轨道的电子云模型(一种用来描述电子在原子核外空间某处出现机会(几率)的大小的模型,毕竟根据量子力学相关的定义,我们无法同时获得电子的位置和此时的时刻):

细心的同学可以发现,2p轨道其实是由3个相同结构构造成的,我们根据其朝向分别命名为2px、2py和2pz。
我们常见的π键,就是2p轨道的电子云通过侧面“肩碰肩”的方式形成的。
只是,大π键(离域π键)的形成和π键要求不同:
1. 一般情况下,所有参与形成离域π键的原子必须在同一直线或同一平面上。
2. 一般情况下,参与离域π键的原子都必须提供一个或两个互相平行的p轨道。
3. 一般情况下,形成离域π键的p电子的总数小于p轨道数的两倍。
大π键的常见表示方法:
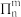 ,其中n为原子个数,m为共用电子个数,m≤2n。
,其中n为原子个数,m为共用电子个数,m≤2n。那么,m的值应该如何计算呢?
计算公式如下:
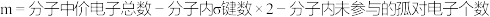
(6)试计算CO2分子中大π键的数量和对应的大π键表示:
(7)写出CO2分子中C原子的杂化情况:
到了这里,相信你已经能够解决题干刚开始给出的那个问题了:为什么CO2的空间结构是直线形,而H2O的空间结构却是V形呢?
已知电子对的数量和其对应的VSEPR模型如下表所示:
| 电子对数 | VSEPR模型 |
| 2 | 直线型 |
| 3 | 平面三角形(sp2杂化) 三角锥形(sp3杂化) |
| 4 | 四面体(正四面体) |
| 5 | 三角双锥型 |
| 6 | 正八面体 |
您最近半年使用:0次



