名校
1 . SiCl4与N-甲基咪唑(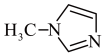 )反应可以得到M2+,其结构如图所示:
)反应可以得到M2+,其结构如图所示:
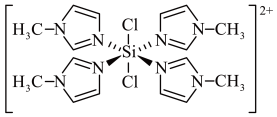
| A.N-甲基咪唑分子中氮原子的杂化轨道类型为sp2和sp3 |
| B.H、C、N的电负性由大到小的顺序为N>C>H |
| C.1个M2+中含有54个σ键(包括配键) |
| D.中心原子硅的氧化数为+6 |
您最近半年使用:0次
名校
2 . 按自由基稳定性由大到小排列的顺序是

| A.cadb | B.cdab | C.acdb | D.acbd |
您最近半年使用:0次
名校
解题方法
3 . 根据电子效应的知识判断下列物质的酸性最强的是
| A.FCH2COOH | B.BrCH2COOH | C.CH3COOH | D.CH3CH2COOH |
您最近半年使用:0次
4 . 下列原子结构参数相比较正确的是
A.半径差: | B.电离能: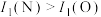 |
C.亲和能: | D.电负性: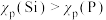 |
您最近半年使用:0次
5 . 短周期主族元素X、Y、Z、M的原子序数依次增大,Z的基态原子的2p轨道半充满,M的最高正价与最低负价的绝对值之差为4,由这4种元素组成的一种分子的结构如图所示。下列说法正确的是
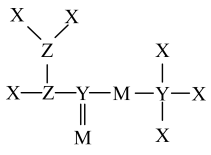

| A.电负性:M<Y |
| B.Y氢化物的沸点可能高于Z氢化物的沸点 |
| C.第一电离能:Y>Z |
| D.X与Z、M形成的化合物中,一定不含离子键 |
您最近半年使用:0次
解题方法
6 . W、X、Y、Z为原子序数依次增大的短周期主族元素,Z原子的质子数等于W原子与Y原子质子数之和,W的价层电子数为偶数,X原子核外未成对电子数与W的相同,四种元素中只有Y为金属元素。下列说法正确的是
A.第一电离能: |
| B.X与Y形成的化合物可能含有共价键 |
C.电负性: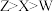 |
| D.W与Z形成的化合物具有可燃性 |
您最近半年使用:0次
2022高二上·安徽阜阳·竞赛
解题方法
7 . 在初中,我们曾经接触过这样一个模型:

我们称其为“洋葱模型”,因为这个原子模型看起来像一个洋葱,一层一层的……awa
每一层都被称作“能层”,而每个能层能够容纳的电子数都不一样:2,8,18,32……
但是,你是否有过这样的疑惑:
为什么每个能层能够容纳的电子的数目只能是那么多呢……?
这时,我们就要提到另外一个模型了:玻尔模型。
玻尔在提出的模型中规定:电子在一些特定的可能轨道上绕核做圆周运动,离核愈远能量愈高,这如同太阳系中的各大行星,围绕着太阳在不停的运动。
他以这个模型为基础,提出了构造原理,即从氢开始,随核电子数的增加,新增电子填入原子核外“壳层”的顺序,由此开启了用原子结构解释元素周期表的篇章。
我们之前学的“能层”,其前身就是玻尔所提出的“壳层”。
自此之后的5年,原本的“壳层”落实为了所谓的“能层”和“能级”。
在后人的不断努力下,到1936年,德国科学家马德隆以原子光谱事实为依据,最终提出了完整的构造原理。
构造原理是化学中的一种定理,决定了原子、分子和离子中电子在各能级的排布。随核电荷数递增,大多数元素的电中性基态原子的电子按顺序填入核外电子运动轨道,即为构造原理。
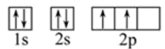
下图中,每个小圆圈表示一个能级。每一行对应一个能层,各圆圈连线的顺序表示随核电荷数递增而增加的电子填入能级的顺序;而另一张图(下)为碳原子的电子排布图:
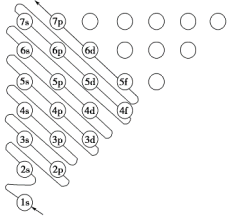
一、已知以下有关电子排布的定义:
•电子排布式:是表示原子核外电子排布的图式之一、有七个电子层,分别用1、2、3、4、5、6、7等数字表示K、L、M、N、O、P、Q等电子层,用s、p、d、f等符号分别表示各电子亚层,并在这些符号右上角用数字表示各亚层上电子的数目。迄今为止,只发现了7个电子层。
•能量最低原理: 自然界一个普遍的规律是"能量越低越稳定"。原子中的电子也是如此。在不违反泡利原理、和洪特规则的条件下,电子优先占据能量较低的原子轨道,使整个原子体系能量处于最低,这样的状态是原子的基态。
•洪特规则:电子尽可能的占据不同轨道,自旋方向相同。
•泡利不相容原理:在一个能量最低的体系中,没有两个电子的四个量子数是完全相同的。
•能级交错:电子层数较大的某些轨道的能量反低于电子层数较小的某些轨道能量的现象。
•电子自旋:电子不仅在核外空间不停地运动,而且还作自旋运动。电子自旋有两种状态,相当于顺时针和逆时针两种方向。每个轨道最多容纳2个自旋方向相反的电子。同一轨道中的2个电子称成对电子,若一个轨道中只有1个电子,该电子被称为单电子。
•价层电子:指原子核外电子中能与其他原子相互作用形成化学键,跟元素化合价有关的电子,又称价电子。
•价层:就是显现化合价的电子层,通常指原子的最外层电子层。
•电负性:周期表中各元素的原子吸引电子能力的一种相对标度 。又称负电性。元素的电负性愈大,吸引电子的倾向愈大,非金属性也愈强。一般认为,电负性大于1.8的是非金属元素,小于1.8的是金属元素,在1.8左右的元素既有金属性又有非金属性。而一般构成元素的电负性差值在0.6~1.7左右的化合物都是共价化合物。
且已知原子中的每一个电子都具有一个不同的运动状态,Re原子共有14个能级,价层共有7个运动状态不同的电子:
(1)写出基态Re原子的价层电子排布图:_______ 。
(2)写出与Re同族的原子序数最小的+2价离子基态核外电子排布式:___ 。
(3)Re的电负性是1.9,Cl的电负性是3.0,ReCl3的熔点为723℃,沸点800~850℃,500℃真空升华。据此判断ReCl3是_______ (选填“共价”,“离子”)化合物。
(4)试推测N能层最多只能容纳32个电子的原因:_____ 。
二、解决了第一个问题之后,我们就成功的来到了第二个问题:
很多同学都知道,CO2和H2O明明都是3个原子,为什么CO2的空间结构是直线形,而H2O的空间结构却是V形呢?
对于下面的问题,这里我们要介绍3个知识点:价层电子对互斥模型、杂化轨道理论和大π键。
价层电子对互斥模型,又称VSEPR模型,是将共用电子对与孤对电子的概念,与原子轨道的概念相结合,且电子斥力达到最小。在这个模型中电子对相互排斥,成键电子与孤对电子距离越远越好。VSEPR模型以最简单的方法形象化了化学变化,也很容易判断物质的空间构型,并且去除孤电子对的VSEPR模型就是实际情况下的空间结构。
而孤电子对(英语:lone pair,或称孤对电子)是不与其他原子结合或共享的成对价电子。存在于原子的最外围电子壳层。 孤对电子在分子中的存在和分配影响分子的形状等,对轻原子组成的分子影响尤为显著。指分子中未成键的价电子对。
对于孤对电子,有以下计算公式: 值得注意的是,中心原子为多个相同原子时,该公式的计算结果为每一个原子上的孤对电子数,而不是中心原子孤对电子数的总和。
值得注意的是,中心原子为多个相同原子时,该公式的计算结果为每一个原子上的孤对电子数,而不是中心原子孤对电子数的总和。
(5)试计算H2O中孤电子对的对数:_______ 对。
杂化轨道理论:
杂化轨道理论是一种科学理论。在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重新组合,形成一组新的轨道,这个过程叫做轨道的杂化,产生的新轨道叫做杂化轨道。只有最外电子层中不同能级中的电子可以进行轨道杂化,且在第一层的两个电子不参与反应。不同能级中的电子在进行轨道杂化时,电子会从能量低的层跃迁到能量高的层,并且杂化以后的各电子轨道能量相等(等性杂化),同时又高于原来能量较低的能级的能量,低于原来能量较高的能级的能量。当然的,有几个原子轨道参加杂化,杂化后就生成几个杂化轨道。
那么,我们该如何计算杂化轨道的数量呢?
计算公式在这里哦(中心原子的轨道数):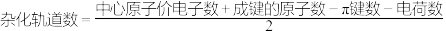
比如,PO 中P原子的杂化情况为
中P原子的杂化情况为 个轨道参与杂化,也就是sp3杂化。
个轨道参与杂化,也就是sp3杂化。
很多同学看到公式就有些懵了:π键数该如何计算呢?
这里我们要讲第三个知识点:大π键。
你可能觉得CO2分子中有两个C=O,但事实上,那真的是碳氧双键吗?
事实上,CO2中的那两个π键看成普通π键只是为了方便我们的理解,而那两个π键应该属于大π键,而他的孤对电子也因此被拿去。
我们先来看一下轨道的电子云模型(一种用来描述电子在原子核外空间某处出现机会(几率)的大小的模型,毕竟根据量子力学相关的定义,我们无法同时获得电子的位置和此时的时刻):
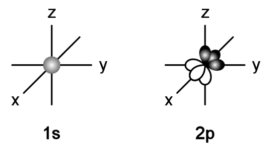
细心的同学可以发现,2p轨道其实是由3个相同结构构造成的,我们根据其朝向分别命名为2px、2py和2pz。
我们常见的π键,就是2p轨道的电子云通过侧面“肩碰肩”的方式形成的。
只是,大π键(离域π键)的形成和π键要求不同:
1. 一般情况下,所有参与形成离域π键的原子必须在同一直线或同一平面上。
2. 一般情况下,参与离域π键的原子都必须提供一个或两个互相平行的p轨道。
3. 一般情况下,形成离域π键的p电子的总数小于p轨道数的两倍。
大π键的常见表示方法: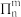 ,其中n为原子个数,m为共用电子个数,m≤2n。
,其中n为原子个数,m为共用电子个数,m≤2n。
那么,m的值应该如何计算呢?
计算公式如下: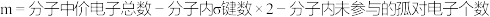
(6)试计算CO2分子中大π键的数量和对应的大π键表示:_______ 。
(7)写出CO2分子中C原子的杂化情况:_______ 。
到了这里,相信你已经能够解决题干刚开始给出的那个问题了:为什么CO2的空间结构是直线形,而H2O的空间结构却是V形呢?
已知电子对的数量和其对应的VSEPR模型如下表所示:
(8)写出N2O4一个中心原子的杂化情况和其对应的空间结构:_______ ;_______ 。

我们称其为“洋葱模型”,因为这个原子模型看起来像一个洋葱,一层一层的……awa
每一层都被称作“能层”,而每个能层能够容纳的电子数都不一样:2,8,18,32……
但是,你是否有过这样的疑惑:
为什么每个能层能够容纳的电子的数目只能是那么多呢……?
这时,我们就要提到另外一个模型了:玻尔模型。
玻尔在提出的模型中规定:电子在一些特定的可能轨道上绕核做圆周运动,离核愈远能量愈高,这如同太阳系中的各大行星,围绕着太阳在不停的运动。
他以这个模型为基础,提出了构造原理,即从氢开始,随核电子数的增加,新增电子填入原子核外“壳层”的顺序,由此开启了用原子结构解释元素周期表的篇章。
我们之前学的“能层”,其前身就是玻尔所提出的“壳层”。
自此之后的5年,原本的“壳层”落实为了所谓的“能层”和“能级”。
在后人的不断努力下,到1936年,德国科学家马德隆以原子光谱事实为依据,最终提出了完整的构造原理。
构造原理是化学中的一种定理,决定了原子、分子和离子中电子在各能级的排布。随核电荷数递增,大多数元素的电中性基态原子的电子按顺序填入核外电子运动轨道,即为构造原理。
下图中,每个小圆圈表示一个能级。每一行对应一个能层,各圆圈连线的顺序表示随核电荷数递增而增加的电子填入能级的顺序;而另一张图(下)为碳原子的电子排布图:

一、已知以下有关电子排布的定义:

•电子排布式:是表示原子核外电子排布的图式之一、有七个电子层,分别用1、2、3、4、5、6、7等数字表示K、L、M、N、O、P、Q等电子层,用s、p、d、f等符号分别表示各电子亚层,并在这些符号右上角用数字表示各亚层上电子的数目。迄今为止,只发现了7个电子层。
•能量最低原理: 自然界一个普遍的规律是"能量越低越稳定"。原子中的电子也是如此。在不违反泡利原理、和洪特规则的条件下,电子优先占据能量较低的原子轨道,使整个原子体系能量处于最低,这样的状态是原子的基态。
•洪特规则:电子尽可能的占据不同轨道,自旋方向相同。
•泡利不相容原理:在一个能量最低的体系中,没有两个电子的四个量子数是完全相同的。
•能级交错:电子层数较大的某些轨道的能量反低于电子层数较小的某些轨道能量的现象。
•电子自旋:电子不仅在核外空间不停地运动,而且还作自旋运动。电子自旋有两种状态,相当于顺时针和逆时针两种方向。每个轨道最多容纳2个自旋方向相反的电子。同一轨道中的2个电子称成对电子,若一个轨道中只有1个电子,该电子被称为单电子。
•价层电子:指原子核外电子中能与其他原子相互作用形成化学键,跟元素化合价有关的电子,又称价电子。
•价层:就是显现化合价的电子层,通常指原子的最外层电子层。
•电负性:周期表中各元素的原子吸引电子能力的一种相对标度 。又称负电性。元素的电负性愈大,吸引电子的倾向愈大,非金属性也愈强。一般认为,电负性大于1.8的是非金属元素,小于1.8的是金属元素,在1.8左右的元素既有金属性又有非金属性。而一般构成元素的电负性差值在0.6~1.7左右的化合物都是共价化合物。
且已知原子中的每一个电子都具有一个不同的运动状态,Re原子共有14个能级,价层共有7个运动状态不同的电子:
(1)写出基态Re原子的价层电子排布图:
(2)写出与Re同族的原子序数最小的+2价离子基态核外电子排布式:
(3)Re的电负性是1.9,Cl的电负性是3.0,ReCl3的熔点为723℃,沸点800~850℃,500℃真空升华。据此判断ReCl3是
(4)试推测N能层最多只能容纳32个电子的原因:
二、解决了第一个问题之后,我们就成功的来到了第二个问题:
很多同学都知道,CO2和H2O明明都是3个原子,为什么CO2的空间结构是直线形,而H2O的空间结构却是V形呢?
对于下面的问题,这里我们要介绍3个知识点:价层电子对互斥模型、杂化轨道理论和大π键。
价层电子对互斥模型,又称VSEPR模型,是将共用电子对与孤对电子的概念,与原子轨道的概念相结合,且电子斥力达到最小。在这个模型中电子对相互排斥,成键电子与孤对电子距离越远越好。VSEPR模型以最简单的方法形象化了化学变化,也很容易判断物质的空间构型,并且去除孤电子对的VSEPR模型就是实际情况下的空间结构。
而孤电子对(英语:lone pair,或称孤对电子)是不与其他原子结合或共享的成对价电子。存在于原子的最外围电子壳层。 孤对电子在分子中的存在和分配影响分子的形状等,对轻原子组成的分子影响尤为显著。指分子中未成键的价电子对。
对于孤对电子,有以下计算公式:
 值得注意的是,中心原子为多个相同原子时,该公式的计算结果为每一个原子上的孤对电子数,而不是中心原子孤对电子数的总和。
值得注意的是,中心原子为多个相同原子时,该公式的计算结果为每一个原子上的孤对电子数,而不是中心原子孤对电子数的总和。(5)试计算H2O中孤电子对的对数:
杂化轨道理论:
杂化轨道理论是一种科学理论。在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重新组合,形成一组新的轨道,这个过程叫做轨道的杂化,产生的新轨道叫做杂化轨道。只有最外电子层中不同能级中的电子可以进行轨道杂化,且在第一层的两个电子不参与反应。不同能级中的电子在进行轨道杂化时,电子会从能量低的层跃迁到能量高的层,并且杂化以后的各电子轨道能量相等(等性杂化),同时又高于原来能量较低的能级的能量,低于原来能量较高的能级的能量。当然的,有几个原子轨道参加杂化,杂化后就生成几个杂化轨道。
那么,我们该如何计算杂化轨道的数量呢?
计算公式在这里哦(中心原子的轨道数):
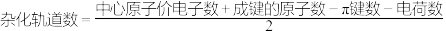
比如,PO
 中P原子的杂化情况为
中P原子的杂化情况为 个轨道参与杂化,也就是sp3杂化。
个轨道参与杂化,也就是sp3杂化。很多同学看到公式就有些懵了:π键数该如何计算呢?
这里我们要讲第三个知识点:大π键。
你可能觉得CO2分子中有两个C=O,但事实上,那真的是碳氧双键吗?
事实上,CO2中的那两个π键看成普通π键只是为了方便我们的理解,而那两个π键应该属于大π键,而他的孤对电子也因此被拿去。
我们先来看一下轨道的电子云模型(一种用来描述电子在原子核外空间某处出现机会(几率)的大小的模型,毕竟根据量子力学相关的定义,我们无法同时获得电子的位置和此时的时刻):

细心的同学可以发现,2p轨道其实是由3个相同结构构造成的,我们根据其朝向分别命名为2px、2py和2pz。
我们常见的π键,就是2p轨道的电子云通过侧面“肩碰肩”的方式形成的。
只是,大π键(离域π键)的形成和π键要求不同:
1. 一般情况下,所有参与形成离域π键的原子必须在同一直线或同一平面上。
2. 一般情况下,参与离域π键的原子都必须提供一个或两个互相平行的p轨道。
3. 一般情况下,形成离域π键的p电子的总数小于p轨道数的两倍。
大π键的常见表示方法:
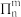 ,其中n为原子个数,m为共用电子个数,m≤2n。
,其中n为原子个数,m为共用电子个数,m≤2n。那么,m的值应该如何计算呢?
计算公式如下:
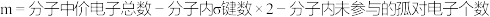
(6)试计算CO2分子中大π键的数量和对应的大π键表示:
(7)写出CO2分子中C原子的杂化情况:
到了这里,相信你已经能够解决题干刚开始给出的那个问题了:为什么CO2的空间结构是直线形,而H2O的空间结构却是V形呢?
已知电子对的数量和其对应的VSEPR模型如下表所示:
| 电子对数 | VSEPR模型 |
| 2 | 直线型 |
| 3 | 平面三角形(sp2杂化) 三角锥形(sp3杂化) |
| 4 | 四面体(正四面体) |
| 5 | 三角双锥型 |
| 6 | 正八面体 |
您最近半年使用:0次
解题方法
8 . 完成下列问题。
(1)基态铬的核外电子排布式是:_______ ,其在周期表中的位置是_______ 。
(2) 可以形成的一种配合物是
可以形成的一种配合物是 ,
, 表示的是
表示的是 。其中
。其中 的VSEPR模型为
的VSEPR模型为_______ , 分子中,各元素的电负性由大到小的顺序为
分子中,各元素的电负性由大到小的顺序为_______ 。
(3)在极性分子中,正电荷重心和负电荷重心间的距离称为偶极长,用d表示。极性分子的极性强弱和偶极长,电荷重心的电量q有关,用偶极矩μ衡量,其定义为μ=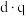 。
。
①请写出一种μ=0的分子_______ 。
②对硝基氯苯,邻硝基氯苯,间硝基氯苯三种分子的偶极矩由大到小的顺序为_______ 。
③治癌药物 有平面四边形结构,
有平面四边形结构, 位于四边形的中心,
位于四边形的中心, 和
和 位于四边形的四个角上。已知该化合物有两种异构体,a的μ≠0、b的μ=0,则这两者在水中的溶解度大小顺序为
位于四边形的四个角上。已知该化合物有两种异构体,a的μ≠0、b的μ=0,则这两者在水中的溶解度大小顺序为_______ 。
(4)铁有δ、γ、α三种晶体,以下为这三种晶体在不同温度下转化的图示。
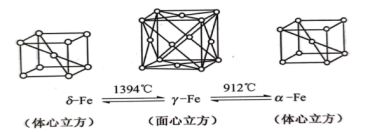
① 晶体中
晶体中 原子的配位数是
原子的配位数是_______ 。
②若 晶胞边长为a,
晶胞边长为a, 晶胞边长为b,则这两种晶体的密度比为
晶胞边长为b,则这两种晶体的密度比为_______ 。
(1)基态铬的核外电子排布式是:
(2)
 可以形成的一种配合物是
可以形成的一种配合物是 ,
, 表示的是
表示的是 。其中
。其中 的VSEPR模型为
的VSEPR模型为 分子中,各元素的电负性由大到小的顺序为
分子中,各元素的电负性由大到小的顺序为(3)在极性分子中,正电荷重心和负电荷重心间的距离称为偶极长,用d表示。极性分子的极性强弱和偶极长,电荷重心的电量q有关,用偶极矩μ衡量,其定义为μ=
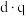 。
。①请写出一种μ=0的分子
②对硝基氯苯,邻硝基氯苯,间硝基氯苯三种分子的偶极矩由大到小的顺序为
③治癌药物
 有平面四边形结构,
有平面四边形结构, 位于四边形的中心,
位于四边形的中心, 和
和 位于四边形的四个角上。已知该化合物有两种异构体,a的μ≠0、b的μ=0,则这两者在水中的溶解度大小顺序为
位于四边形的四个角上。已知该化合物有两种异构体,a的μ≠0、b的μ=0,则这两者在水中的溶解度大小顺序为(4)铁有δ、γ、α三种晶体,以下为这三种晶体在不同温度下转化的图示。

①
 晶体中
晶体中 原子的配位数是
原子的配位数是②若
 晶胞边长为a,
晶胞边长为a, 晶胞边长为b,则这两种晶体的密度比为
晶胞边长为b,则这两种晶体的密度比为
您最近半年使用:0次
解题方法
9 . 某种阴离子如图所示,X、Y、W、Z四种元素为原子序数依次增大的短周期主族元素,Y和W位于同周期。下列说法正确的是


A.元素的电负性: |
B.X、Y、W、Z的简单氢化物的沸点: |
| C.同周期元素第一电离能大于X的有2种 |
D. 分别与X、Y、W、Z形成的化合物中,均不含非极性键 分别与X、Y、W、Z形成的化合物中,均不含非极性键 |
您最近半年使用:0次
10 . 下列叙述不正确的是
| A.在C-F、C-O、C-Si、C-Cl等化学键中碳的正电性最强的是C-F |
| B.电子构型为[Xe]4f145d76s2的元素是第IIA元素 |
| C.在Ga3+、Ti4+、Cu+、Li+4种离子中最外层电子数为8的是Ti4+ |
| D.目前应用最多的太阳能电池的光电转化材料是硅 |
您最近半年使用:0次



