名校
解题方法
1 . 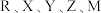 五种短周期主族元素,原子序数依次增大,R元素的原子最外层电子排布式为
五种短周期主族元素,原子序数依次增大,R元素的原子最外层电子排布式为 与M同主族,且M元素的原子序数为Y元素的2倍,Z是同周期元素中原子半径最大的元素,下列说法错误的是
与M同主族,且M元素的原子序数为Y元素的2倍,Z是同周期元素中原子半径最大的元素,下列说法错误的是
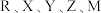 五种短周期主族元素,原子序数依次增大,R元素的原子最外层电子排布式为
五种短周期主族元素,原子序数依次增大,R元素的原子最外层电子排布式为 与M同主族,且M元素的原子序数为Y元素的2倍,Z是同周期元素中原子半径最大的元素,下列说法错误的是
与M同主族,且M元素的原子序数为Y元素的2倍,Z是同周期元素中原子半径最大的元素,下列说法错误的是A.电负性: | B.氢化物的沸点: |
| C.Z与Y形成的化合物中可能含有非极性共价键 | D.等物质的量浓度的 最高价氧化物对应的水化物水溶液酸性依次递增 最高价氧化物对应的水化物水溶液酸性依次递增 |
您最近半年使用:0次
名校
解题方法
2 . 硼和氮的化合物在生产、生活和科研中应用广泛。回答下列问题:
(1)基态N原子电子自旋量子数和为___________ ,其价电子中成对电子数与未成对电子数之比是___________ 。
(2)硼烷-吡啶(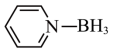 )是一种中等强度的还原性试剂,在质子性溶剂中,它的稳定性和溶解性均优于硼氢化钠(NaBH4),则硼氢化钠晶体类型是
)是一种中等强度的还原性试剂,在质子性溶剂中,它的稳定性和溶解性均优于硼氢化钠(NaBH4),则硼氢化钠晶体类型是___________ 。硼烷-吡啶组成元素属于第二周期的电负性从大到小的顺序是___________ 。
(3)吡啶(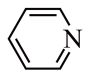 )和吡咯(
)和吡咯(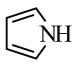 )均含有大
)均含有大 健,相同条件下,熔点吡啶
健,相同条件下,熔点吡啶___________ 吡咯(填“大于”或“小于”),其原因是___________ 。
(4)Ca与B组成的金属硼化物结构如图所示,硼原子全部组成B6正八面体,各个顶点通过B-B键互相连接成三维骨架,具有立方晶系的对称性。该晶体的化学式为___________ 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如M点原子的分数坐标为( ,
, ,
, ),已知B6八面体中B -B键的键长为r pm,晶胞参数为a pm,则N点原子的分数坐标为
),已知B6八面体中B -B键的键长为r pm,晶胞参数为a pm,则N点原子的分数坐标为 ___________ ,Ca与 B 原子间的最短距离d=___________ pm(列出计算式即可)。
(1)基态N原子电子自旋量子数和为
(2)硼烷-吡啶(
 )是一种中等强度的还原性试剂,在质子性溶剂中,它的稳定性和溶解性均优于硼氢化钠(NaBH4),则硼氢化钠晶体类型是
)是一种中等强度的还原性试剂,在质子性溶剂中,它的稳定性和溶解性均优于硼氢化钠(NaBH4),则硼氢化钠晶体类型是(3)吡啶(
 )和吡咯(
)和吡咯( )均含有大
)均含有大 健,相同条件下,熔点吡啶
健,相同条件下,熔点吡啶(4)Ca与B组成的金属硼化物结构如图所示,硼原子全部组成B6正八面体,各个顶点通过B-B键互相连接成三维骨架,具有立方晶系的对称性。该晶体的化学式为
 ,
, ,
, ),已知B6八面体中B -B键的键长为r pm,晶胞参数为a pm,则N点原子的分数坐标为
),已知B6八面体中B -B键的键长为r pm,晶胞参数为a pm,则N点原子的分数坐标为 
您最近半年使用:0次
3 . 下列各元素性质的叙述中,正确的是
| A.N、O、F的电负性依次减小 |
B. 、 、 、 、 的第一电离能依次增大 的第一电离能依次增大 |
| C.若X2+和Y2-具有相同的电子层结构,则离子半径:X2+<Y2- |
D.基态 原子的电子排布式为: 原子的电子排布式为: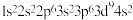 |
您最近半年使用:0次
4 . 下列关于元素或物质性质的比较中,不正确 的是
A.稳定性: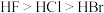 | B.第一电离能: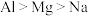 |
C.酸性: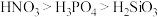 | D.电负性: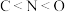 |
您最近半年使用:0次
解题方法
5 . 现有10种元素,其中X、Y、Z、A、E为短周期主族元素,原子序数依次增大;M、R、Q为第4周期元素。X元素原子的核外电子只有一种自旋取向;Y的基态原子核外2个能级上有电子,且每个能级上的电子数相等;Z原子核外有6种运动状态不同的电子。A元素原子核外s能级上的电子总数与p能级上的电子总数相等,但第一电离能都低于同周期相邻元素;E元素原子半径在同周期元素中最大;M是第四周期最外层只有一个电子的元素中原子序数最大的。R的3价阳离子遇KSCN溶液显红色。Q是ds区元素,基态原子核外7个能级上的电子均充满。请根据相关信息回答问题。
(1)Y、Z、A、E四种元素电负性由大到小的顺序:___________ (填元素符号)。Y、Z、A、E四种元素原子半径由大到小的顺序:___________ (填元素符号)。
(2)R元素的基态原子的电子排布式___________ ,占据最高能级电子的电子云轮廓图为___________ 形。Q在周期表中位于第四周期第___________ 族。
(3)X与Z形成的化合物的相对分子质量是26,其分子中σ键与π键的数目之比为___________ 。
(4)Y的氧化物与E的氢氧化物发生化学反应的离子方程式:___________ 。
(5)E在火焰上灼烧产生的黄光是一种___________ 光谱(填“发射”“吸收”)。
(6)从结构角度看,R2+易被氧化成R3+的原因是___________ 。
(7)过渡元素的金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为d0或d10排布时,无颜色,为d1~d9排布时,有颜色,如[R(H2O)6]3+显棕黄色。据此判断,[Q(H2O)4]2+___________ (填“无”或“有”)颜色。
(1)Y、Z、A、E四种元素电负性由大到小的顺序:
(2)R元素的基态原子的电子排布式
(3)X与Z形成的化合物的相对分子质量是26,其分子中σ键与π键的数目之比为
(4)Y的氧化物与E的氢氧化物发生化学反应的离子方程式:
(5)E在火焰上灼烧产生的黄光是一种
(6)从结构角度看,R2+易被氧化成R3+的原因是
(7)过渡元素的金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般而言,为d0或d10排布时,无颜色,为d1~d9排布时,有颜色,如[R(H2O)6]3+显棕黄色。据此判断,[Q(H2O)4]2+
您最近半年使用:0次
6 . 回答下列问题:
(1)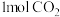 中含有的
中含有的 键数目为
键数目为___________ , 键数目为
键数目为___________ 。
(2)已知CO和 与
与 结构相似,CO分子内
结构相似,CO分子内 键与
键与 键个数之比为
键个数之比为___________ 。 分子中
分子中 键与
键与 键数目之比为
键数目之比为___________ 。
(3)肼 分子可视为
分子可视为 分子中的一个氢原子被
分子中的一个氢原子被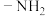 (氨基)取代形成的另一种氮的氢化物。肼可用作火箭燃料,燃烧时发生的反应:
(氨基)取代形成的另一种氮的氢化物。肼可用作火箭燃料,燃烧时发生的反应:
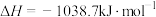 ,若该反应中有
,若该反应中有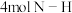 键断裂,则形成的
键断裂,则形成的 键有
键有___________ mol。
(4)Co基态原子核外电子排布式为___________ ; 的价电子轨道表示式为
的价电子轨道表示式为___________ ; 核外电子未成对电子数为
核外电子未成对电子数为___________ 。
(5) 、
、 、
、 、
、 分子中共价键的极性由强到弱的顺序是
分子中共价键的极性由强到弱的顺序是___________ 。
(1)
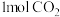 中含有的
中含有的 键数目为
键数目为 键数目为
键数目为(2)已知CO和
 与
与 结构相似,CO分子内
结构相似,CO分子内 键与
键与 键个数之比为
键个数之比为 分子中
分子中 键与
键与 键数目之比为
键数目之比为(3)肼
 分子可视为
分子可视为 分子中的一个氢原子被
分子中的一个氢原子被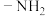 (氨基)取代形成的另一种氮的氢化物。肼可用作火箭燃料,燃烧时发生的反应:
(氨基)取代形成的另一种氮的氢化物。肼可用作火箭燃料,燃烧时发生的反应:
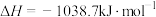 ,若该反应中有
,若该反应中有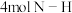 键断裂,则形成的
键断裂,则形成的 键有
键有(4)Co基态原子核外电子排布式为
 的价电子轨道表示式为
的价电子轨道表示式为 核外电子未成对电子数为
核外电子未成对电子数为(5)
 、
、 、
、 、
、 分子中共价键的极性由强到弱的顺序是
分子中共价键的极性由强到弱的顺序是
您最近半年使用:0次
名校
7 . 科学家合成了一种含硼阴离子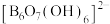 ,其结构如图所示下列叙述错误的是
,其结构如图所示下列叙述错误的是
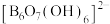 ,其结构如图所示下列叙述错误的是
,其结构如图所示下列叙述错误的是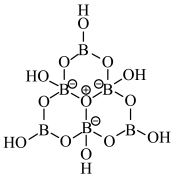
| A.基态硼原子的核外电子的空间运动状态有3种 |
| B.电负性大小为:O>B>H |
| C.该结构中硼原子的杂化方式为sp2、sp3 |
| D.该结构中共有4种不同化学环境的氧原子 |
您最近半年使用:0次
昨日更新
|
151次组卷
|
2卷引用:2024年辽宁省抚顺市普通高中高三下学期模拟考试化学试卷
名校
8 . 下列对事实的分析正确的是
| 选项 | 事实 | 分析 |
| A | 键角: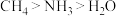 | 电负性:C<N<O |
| B | 第一电离能:P>S | 原子半径:P>S |
| C | 沸点:CO> | CO为极性分子, 为非极性分子 为非极性分子 |
| D | 热稳定性:HF>HCl | HF中存在氢键,HCl中不存在氢键 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
9 . 物质结构决定物质性质。下列性质差异与结构因素匹配错误的是
| 选项 | 性质差异 | 结构因素 |
| A | 酸性:三氟乙酸>三氯乙酸 | 电负性差异 |
| B | 熔点:SiO2>干冰 | 晶体类型差异 |
| C | 溶解性:I2在CCl4中的溶解度大于在水中的溶解度 | 相似相溶 |
| D | 稳定性:H2O的分解温度(3000℃)远大于H2S(900℃) | 有无氢键 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
10 . 中国有广阔的海岸线,建设发展海洋经济、海水的综合利用大有可为。
Ⅰ.目前世界上60%的镁是从海水中提取的,海水提镁的主要流程如下:__________ 。
(2)工业冶炼金属 的化学方程式为
的化学方程式为__________ 。
Ⅱ.空气吹出法工艺,是目前“海水提溴”的最主要方法之一,其工艺流程如下图所示,试回答下列问题: ”,这样进行转化的目的是
”,这样进行转化的目的是__________ 。
(4)步骤Ⅱ通入热空气或水蒸气吹出 ,利用了溴的__________(填序号)。
,利用了溴的__________(填序号)。
(5)写出步骤Ⅱ中涉及的离子反应__________ 。
Ⅲ.最近,科学家开发了一种用二氧化碳淡化海水的技术,其循环图如下: 中H、C、N、O四种元素的电负性
中H、C、N、O四种元素的电负性由大到小 的顺序为__________ 。
Ⅰ.目前世界上60%的镁是从海水中提取的,海水提镁的主要流程如下:
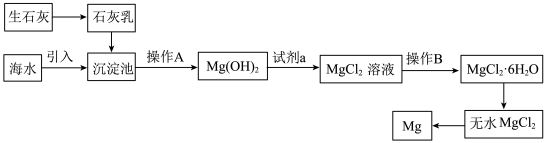
(2)工业冶炼金属
 的化学方程式为
的化学方程式为Ⅱ.空气吹出法工艺,是目前“海水提溴”的最主要方法之一,其工艺流程如下图所示,试回答下列问题:
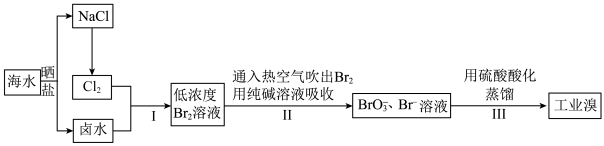
 ”,这样进行转化的目的是
”,这样进行转化的目的是(4)步骤Ⅱ通入热空气或水蒸气吹出
 ,利用了溴的__________(填序号)。
,利用了溴的__________(填序号)。| A.氧化性 | B.还原性 | C.挥发性 | D.腐蚀性 |
(5)写出步骤Ⅱ中涉及的离子反应
Ⅲ.最近,科学家开发了一种用二氧化碳淡化海水的技术,其循环图如下:

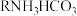 中H、C、N、O四种元素的电负性
中H、C、N、O四种元素的电负性
您最近半年使用:0次



